Bub1和Mad2蛋白在子宫内膜癌中的表达及意义
2013-12-19庄雪仪李爱香
庄雪仪,李 玲,李爱香
2.河南省人口与计划生育科学研究院 生殖科,郑州450052
子宫内膜癌是女性生殖道三大恶性肿瘤之一,近年来发病率在世界范围内呈上升趋势。苯并咪唑出芽抑制解除同源物蛋白-1(Bub1)和有丝分裂阻滞缺陷蛋白-2(Mad2)蛋白是纺锤体关卡的重要组成部分,其功能是监控细胞有丝分裂,保证其过程忠实有序的进行。本研究采用免疫组织化学SP法检测Bub1和Mad2蛋白在人正常子宫内膜、子宫内膜不典型增生和子宫内膜癌中的表达情况,并分析其与子宫内膜癌患者的临床分期、病理分级和淋巴结转移的关系,探讨其在子宫内膜癌发生发展中的作用及临床意义。
1 材料与方法
1.1 一般资料 选取2009年6月-2012年6月确诊为子宫内膜癌的手术切除存档蜡块标本72例,为子宫内膜癌组(A组),年龄(50.37±4.54)岁(42~57岁),其中绝经患者58例。病理类型:内膜样腺癌46例,腺癌伴鳞状上皮化生16例,浆液性腺癌9例,透明细胞癌1例;临床分期:Ⅰ期43例,Ⅱ期19例,Ⅲ期7例,Ⅳ期3例;病理分级:G1(高分化)43例,G2(中分化)20例,G3(低分化)9例;发生淋巴结转移9例,未发生淋巴结转移63例。选取同期子宫内膜不典型增生石蜡包埋组织标本40例,为不典型增生组(B组),年龄(47.87±5.32)岁;正常子宫内膜石蜡包埋组织标本40例,为正常子宫内膜组(C组),年龄(48.63±3.80)岁。3组间年龄差别无统计学意义(P>0.05)。所有患者术前均未接受激素治疗、放疗或化疗。
1.2 方法
1.2.1 试剂 一抗兔抗人多克隆抗体Bub1和Mad2(工作浓度为1∶100,美国Abcom公司);SP试剂盒和DAB显色剂(北京博奥森生物技术有限公司)。
1.2.2 检测方法及判断标准 采用免疫组织化学SP法检测各组中Bub1和Mad2蛋白的表达情况,子宫内膜腺上皮细胞胞质和/或胞核出现黄色或棕黄色颗粒为阳性表达。判定标准:采用半定量、2人双盲法观察结果,每例切片选择10个高倍视野(10×40),按照阳性细胞数占视野中总细胞数的百分比分为4级:无阳性着色或阳性细胞数≤10%为(-),11% ~30% 为 (+),31% ~50% 为 (),≥51%为();(-)为阴性表达,(+)~()为阳性表达[1]。若2人观察结果相差10%则重新评定。
1.3 统计学处理 数据以±s表示,采用SPSS 13.0统计软件处理。定性资料比较采用χ2检验,Bub1和Mad2蛋白的相关性采用Spearman秩相关系数分析,α=0.05设为检验水准。
2 结 果
2.1 Bub1和 Mad2蛋白检测结果 A,B,C组Bub1蛋白的阳性表达率分别为27.78%,57.50%,85.00%;Mad2蛋白的阳性表达率分别为86.11%,57.50%,22.50%;2种蛋白3组间两两比较差别均有统计学意义(P<0.05)。
2.2 Bub1及Mad2蛋白的表达与子宫内膜癌临床病理参数的关系 Bub1蛋白在临床分期为Ⅰ,Ⅱ,Ⅲ,Ⅳ期的患者中的阳性表达率比较差别均有统计学意义(P<0.05),而 Mad2蛋白则无统计学意义(P>0.05);2种蛋白在病理分级为 G1,G2,G3的患者中阳性表达率差别均有统计学意义(P<0.05);在发生淋巴结转移及未发生转移的患者中,Bub1蛋白的阳性表达率分别为0%及31.75%,Mad2蛋白的阳性表达率分别为88.89%及85.71%,差别均无统计学意义(P>0.05,图1,表1)。
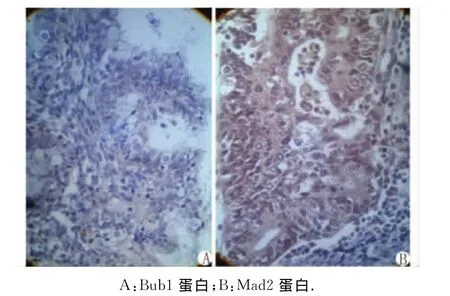
图1 子宫内膜癌组织中Bub1及Mad2蛋白的表达(DAB染色 ×400)Fig 1 Immunohistochemical figure of Bud1and Mad2(DAB ×400)
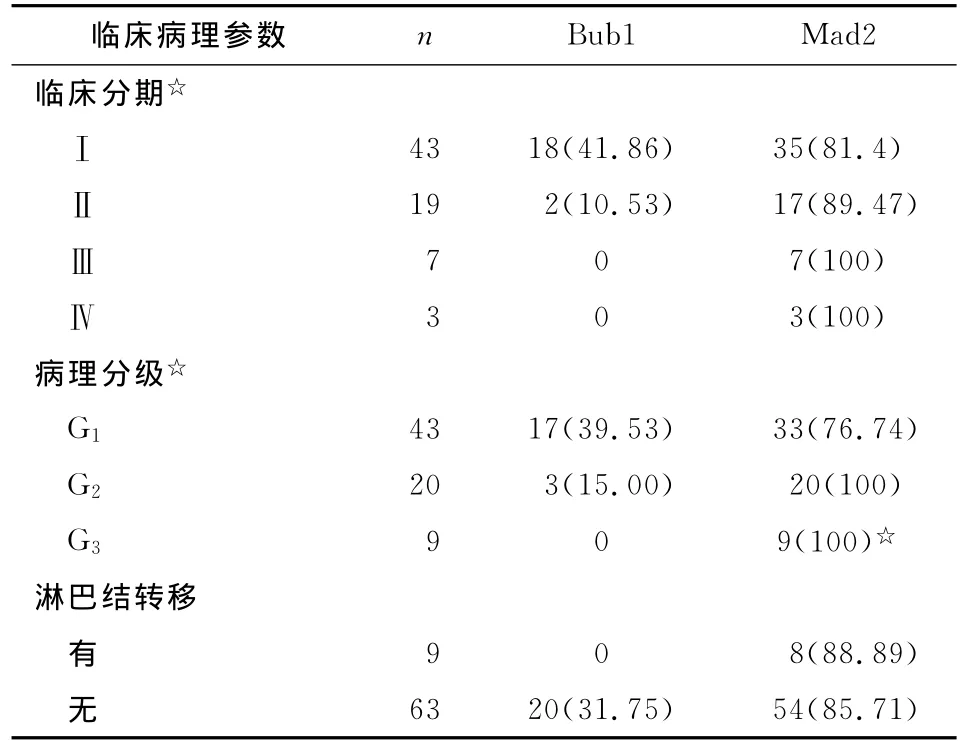
表1 Bub1及Mad2蛋白的表达与子宫内膜癌临床病理参数关系Tab 1 Parameter relationship between positive expression rate of Bub1and Mad2and clinical stage,pathology classification and lymph node etastasis
2.3 Bub1和Mad2蛋白在子宫内膜癌组织中的相关性分析 2种蛋白在子宫内膜癌组中均为阳性表达的有13例,均为阴性的有3例。根据其阳性细胞数占视野中总细胞数的百分比,二者在子宫内膜癌组织中的表达呈负相关(P<0.01,表2)。

表2 子宫内膜癌组织中Bub1和Mad2的相关性Tab 2 The correlation of Bub1and Mad2
3 讨 论
子宫内膜癌是女性生殖系统三大恶性肿瘤之一,其发病年龄逐渐年轻化且发病率呈显著上升趋势。近年来的研究表明,细胞周期调控紊乱与肿瘤发生、发展关系密切[2]。Bub1和Mad2蛋白是纺锤体关卡的重要组成部分,在细胞有丝分裂过程中监控纺锤体形态、染色体着丝点与微管联接以及染色体位置和排列,如果其表达和/或功能异常时,纺锤体关卡就会忽略染色体损伤,继续有丝分裂周期,染色体分配过程就有可能发生错误,造成染色体的不稳定性[1]。
本研究结果表明,Bub1蛋白主要定位于细胞质,其在子宫内膜癌患者中的阳性表达率明显低于正常子宫内膜,且内膜癌的分化程度越低、临床分期越晚,阳性表达率越低,但与是否发生淋巴结转移无关,提示Bub1蛋白表达可能与内膜癌预后相关。Bub1基因发生突变的机率极低,Bub1蛋白在内膜癌组织中表达降低,可能由于癌组织中Bub1的上游基因发生突变而导致Bub1表达降低,Bub1表达缺乏会导致P53介导的受损细胞早期凋亡通路中纺锤体关卡功能受损,导致非整倍体染色体的形成和积累[3]。有研究表明,内膜癌组织中非整倍体染色体细胞率明显高于不典型增生和正常子宫内膜组织,非整倍体可以独立于基因突变而导致癌症的发生[4-5]。
本研究也显示,Mad2蛋白在子宫内膜癌患者中的阳性表达率明显高于正常子宫内膜,且子宫内膜癌的分化程度越低,阳性表达率越高,但与临床分期和是否发生淋巴结转移无关。Mad2蛋白同样以细胞质表达为主,在细胞有丝分裂过程中可以调节细胞周期蛋白,使细胞进行染色体的分离[6]。Mad2基因也极少发生突变,可能是由于某种或多种因素导致Mad2蛋白在内膜癌中表达增高,继而使纺锤体检测点功能受损,引起纺锤体检查点控制失常,导致染色体不稳定性增加,染色体缺失的机率升高[7]。Sotillo等研究表明,Mad2过表达可以刺激小鼠体内不同亚型肿瘤的启动和进展[8]。
本研究结果还表明,Bub1和Mad2蛋白在子宫内膜癌组织中的表达呈负相关。Bub1是Bub家族的成员之一,基因定位于2q14,其表达产物是纺锤体关卡的必要组分。Bub1蛋白是一种丝氨酸/苏氨酸蛋白激酶,在各种生物中,Bub1是招募 Mad1、Mad2、蛋白瞵酸酶(PP)等到动点所必须的。Bubl蛋白表达异常会使纺锤体关卡功能受损,导致细胞有丝分裂过程中染色体分配错误,造成非整倍体和染色体不稳定性(Chromosomeinstability,CIN)的产生[9]。Mad2是Mad家族的成员之一,其基因定位于4q27,Mad2蛋白是纺锤体关卡的必要组成部分,其位于游离染色体着丝点上,参与监控着丝点与纺锤体微管的联接,并发出联结缺损信号。在信号级联中,Bub1位于信号级联的上游,为Mad2检测张力动粒所必须。当染色体受到损伤,纺锤体关卡被激活,Mad2通过抑制后期促进复合体的活性,阻止细胞向后期转变[10]。Bub1表达降低,使Mad2定位动粒的能力降低,忽略染色体的异常,加快有丝分裂的进程[11]。Bub1和 Mad2蛋白均表达异常,可能会加重染色体不稳定的发生,具有染色体不稳定性质的细胞易于发生染色体畸变,最终可能会导致肿瘤的发生。
综上所述,Bubl和Mad2蛋白表达异常会造成染色体不稳定和非整倍体细胞,最终导致肿瘤的发生,二者相互作用,在子宫内膜癌的发生、发展过程起重要作用。因此联合检测两个指标较单一检测其中某一个指标更具有临床意义。
[1]Ito D,Saito Y,Matsumoto T.Centromere-tethered Mps1 pombe homolog(Mph1)kinase is a sufficient marker for recruitment of the spindle checkpoint protein Bub1,but not Mad1[J].ProcNatlAcadSciUSA,2012,109(1):209-214.
[2]李志琴,章静波.细胞周期调控与肿瘤[J].癌症进展杂志,2004,2(2):146-150.
[3]Gao F,Ponte J F,Papageorgis P,etal.hBub1deficiency triggers a novel p53mediated early apoptotic checkpoint pathway in mitotic spindle damaged cells[J].CancerBiolTher,2009,8(7):627-635.
[4]马 哲,刘 力.子宫内膜癌DNA倍体、SPF的检测及其临床意义的研究[J].中国妇幼保健,2006,(22):3173-3175.
[5]Todorovic-Rakovic N.Genome-based versus gene-based theory of cancer:possible implications for clinical practice[J].Biosc,2011,36(4):719-724.
[6]Du J,Du Q,Zhang Y,etal.Expression of cell-cycle regulatory proteins BUBR1,MAD2,Aurora A,cyclin A and cyclin E in invasive ductal breast carcinomas[J].HistolHistopatho,2011,26(6):761-768.
[7]Kabeche L,Compton D A.Checkpoint-independent stabilization of kinetochore-microtubule attachments by Mad2in human cells[J].CurrBio,2012,22(7):638-644.
[8]Sotillo R,Hernando E,Díaz-Rodríguez E,etal.Mad2overexpression promotes aneuploidy and tumorigenesis in mice[J].CancerCell,2007,11(1):9-23.
[9]李爱香.Bubl、Mad2和突变型p53蛋白在子宫内膜癌组织中的表达及意义[D].郑州:郑州大学,2012.
[10]Ge S,Skaar J R,Pagano M.APC/C-and Mad2-mediated degradation of Cdc20during spindle checkpoint activation[J].CellCycle,2009,8(1):167-171.
[11]Saitoh S,Kobayashi Y,Ogiyama Y,etal.Dual regulation of Mad2localization on kinetochores by Bub1and Dam1/DASH that ensure proper spindle interaction[J].MolBiolCel,2008,19(9):3885-3897.
