新诊断2型糖尿病患者血清脂多糖水平与动脉粥样硬化的关系
2013-12-19,,,
, , ,
(大连医科大学 附属第二医院 内分泌科,辽宁 大连 116027)
临床医学
新诊断2型糖尿病患者血清脂多糖水平与动脉粥样硬化的关系
刘立朝,唐怡,王荔,苏本利
(大连医科大学 附属第二医院 内分泌科,辽宁 大连 116027)
目的探讨新诊断2型糖尿病(NDDM)患者血清脂多糖(LPS)水平与动脉粥样硬化之间的相关性。方法检测112名NDDM患者入组时和入组1年LPS水平以及大动脉粥样硬化超声指标,并选取75名年龄、性别相匹配的健康对照,对LPS、大动脉粥样硬化超声指标及相关临床资料进行分析。结果与健康对照组相比较,NDDM患者的lnLPS水平(1.64±0.32)高于健康对照组(1.42±0.28),差异有显著性意义(P<0.01)。采用偏相关分析发现,校正性别、年龄、病程后, LPS与入组时收缩压(SBP)、体重指数(BMI)、甘油三酯(TG)、颈动脉内膜厚度(CCA-IMT)、1年时收缩压(SBP)、总胆固醇(TC)及1年时CCA差呈正相关(相关系数分别为0.312、0.287、0.274、0.187、0.231、0.295和0.287,P均<0.05)。多元线性回归分析发现,入组时BMI、1年时CCA差是LPS独立相关因素。结论LPS在糖尿病患者中水平升高,是引起动脉粥样硬化的危险因素。
2型糖尿病;脂多糖;动脉粥样硬化
慢性低活度炎症状态是2型糖尿病和动脉粥样硬化形成的共同机制。脂多糖(lipopolysaccharide,LPS)是革兰阴性细菌细胞壁的主要结构成分之一,也是革兰阴性细菌的主要致病因子。革兰阴性细菌感染时,LPS从细菌外膜释放出来,诱发机体免疫炎症反应。近年来,国内外对脂多糖损伤血管内皮细胞方面的研究报道很多,但LPS在糖尿病及糖尿病大血管病变个体的研究报道较少。鉴于以上背景,本研究选择新诊断2型糖尿病(NDDM)患者为研究对象,探讨该人群LPS水平与动脉粥样硬化之间的关系。
1 资料与方法
1.1 研究对象
从参与国家十一五科技支撑计划《2型糖尿病大血管并发症干预措施与控制模式研究实验》的大连医科大学附属第二医院分中心病人中收集入组实验满1年且资料完整的112例2型糖尿病患者。研究对象为确诊糖尿病病程不超过2年,年龄在35~70岁之间,无肝肾功能不良(血肌酐>正常上限1.2倍,谷草转氨酶>正常上限2倍),抽血前半年内无酮症或酮症酸中毒、高渗昏迷、严重应激状态,无进展性的致命性疾病。并选择年龄、性别相匹配的健康对照75例。
1.2 研究方法
详细记录所有研究对象的性别、年龄、吸烟与否、高血压病史,测量患者的身高与体重及血压。
生化指标测定:所有研究对象在实验入组时及实验满1年时,均空腹8 h,留取血液、尿液标本,分别检测空腹血糖(FPG)、血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、糖化血红蛋白(HbA1C)、空腹胰岛素(Ins)。
血管B型超声检查:所有研究对象在实验满1年时均由同一名超声医师行颈总动脉、髂总动脉、股动脉超声检查。动脉内膜中层厚度(IMT)的检查方法:以右侧颈总动脉(CCA)、髂总动脉(CIA)、股动脉(CFA)作为靶血管,3个动脉内膜中层厚度测量位置分别为:颈总动脉—距颈动脉球膨大起始处10 mm内最厚处;髂总动脉—距腹主动脉分叉远端10 mm内最厚处;股动脉—股动脉分叉近端10 mm内最厚处。斑块记录:检查视野内有斑块时,记录斑块的数目、大小、回声和形态。
酶联免疫吸附法测定血清脂多糖(LPS):人脂多糖/内毒素(LPS)ELISA Kit酶联免疫分析试剂盒,购于南京凯基生物公司。
研究对象给予血糖、血压、血脂强化控制。强化血糖控制标准: FPG<7.0 mmol/L,HbA1c<7.0%; 强化血压控制标准: BP≤130/80 mmHg。强化血脂控制标准: TG<1.7 mmol/L,LDL- C<2.6 mmol/L。降糖药物主要应用磺脲类、双胍类,达到最大剂量血糖仍未达标则加用胰岛素(NPH 或长效胰岛素) 睡前1次皮下注射。降压药物选用血管紧张素转换酶抑制剂(ACEI)、钙拮抗剂(CCB)。TC 升高为主的血脂异常,首选他汀类,高TG 血症为主的脂代谢紊乱选用贝特类。各干预对象无服用阿司匹林禁忌证者均同时给予阿司匹林100 mg/d。
1.3 统计学方法
采用SPSS17.0统计软件,计量资料用均值±标准差表示,各组之间比较符合正态分布的计量资料用t检验,不符合正态分布的计量资料进行自然对数转换后再进行t检验, LPS与其它研究指标的相关性分析用偏相关分析。所有比较的差异显著性检验定义为P<0.05。
2 结 果
2.1 2型糖尿病患者与非糖尿病者LPS比较
2型糖尿病患者血lnLPS水平高于非糖尿病者,差异有显著性意义(1.64±0.32 vs 1.42±0.28,t=-3.095,P<0.01)。
2.2 LPS与其他研究指标的相关性比较
对LPS浓度与实验入组时及满1年时的各研究指标进行偏相关性分析得出:校正性别、年龄、病程后, LPS与入组时收缩压(SBP)、TG、颈动脉内膜厚度(CCA-IMT),1年时SBP、TC呈正相关(P<0.05)。具体各研究指标的相关系数及P值见表1、表2。
表1 LPS与实验入组时各研究指标相关性比较
Tab 1 Analysis of the relationship between LPS and clinical date at the baseline

研究指标相关系数(r)P性别-1.2410.217年龄-0.0540.672病程-0.0220.925吸烟0.0850.607高血压0.2570.021SBP0.3120.017DBP0.2820.149BMI0.2870.020FPG-0.2120.357HbA1C-0.2300.257Ins0.0710.683TG0.2740.025TC0.2740.182HDL-C0.0510.772LDL-C0.1520.245CCA-IMT0.1870.041CIA-IMT-0.0810.573CFA-IMT0.2510.073
表2 LPS与实验满1年时各研究指标相关性比较
Tab 2 Analysis of the relationship between LPS and clinical date after 1 year
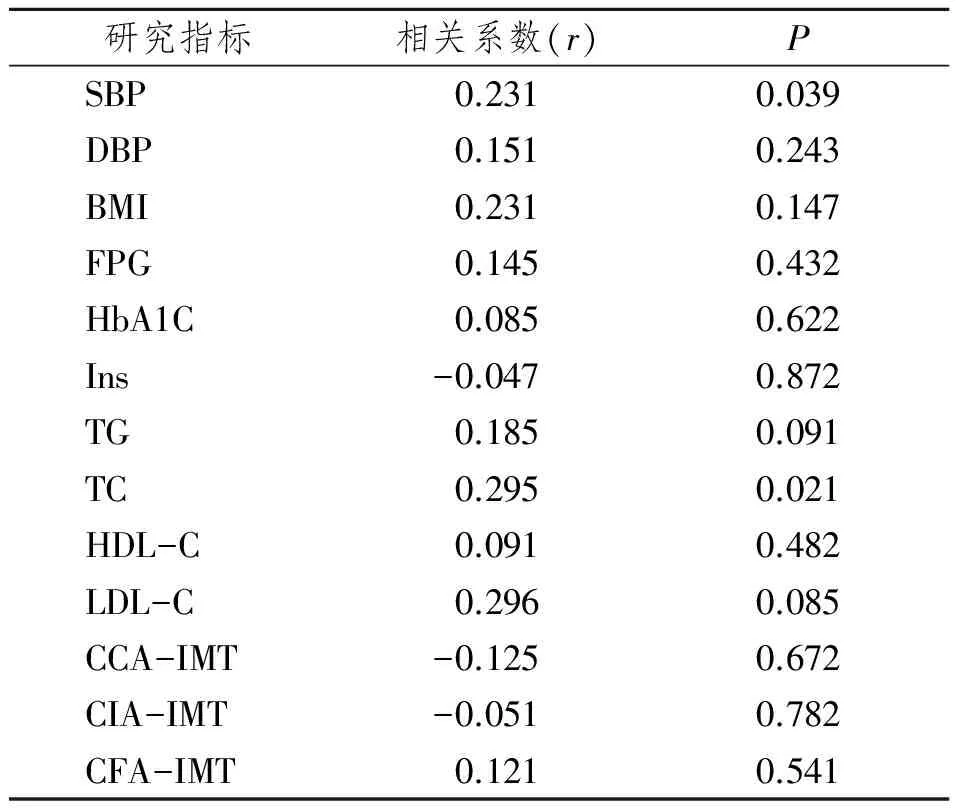
研究指标相关系数(r)PSBP0.2310.039DBP0.1510.243BMI0.2310.147FPG0.1450.432HbA1C0.0850.622Ins-0.0470.872TG0.1850.091TC0.2950.021HDL-C0.0910.482LDL-C0.2960.085CCA-IMT-0.1250.672CIA-IMT-0.0510.782CFA-IMT0.1210.541
2.3 LPS与CCA、CIA、CFA动脉内膜变化的相关性比较
用研究对象入组时CCA、CIA、CFA内膜中层厚度与实验满1年时CCA、CIA、CFA内膜中层厚度之差来反映CCA、CIA、CFA动脉内膜变化,并与LPS浓度做偏相关分析后得出,LPS与1年时CCA差正相关(P<0.05)。具体相关系数及P值见表3。
表3 LPS与动脉内膜变化相关性比较
Tab 3 Analysis of the relationship between LPS and the change of artery intima-media thickness
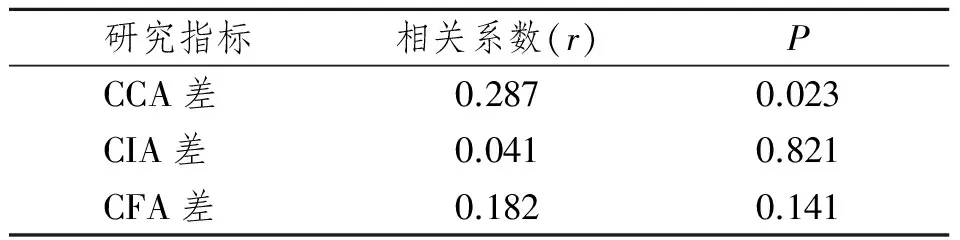
研究指标相关系数(r)PCCA差0.2870.023CIA差0.0410.821CFA差0.1820.141
2.4 LPS影响因素的多元线性回归分析
以LPS作为因变量,实验入组时及实验满1年时的各研究指标作为自变量进行多元线性回归分析显示: LPS与入组时BMI (BMI0)及1年时CCA差独立相关,见表4。
表4影响LPS的多元线性回归分析
Tab 4 Multiple linear regression analysis of factors affecting LPS

进入变量标准βtPBMI00.3423.3810.004CCA差0.3573.4150.006
3 讨 论
炎症反应在糖尿病患者大血管粥样硬化的发生、发展过程中具有重要的意义。LPS是革兰氏阴性菌的主要致病因子,是血管内皮细胞的强烈激活剂。LPS通过直接或间接两条途径作用于血管内皮,促进炎症的发生和发展[1]。所谓直接损伤是指LPS直接作用在血管内皮细胞上而产生的损伤效应, LPS作用于血管内皮细胞后,在最初第2~4 h,其表面黏附分子ICAM-1表达即开始增加,到第24 h,ICAM-1分泌达高峰,黏附分子在糖尿病血管并发症的发生过程中起到了重要作用,可介导并增强白细胞与血管内皮细胞间的黏附,从而促进炎症的进展。间接损伤则是指LPS通过与细胞膜上的受体结合,诱导免疫细胞释放多种细胞因子和炎性介质,最后再影响微血管内皮细胞的通路。LPS释放入血后,先与脂多糖结合蛋白(LBP)结合,之后再与单核细胞、T细胞等免疫活性细胞表面的蛋白复合物受体相互作用,将LPS信号转导到细胞内,激活靶基因,产生肿瘤坏死因子-α(TNF-α)、白介素-1(IL-1)、白介素-6(IL-6)等细胞因子,这些细胞因子再激活血管内皮细胞,使其也分泌许多可造成血管内皮细胞损伤的细胞因子,进一步加重血管内皮细胞损伤。
本研究表明,与正常人相比,2型糖尿病患者组LPS显著升高,说明糖尿病患者体内的炎症反应可能更加严重。LPS水平升高将导致机体发生严重的糖代谢紊乱:一方面在早期通过神经内分泌体系加速肝脏糖原的分解,提高肝脏糖原异生功能,导致高血糖的发生;另一方面,LPS还可使TNF-α 和一氧化氮(NO)水平升高,TNF-α通过抑制组织细胞膜胰岛素受体酪氨酸蛋白激酶,造成胰岛素受体信号传导障碍。而NO可诱导胰岛β细胞凋亡,造成血糖刺激的胰岛素分泌功能下降,加重糖尿病的进展[2]。此外高糖环境还可加强LPS对心血管组织的炎症反应,有学者推测可能与Toll样受体 (Toll like receptors,TLRs)有关。 TLRs是近年来发现的一种细胞表面受体家族,属于模式识别受体,可对病原体相关分子模式进行识别、结合并引发一系列信号转导,进而导致炎性介质的释放,TLR4是目前已知的识别LPS最主要的跨膜受体;而TLR2主要介导革兰氏阳性菌及其细胞壁成分对细胞的激活作用,也可介导对LPS的反应,机体的高糖环境导致TLR2/4的激活,最终使核因子κB(NF-κB)的转位与相应免疫基因的活化和转录,释放前炎症因子及辅助剌激分子起到调节炎症反应的作用[3]。
本研究还发现,经偏相关分析校正性别、年龄、病程后,LPS与糖尿病患者的SBP、CCA-IMT及1年时CCA差正相关(P<0.05),表明LPS可引起血管舒缩功能紊乱,在糖尿病患者动脉粥样硬化过程中可能起着重要作用。LPS可以作用于血管内皮细胞导致内皮素-1(ET-1)和一氧化氮(NO)合成和分泌增加,使内皮舒张功能受损,进而导致血管舒缩功能紊乱的发生[4],这可能是高血压发生及发展的病因之一。动物实验研究还表明:在对糖尿病大鼠注射LPS后,可引起全身性的炎症反应,使体内炎症因子的水平明显增高[5]。增高的炎症因子水平对高血糖导致的内皮细胞功能损害起协同作用,从而进一步加重了血管的炎症反应,由于内皮功能紊乱及形态学变化等因素,造成白细胞与血小板激活,最终导致动脉粥样硬化的形成[6]。
本研究LPS水平与CIA、CFA内膜厚度未见相关性,考虑可能与髂总动脉、股动脉离体表位置较远,受肥胖、超声检测干扰影响较大,不如颈总动脉位置表浅,走行明确,与皮肤平行,较易成像,有较高的重复性和准确性。很多研究已证实颈动脉粥样硬化与心、脑动脉粥样硬化密切相关,故临床上可以选用CCA-IMT来反映动脉粥样硬化的程度[7-8]。
本实验显示LPS与入组时TG、1年时TC呈正相关(P<0.05), LPS使血脂增高的原因可能为LPS通过激活CD14阳性细胞,释放的TNF-α等细胞因子不但参与炎症反应,而且在脂肪代谢中起重要作用,TNF-α对脂蛋白脂酶有较强的抑制作用,大量的TNF-α可减少外周脂肪组织分解,并促进肝细胞合成TG[9-10],导致血脂的升高。
本研究将LPS导致的炎症反应与2型糖尿病中的大血管病变、糖脂代谢紊乱联系起来,为进一步深入研究糖尿病大血管病变提供了新的线索和思路。将来还需更大的样本和更加严格前瞻性研究来证实这一相关性。
[1] Moreno-Navarrete JM,Ortega F,Serino M,et al. Circulating lipopolysaccharide-binding protein (LBP) as a marker of obesity-related insulin resistance[J]. Int J Obes,2012,36(11):1442-1449.
[2] Park HK,Qatanani M,Briggs ER,et al. Inflammatory induction of human resistin causes insulin resistance in endotoxemic mice[J]. Diabetes,2011,60(3):775-783.
[3] Monaco C,Gregan SM,Navin TJ,et al. Toll-like receptor- 2 mediates inflammation and matrix degradation in human atherosclerosis[J]. Circulation,2009,120(24):2462-2469.
[4] Kajita M,Murata T,Horiguchi K,et al. iNOS expression in vascular resident macrophages contributes to circulatory dysfunction of splanchnic vascular smooth muscle contractions in portal hypertensive rats[J]. Am J Physiol Heart Circ Physiol,2011,300(3): 1021-1031.
[5] Satoshi H,Hideo I,Akira H,et al. Hyperglycemia contributes to cardiac dysfunction in a lipopolysaccharide-induced systemic inflammation model[J]. Crit Care Med,2009,37(7): 2223-2227.
[6] Akihiro N,Kosaku K,Atsushi S,et al. Hyperglycemia and lipopolysaccharide decrease depression effect of interleukin 8 production by hypothermia: an experimental study with endothelial cells[J]. Intensive Care Med,2008,34(1):109-115.
[7] Meenakshisundaram R,Devidutta S,Michaels AD,et al. Significance of the intima-media thickness of carotid and thoracic aorta in coronary artery disease in the South Indian population[J]. Heart Views,2011,12(4):150-156.
[8] Herder M,Johnsen SH,Arntzen KA,et al. Risk factors for progression of carotid intima-media thickness and total plaque area: a 13-year follow-up study: the Troms Study[J]. Stroke,2012,43(7):1818-1823.
[9] Carter-Kent C,Zein NN,Feldstein AE. Cytokines in the pathogenesis of fatty liver and disease progression to steatohepatitis: Implications for treatment[J]. Am Gastroenterol,2008,103(4):1036-1042.
[10] Tian J,Hu S,Han X,et al. Lipopolysaccharide-induced proliferation of the vasa vasorum in a rabbit model of atherosclerosis as evaluated by contrast-enhanced ultrasound imaging and histology [J]. Inflammation,2012,35(4):1530-1537.
Lipopolysaccharideandatherosclerosisinnewlydiagnosedtype2diabetes
LIULi-chao,TANGYi,WANGLi,SUBen-li
(DepartmentofEndocrinology,theSecondAffiliatedHospitalofDalianMedicalUniversity,Dalian116027,China)
ObjectiveTo study the relationship between Lipopolysaccharide (LPS) and the formation of atherosclerosis in newly diagnosed type 2 diabetes mellitus.MethodsSerum of 112 patients with type 2 diabetes and 75 non-diabetic subjects matched for age and gender were analyzed for LPS in this study. The levels of LPS and ultrasonographic studies on main arteries were performed at the time of enrollment and 1 year later. The results of ultrasonography,the levels of LPS and the other clinical data were analyzed.ResultsThe level of lnLPS in diabetic patients (1.64±0.32) were significantly higher than that in non-diabetic subjects (1.42±0.28)(P<0.01). Partial correlation analysis showed LPS was correlated with the baseline systolic blood pressure (SBP) (r=0.312),body mass index (BMI) (r=0.287),triglyceride (TG) (r=0.274),Carotid artery intima-media thickness (CCA-IMT) (r=0.187),and SBP (r=0.231),total cholesterol (TC) (r=0.295),the change of CCA-IMT (r=0.287) after 1 year (P<0.05), adjustment for sex,age and the period of disease. Multiple regression analysis indicated that BMI at the baseline and the change of CCA-IMT 1 year later were the independent influential factors of LPS.ConclusionThe lnLPS in diabetic patients were higher than that in non-diabetic subjects. LPS is a risk factor of carotid atherosclerosis.
type 2 diabetes; lipopolysaccharide; atherosclerosis
10.11724/jdmu.2013.06.09
R587.1
A
1671-7295(2013)06-0547-04
刘立朝,唐怡,王荔,等. 新诊断2型糖尿病患者血清脂多糖水平与动脉粥样硬化的关系[J].大连医科大学学报,2013,35(6):547-550.
十一五科技支撑计划课题(2006 BAI02B08)
刘立朝(1979-),男,河北石家庄人,主治医师。E-mail:wjsmxk@163.com
苏本利,教授。E-mail:wsllc@eyou.com
2013-06-14;
2013-08-20)
