c-Kit+Lin-细胞体外扩增及体内分化的实验研究
2013-12-19,,,,
, ,,,
(1.广东省东莞市石排医院 普外科,广东 东莞 523330;2.南方医科大学 南方医院 肝胆外科,广东 广州 510515)
基础医学
c-Kit+Lin-细胞体外扩增及体内分化的实验研究
张春兴1,王芳1,廖彩仙2,吴亚琼1,蒋建武1
(1.广东省东莞市石排医院 普外科,广东 东莞 523330;2.南方医科大学 南方医院 肝胆外科,广东 广州 510515)
目的研究移植刚分选及扩增后雄性小鼠的骨髓c-Kit+Lin-细胞到酒精性肝纤维化雌性模型小鼠体内后,模型小鼠的肝脏形态改变、肝功能变化和移植细胞的分布、分化及归巢情况。方法采用酒精灌胃法建立酒精性肝纤维化雌性小鼠模型,造模成功后随机选取8只模型小鼠(模型组)与正常小鼠8只(对照组)比较两组肝功能变化。剩余模型小鼠再随机选取32只,分为4组处理,并再随机选取8只正常小鼠(第1组)与其对照。模型小鼠的4组分别为:移植前取血处死组(第2组),移植新鲜分选的c-Kit+Lin-细胞组(第3组),移植扩增后的c-Kit+Lin-细胞组(第4组),仅予以注射Buffer组(第5组)。采用免疫磁珠法分选雄性小鼠骨髓c-Kit+Lin-细胞;利用SCF+ HGF+ FL+LIF +TPO+ IL-3因子组合对其进行体外扩增;将刚分选及扩增后c-Kit+Lin-细胞移植入酒精性肝纤维化雌性模型小鼠体内,检测两组肝功能改变、肝脏纤维化改善、含雄性小鼠Y染色体性别决定基因cDNA(Sry)的移植细胞在受体肝内定居分化情况。结果(1) 两移植组在移植30天后,较移植前肝脏纤维化改善明显;(2) 两移植组在移植30天后AST、ALT、ALB与移植前比较差异有显著性意义(P<0.05);(3)两移植组均可见含雄性小鼠Y染色体性别决定基因cDNA(Sry)的移植细胞,并同时表达ALB mRNA,计数细胞比例,比较差异无显著性意义(P>0.05)。结论移植c-Kit+Lin-细胞后能在受体肝内定居并转化成有功能新生肝细胞;移植c-Kit+Lin-细胞后能明显改善肝损伤小鼠的肝功能及肝脏纤维化;扩增对c-Kit+Lin-细胞的归巢、在体内分化没有明显影响。
骨髓衍生肝干细胞;免疫磁珠分选;体外扩增培养;干细胞移植;c-Kit+Lin-细胞
骨髓细胞可以分化形成肝细胞的特定干细胞群,被称之为骨髓衍生肝干细胞(bone marrow derived liver stem cells BMDLSC),已被众多学者公认[1-2],为肝脏疾病治疗提供了新思路和新手段。有研究者在不同的实验研究中发现c-kit+Lin-是一群富含BMDLSC的骨髓干细胞群。与其他类型的骨髓干细胞类似,c-kit+Lin-细胞的含量低、数量有限,难以满足未来应用的需要[3-4]。
本实验利用免疫活性细胞磁珠分选法(magnetic activated cell separation,MACS)对雄性小鼠c-kit+Lin-细胞进行分选提纯[5]。根据相关文献,参照脐血造血干细胞、骨髓造血干细胞的体外扩增培养,本实验选用SCF+HGF+FL+LIF+TPO+IL-3因子组合在STEMPRO-34 SFM 无血清培养基中对其进行体外扩增,流式细胞术检测c-kit+Lin-细胞数。将刚分选及扩增后雄性小鼠c-kit+Lin-细胞移植入酒精性肝纤维化雌性模型小鼠体内,检测移植前后酒精性肝纤维化模型雌性小鼠的肝功能,利用双重原位杂交的方法检测雌性小鼠肝脏中存在Y染色体性别决定基因cDNA(Sry)阳性和ALBmRNA阳性的细胞数量,比较两组小鼠的肝脏形态、肝功能变化和移植细胞的分布、分化及归巢情况。为将来临床上进行骨髓衍生肝干细胞肝内移植治疗肝疾病奠定基础。
1 材料和方法
1.1 酒精性肝纤维化雌性小鼠模型的建立及分组
6~7周龄BALB/C雌性小鼠80只,随机分两组,模型组64只,对照组16只。采用酒精灌胃法,模型组给予54度白酒(酒鬼酒股份有限公司生产,湘泉500 mL,54度)每天灌胃2次共16周,同时将54度白酒用蒸馏水配制成含酒精10% (v/v)白酒为唯一饮料。第1周~第3周末灌胃量为每次8 mL/kg,第4周~第7周末灌胃量为每次10 mL/kg,第8周~第16周末灌胃量为每次12 mL/kg。对照组无特殊处理,饮用自来水。实验期间均予全价营养颗粒饲料喂养。第16周末模型组死亡16只,死亡率为25%,剩余48只,对照组无死亡。造模成功后随机选取8只模型组小鼠,与8只正常对照组小鼠比较两组肝功能变化。剩余模型小鼠再随机选取32只,分为4组处理,并再选取其余8只正常小鼠(第1组)与其对照。模型小鼠的4组分别为:移植前取血处死组(第2组),移植新鲜分选的c-Kit+Lin-细胞组(第3组),移植扩增后的c-Kit+Lin-细胞组(第4组),仅予以注射Buffer组(第5组)。每组8只,剩余8只模型小鼠弃之不用。
1.2 肝功能检测
模型组和对照组的各8只小鼠,眼球采血后,颈椎脱臼处死,处死前禁食12 h。小鼠处死后立即取出肝脏用10%的甲醛固定,脱水后石腊包埋切片,苏木精-伊红(HE)染色和苦味酸-酸性品红(VG)染色,光镜观察病理变化。血标本用于测定ALB、AST、ALT。
1.3 免疫磁珠法分离骨髓c-kit+Lin-细胞
取5只6~7周龄Balb/c雄性小鼠,颈椎脱臼处死,置75%的酒精浸泡15 min;无菌取出,解剖双侧股骨,离断两端骨骺,DMEM液反复冲洗骨髓腔;细胞悬液吹打后加入红细胞裂解液6 mL,30 μm 400目尼龙膜过滤,获取细胞悬液。利用德国Miltenyi Biotec公司Lin-细胞单抗分离系统(MACS) 分离,收集Lin-细胞,在此基础上再阳性分选出c-Kit+细胞,得到c-kit+Lin-细胞。分离方法按试剂盒说明书进行。利用流式细胞仪(BD公司) 检测分选的c-kit+Lin-细胞。
1.4 c-Kit+Lin-细胞短期培养
白细胞介素-3(IL-3),干细胞因子(SCF),FLt-3配基(FL)和白血病抑制因子(LIF)及血小板生成素(TPO)购自美国Peprotech公司,HGF购自eBioscience公司。SCF,LIF,FL 和TPO终浓度为50 ng/mL HGF终浓度为10 ng/mL,IL-3终浓度为20 ng/mL。培养体系为STEMPRO -34 SFM 无血清培养基(GIBCO公司) 。c-Kit+Lin-细胞初始浓度为5×104/ mL,将c-Kit+Lin-细胞接种于24 孔培养板中,每孔1 mL,复种8孔,在37 ℃、5 % CO2、饱和湿度条件下培养7天。培养第3天半量换液,第7天计算细胞总数,流式细胞术检测c- Kit+Lin-细胞数。
1.5 模型雌性小鼠移植雄性小鼠骨髓c-Kit+Lin-细胞
第3组移植新鲜分选的c-Kit+Lin-细胞组,第4组移植扩增后的c-Kit+Lin-细胞组,第5组仅予以注射Buffer。扩增后及刚分选的c-Kit+Lin-细胞分别进行计数, 8 ℃条件下1 500 r/min离心10 min,弃上清,加入Buffer22.5 mL重悬细胞。调节细胞浓度1×106个/mL,第3组、第4组每只予100 μL细胞悬液尾静脉注射。第5组仅予以注射Buffer2100 μL。
1.6 移植前后肝功能检查、肝组织常规病理检查
移植前第1组、第2组全部小鼠眼球采血后,颈椎脱臼处死,小鼠处死后立即取出肝脏。第3、4、5组30天后无小鼠死亡,全部小鼠眼球采血后,颈椎脱臼处死。小鼠处死后立即取出肝脏。测量血清中ALT、AST和ALB等肝功能指标;肝脏给予石蜡包埋,按标准操作行HE、VG染色,HE染色观察小鼠肝脏病理改变,包括肝细胞的变性、坏死、炎性细胞浸润;VG染色观察小鼠肝脏胶原纤维的增生(染色后胶原纤维呈红色)。
1.7 白蛋白mRNA和Y染色体Sry基因DNA双重原位杂交
设立严格的对照组,阴性对照为BALB/C雌性小鼠肝组织。ALB mRNA探针序列:5’-TTGGCAAGTT CCGCCCTGTC ATCTGCGC (TAMRA红色荧光标记,PCR扩增时参入dupt-TAMRA);Sry基因DNA探针序列:5’-GCTGGGATGC AGGTGGAAAA GCCTTACAG(FAM绿色荧光标记,PCR扩增时参入dupt-FAM)。
小鼠白蛋白mRNA探针根据GenBank登记号为:AJ011413设计;Y染色体性别决定区序列根据GenBank登记号为:NM0 11564设计DNA探针。其中Y染色体DNA探针由FAM标记,激发后显绿色荧光;ALB mRNA探针由TAMRA标记,激发后显红色荧光。当细胞同时表达ALB mRNA和Y染色体DNA时,红色与绿色叠加而形成黄色。
按原位杂交方法操作,在同一切片上先行ALBmRNA原位杂交,杂交后滴加Y染色体Sry基因 DNA探针。在荧光显微镜下激发各自波长,分别照相,并进行图像融合,每张切片随机选取10个视野(油镜),每个视野细胞数约20个,记录双阳性细胞率。每组取8张切片计数,了解移植细胞肝内转化情况。
1.8 统计学方法
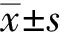
2 结 果
2.1 酒精性肝纤维化模型小鼠的肝功能变化
模型组小鼠的肝功能与对照组相比,肝功能损害明显。见表1。
表1酒精性肝纤维化模型小鼠的血清生化指标比较


生化指标对照组模型组tPALB(U/L)38.97±4.5626.26±3.486.2680.000AST(U/L)147.23±12.63286.65±30.92-11.8080.000ALT(g/L)43.41±5.27150.02±13.30-21.0740.000
与对照组比较,P均<0.001
2.2 MACS分离c-Kit+Lin-细胞的纯度及回收率
MACS分离c-Kit+Lin-细胞纯度均达到85%,回收率达到80%以上。
2.3 细胞总数扩增结果
在7天的培养过程中,细胞总数增加163.34倍,流式细胞术检测c-Kit+Lin-细胞数,c-Kit+Lin-细胞扩增倍数为18.75倍。
2.4 移植c-Kit+Lin-细胞后病理学变化
雌性酒精性肝纤维化模型小鼠移植刚分选细胞组(第3组)和移植扩增细胞组(第4组):移植30天后,肝组织HE染色显示:肝细胞无明显坏死,细胞浊肿、变性减轻,部分细胞接近正常形态;肝窦区无明显炎性浸润,核分裂相少,增生不明显,肝索排列有序,汇管区纤维化减轻。VG染色见肝小叶中央静脉壁、汇管区及肝窦内的粉红色胶原纤维与移植前雌性酒精性肝纤维化模型小鼠(第2组)相比有所减少。
雌性酒精性肝纤维化模型小鼠注射Buffer2组(第5组):30天后,肝组织HE染色显示:肝小叶仍可见点状坏死及小灶状坏死,肝细胞胞体肿大呈球形;肝窦受压,肝索紊乱,并可见少数假小叶形成。VG染色可见汇管区血管壁明显增厚,肝窦周围有大量粉红色胶原纤维散在分布,并且肝小叶中央静脉之间仍可见胶原纤维相连。
2.5 移植30天后小鼠肝脏功能变化
两移植组小鼠30天后肝功能损害较移植前模型小鼠(第2组)及仅予以注射Buffer2的小鼠(第5组)改善明显。注射Buffer2小鼠肝功能无明显改善。各组肝功能结果见表2。
表2 30天后各组肝功能变化

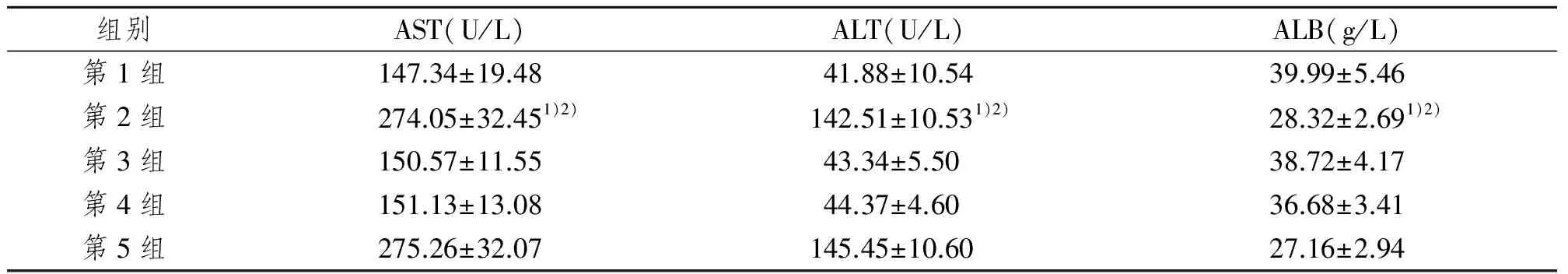
组别AST(U/L)ALT(U/L)ALB(g/L)第1组147.34±19.4841.88±10.5439.99±5.46第2组274.05±32.451)2)142.51±10.531)2)28.32±2.691)2)第3组150.57±11.5543.34±5.5038.72±4.17第4组151.13±13.0844.37±4.6036.68±3.41第5组275.26±32.07145.45±10.6027.16±2.94
1)与第1组(对照组)比较,P<0.05;2)与第3组、第4组比较,P<0.05
2.6 双重原位杂交,双阳性细胞的比例
移植刚分选细胞组和移植培养后细胞组双重原位杂交,均可见含雄性小鼠Y染色体性别决定基因cDNA(Sry)的移植细胞,并同时表达ALB mRNA,双阳性细胞的比例无明显差异,分别为3.90±1.02 和3.55±0.70,P>0.05。
3 讨 论
对于酒精性肝损伤模型,国外已经创建成形的有Lieber-Decarli模型、Tsukamoto -French 模型和Lieber-Decarli 液体食料加辅剂模型[6-8]。由于此类造模方法较复杂,而且造价较高,国内较少有人采用。本实验中乙醇的起始量为54%酒精8 mL/kg,每天灌胃2次,同时饮用酒精饮料,随实验的推进,两次调整酒精的剂量,逐步增加酒精灌注量,有利于维持血中较高酒精浓度,避免一次给酒剂量太大导致小鼠出现急性酒精中毒而死亡。在 16 周末成功建立了酒精性肝纤维化模型。酒精性肝纤维化模型组小鼠的肝功能与正常对照组相比,肝功能损害明显。在模型制备过程中小鼠共死亡16只,死亡率为25%。这种造模方法也接近国人的饮酒习惯,适合中国国情,且方法简便易行,费用低,适合于酒精性肝病的发病机理及肝细胞的移植治疗的研究。
越来越多的试验证实骨髓干细胞参与了肝组织再生过程[9]。与其他类型的骨髓干细胞类似,c-Kit+Lin-细胞的含量低、数量有限,必须对其进行分选、提纯、扩增。MACS细胞分选系统能有效分选c-Kit+Lin-细胞,纯度和回收率均较高[5]。IL-3,LIF,FL,TPO和SCF是广泛应用于体外扩增干细胞的细胞因子[10]。IL-3是非特异性细胞因子,由T淋巴细胞受分裂剂或抗原刺激后产生的一种淋巴因子,其功能主要是维持处于G0期之外的所有干细胞的增殖[11]。且与TPO联用时能提高扩增效率。LIF常用于胚胎干细胞(ESC)的培养,能抑制其分化并保持增殖能力,是ESC体外培养不可缺少的细胞因子之一[12]。SCF能诱导骨髓或脐血CD34+等干/祖细胞由静止期进入增殖期,通常和其他因子合用,并能够起到协同扩增的效果。FL促进细胞有丝分裂的能力较弱,但却有很强的维持祖细胞能力,在扩增干祖细胞的同时还能抑制其分化[13]。SCF和FL同属于酪氨酸激酶TKP家族,可启动早期祖细胞的分裂和增殖[14]。TPO的配基为MPL,是巨核细胞系特异性的生长因子,通过激活JANUS激酶2,介导G蛋白信号系统,从而刺激细胞增殖,但近年来实验证实对维持和调节早期干/祖细胞增殖的自我更新有重要作用[15]。HGF主要由肺、肝等脏器分泌,不仅可以刺激肝细胞还可以刺激各种上皮细胞、内皮细胞、神经细胞等增殖。在干细胞方面,HGF主要应用于诱导干细胞的定向分化[16]。本研究在无血清条件下采用SCF+FL+HGF+TPO+LIF+IL-3组合培养c-Kit+Lin-细胞,发现随着培养时间的延长,干细胞有部分分化,形态上显微镜下可见变得大小不一致的细胞;细胞总数扩增163.34倍,而c-Kit+Lin-细胞扩增18.75倍。
本实验利用酒精性肝纤维化雌性小鼠模型作为受体,将刚分选雄性小鼠骨髓c-Kit+Lin-细胞、培养后雄性小鼠骨髓c-Kit+Lin-细胞移植入雌性模型小鼠体内,通过肝脏形态学、组织学变化及肝功能等指标评价干细胞修复肝损伤的效果;同时利用雄性小鼠的Y染色体性别决定基因cDNA(Sry)为标记,通过原位杂交检测雌性小鼠损伤肝脏中存在Sry阳性的细胞,以观察移植干细胞在肝脏形态、分布、分化及归巢情况。荧光原位杂交(fluorescence in situ hybridization,FISH) 技术是Pinkel等于1986 年在放射性原位杂交的基础上创建的,本实验采用的是相对简单的双重(双色)原位杂交的方法,根据小鼠ALB mRNA(GenBank登记号为:AJ011413设计)和Y染色体性别决定区序列(GenBank登记号为:NM011564)设计合成探针,并根据颜色叠加的原理,当细胞同时表达ALB mRNA所表达的红色与表达Y染色体的黄色相复合后就可见黄色荧光。
移植雄性小鼠骨髓c-Kit+Lin-细胞入模型小鼠体内30 天后,两移植组小鼠肝纤维化较移植前模型小鼠及仅予以注射Buffer的小鼠均有明显减轻,肝细胞在形态上均接近正常。两移植组小鼠ALB、AST、ALT也明显改善,均接近正常。两移植组小鼠的肝脏都检测到了同时表达ALB mRNA与表达Y染色体的细胞,且两组比较无明显差异,而在仅予以注射Buffer2的小鼠Y染色体的细胞表达阴性。由此可以推测,移植的雄性小鼠骨髓c-Kit+Lin-细胞定居在模型雌性小鼠肝脏,分化为有功能的新生肝细胞,能明显改善肝损伤小鼠的肝功能及肝脏纤维化,而且体外扩增培养后对c-Kit+Lin-细胞的定居、分布、分化及归巢无明显影响。而仅注射Buffer2不能改善模型小鼠肝脏损害。
[1] Petersen BE,Bowen WC,Patrene KD,et al.Bone marrow as a potential source of hepatic oval cells[J].Science,1999,284(5417):1168-1170.
[2] Baumann U,Crosby HA,Ramani P,et al. Expression of the stem cell factor receptor c-Kit in normal and diseased pediatric liver: identification of a human hepatic progenitor cell[J].Hepatology,1999,30(1):112-117.
[3] Lagasse E,Corrnors H,Al-Dhalimy M,et al. Purfied hematopoietic stem cells can differentiate into hepatocytes in vive[J]. Nat Med,2000,6(11):1229-1234.
[4] 唐浩,廖彩仙,周杰,等.小鼠 C-Kit+Lin-骨髓细胞移植生成肝细胞的实验研究[J].南方医科大学学报,2006,26(5):567-569.
[5] 张春兴,廖彩仙,张守华,等.免疫磁珠分选骨髓衍生肝干细胞亚群c-Kit+Lin-[J].中国组织工程研究与临床康复,2007,11(7):1232-1234.
[6] Lieber CS,DeCarli LM.The feeding of alcohol in liquid diets:two decades of applications and 1982 update[J]. Alcohol Clin Exp Res,1982,6(4):523-531.
[7] Tsukamoto H,Reidelberger RD,French SW,et al.Long-term cannulation model for blood sampling and intragastric infusion in the rat [J].Am J Physiol,1984,247(16):R595-R599.
[8] Yokoyama H,Nagata S,Moriya S,et al.Hepatic fibrosis produced in guinea pigs by chronic tehanol adm inistration and immunization with acetadehyde adducts[J]. Hepatology,1995,21(5):1438-1442.
[9] Alison MR,Poulsom R,Jeffery R,et al. Cell differentiation-Hepatocytes from nonhepatic adult stem cells[J]. Nature,2000,406(6793):257.
[10] Kimura T,Wang J,Minaminguchi H,et al. Signal through gp130 activated by soluble interleukin (IL)-6 receptor (R) and IL-6 or IL-6R/IL-6 fusion protein enhances ex vivo expansion of human peripheral blood-derived hematopoietic progenitors[J]. Stem Cells,2000,18(6):444-452.
[11] 叶韵斌,徐莉敏,陈志哲,等.造血细胞生长因子对脐血CD34+细胞短期体外扩增的作用[J].福建医科大学学报,2003,137(2):147-150.
[12] Saito k,Yoshikawa M,Ouji y,et al. Promoted differentiation of cynomolgus monkey ES cells into hepatocyte-like cells by co-culture with mouse fetal liver-derived cells[J].World J Gastroenterol,2006,12(42):6818-6827.
[13] Stefanovic L,Stephens CE,Boykin D,et al. Inhibitory effect of dicationic diphenylfurans on production of type I collagen by human fibroblasts and activated hepatic stellate cells[J]. Life Sci,2005,76(17):2011-2026.
[14] Ueda T,Tsuji K,Yoshino H,et al. Expansion of human NOD/SCID-repopulating cells by stem cell factor,Flk2/Flt3 ligand,thrombopoietin,IL-6,and soluble IL-6 receptor[J]. J Clin Invest,2000,105(7):1013-1021.
[15] Okumoto K,Saito T,Onodera M,et al. Serum levels of stem cell factor and thrombopoietin are markedly decreased in fulminant hepatic failure patients with a poor prognosis[J]. J Gastroenterol Hepatol,2007,22(8): 1265-1270.
[16] Kato H,Shimomura T,Murai R,et al. Regulation of hepatic oval cell proliferation by adenoviral mediated hepatocyte growth factor gene transfer and signal transduction inhibitors[J]. Hepatogastroenterology,2007,54(75): 821-825.
Studyoftheexpansionofc-kit+Lin-cellsandthepotentialofdifferentiationintolivercellinmouse
ZHANGChun-xing1,WANGFang1,LIAOCai-xian2,WUYa-qiong1,JIANGJian-wu1
(1.DepartmentofGeneralSurgery,ShipaiHospitalofDongguanCity,Dongguan523330,China; 2.DepartmentofHepatobiliarySurgery,NanfangHospitalofSouthernMedicalUniversity,Guangzhou510515,China)
ObjectiveTo elucidate the liver function recovery and the translated stem cells’location and differentiation of the hepatic fibrosis female rats induced by alcohol in the group of translated expanded and fresh isolated c-Kit+Lin-cells.MethodsWe used alcohol to establish the female rats hepatic fibrosis model. After the modeling randomly selected eight mice (model group) compared with normal mice (control group) liver function. The remaining mice were randomly selected 32 divided into 4 groups.Randomly selected eight normal mice (group 1)as a control group.C-kit+Lin-cells were isolated from mouse bone marrow by using a high-gradient magnetic cell sorting system (MACS),and expanded with combinations of SCF+ HGF+ FL+LIF +TPO+ IL-3 for 7days in a liquid culture system. We translated the expanding c-kit+Lin-cells into the normal female rats and hepatic fibrosis female rats induced by alcohol. Observe the translated stem cells'location and differentiation in the rats body and count the cells which expressed both gene of Sry,and compare the two group.Results(1) After 30 days,HE and VG histological examination showed that the translated groups were less fibrosis and the control group obviously. (2) After 30 days,AST,ALT,ALB after transplantation compared with pretrans-plant significant difference (P<0.05). (3) Results of hybridization of Y-chromosome determined cDNA and albumin mRNA indicated that in the translated group there existed hepatic cells which derived from stem cells in the liver. The difference was not statistically significant (P>0.05).ConclusionIn this experiment condition,expanding c-Kit+Lin-cell did not effect the stem cells location and differentiation. The liver function recovery in the group translated and fresh isolated c-Kit+Lin-cells ,reverse the liver fibrosis and there existed hepatic cells which derived from stem cells in the liver.
bone marrow derived liver stem cells; MACS; expand and culture in vitro; stem cell transplantation; c-Kit+Lin-cells
10.11724/jdmu.2013.06.07
R457.7
A
1671-7295(2013)06-0538-05
张春兴,王芳,廖彩仙,等. c-Kit+Lin-细胞体外扩增及体内分化的实验研究[J].大连医科大学学报,2013,35(6):538-542.
张春兴(1977-),男,江西吉安人,主治医师,硕士。E-mail:550193985@qq.com
2013-09-16;
2013-11-05)
