阿托伐他汀对脓毒症大鼠C反应蛋白的影响
2013-12-19,,,
, ,,
(大连医科大学 附属第二医院 重症医学科,辽宁 大连 116027)
基础医学
阿托伐他汀对脓毒症大鼠C反应蛋白的影响
顾金萍,于健,王之余,曲茂兴
(大连医科大学 附属第二医院 重症医学科,辽宁 大连 116027)
目的观察阿托伐他汀对脓毒症大鼠血中C反应蛋白(CRP)浓度的影响,探讨他汀类药物是否影响宿主炎症反应。方法选择健康雄性S-D(Sprague-Dawley)大鼠100只,采用盲肠结扎法(CLP)制造大鼠脓毒症模型,随机分为对照组、脓毒症组、阿托伐他汀低剂量组和阿托伐他汀高剂量组,各组25只。于术后0 h,3 h,6 h,12 h和24 h采血,分离血浆检测CRP的浓度。观察和比较各组大鼠活动度,小肠组织病理改变。采用SPSS13.0软件包,于各时间点行重复测量资料方差分析。结果0 h各组大鼠血浆CRP浓度比较差异无显著性意义(P>0.05)。对照组血浆CRP浓度在各时间点变化不明显,在3 h、6 h、12 h、24 h阿托伐他汀低剂量组、阿托伐他汀高剂量组的血浆CRP浓度较脓毒症组和对照组比较差异均有显著性意义,明显低于脓毒症组(P<0.01),阿托伐他汀高剂量组较阿托伐他汀低剂量组血浆CRP浓度降低更明显(P<0.01)。脓毒症组大鼠脓毒症表现最强,阿托伐他汀组脓毒症表现明显减轻,高剂量组较低剂量组减轻更为明显,对照组没有相关表现。结论阿托伐他汀能抑制脓毒症大鼠CRP释放,降低血浆CRP的水平。
脓毒症;阿托伐他汀;C反应蛋白(CRP);大鼠
脓毒症(Sepsis)是由感染引起的临床疾病,为机体局部感染,毒素吸收或者病原微生物直接入血弥漫全身所致,是严重创伤、休克、感染、外科大手术患者常见的并发症,进一步发展可导致脓毒性休克、多器官功能障碍综合征,是临床危重患者最主要的死亡原因之一[1],而Sepsis是否引起死亡主要取决于机体对炎症的反应及其炎症因子的释放。目前,对脓毒症的发病机制尚未完全阐明,病因治疗、液体复苏、血管活性药物治疗、抗生素的使用及抗凝治疗等仍然是目前的主要治疗手段,尽管上述治疗手段不断改进,但脓毒症或脓毒性休克的死亡率仍居高不下,为30%~50%[2]。
他汀类药物(statins)是羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,此类药物通过竞争性抑制内源性胆固醇合成限速酶(HMG-CoA)还原酶,阻断细胞内羟甲戊酸代谢途径,使细胞内胆固醇合成减少。同时,他汀类药物可刺激肝脏细胞,使其摄取胆固醇及其前体增加,从而降低血胆固醇浓度,是治疗心脑血管病的必备药物。他汀类药物同时对内皮细胞,血小板,平滑肌及炎症过程等均有作用。近期的研究显示他汀类药物对内毒素血症的患者有益,一项前瞻性研究证实,患有急性细菌感染的患者,若预先服用他汀类药物,则严重脓毒症的发病率及ICU住院率均下降[3]。一项回顾性分析报道,在388例感染需氧革兰阴性杆菌和金黄色葡萄球菌的患者中,服用他汀类药物的患者死亡率明显低于未服用的患者[4]。
另一项基础实验制作了脓毒症小鼠模型,于脓毒症发生前后均给予他汀类药物,发现其生存率明显高于对照组[5]。由于脓毒症是细菌感染的严重阶段,涉及到多种炎症因子的释放,如肿瘤坏死因子α(TNF-α),白细胞介素1、6、8(IL-1,IL-6,IL-8)等,而他汀类药物改善患者的预后可能与抑制炎症因子的释放有关[1]。本研究的目的是观察他汀类药物对脓毒症小鼠血浆CRP浓度的影响,从而进一步明确他汀类药物干预炎症过程的机制。
1 材料和方法
1.1 仪器设备
DS-88型电子秤(武汉自动化仪表厂),TG16WS高速台式离心机(长沙科学仪器厂), HH-W21-600电热恒温水浴箱(上海医用恒温设备厂),迈瑞MR96A酶标仪。
1.2 试剂和材料
阿托伐他汀(立普妥),20 mg/片,大连辉瑞制药有限公司生产,批号081128。麻醉剂:3%戊巴比妥钠。制作模型的耗材:爱惜康(黑色)编织非吸收性缝线,15 cm×60 cm,由Johnson 公司生产。凯基大鼠CRP ELISA 试剂盒,由南京凯基生物科技发展有限公司生产。
1.3 实验动物分组及给药
100只健康雄性S-D大鼠,体质量184~202 g,购于大连医科大学实验动物中心。在实验室内饲养,环境温度22~25 ℃,空气湿度40%~70%。每5只大鼠置一笼(475 mm×300 mm×200 mm),在笼内自由活动,摄取全价配合饲料并自由饮水,自然长度的昼夜循环。按照随机排列表法分为对照组,脓毒症组,阿托伐他汀低剂量组,阿托伐他汀高剂量组,每组25只。对照组用淀粉40 mg/(kg·d)加入2 mL生理盐水制成混悬液灌胃5 d,术前禁食12 h,腹腔注射3%戊巴比妥钠45 mg/kg麻醉,无菌条件下取下腹正中切口2 cm,翻动盲肠后还纳腹腔,逐层缝合切口,置笼内活动,不禁饮食。脓毒症组术前灌胃与对照组相同,采用盲肠结扎穿孔术(CLP)制作脓毒症大鼠模型。阿托伐他汀组低剂量用研钵粉碎阿托伐他汀,以20 mg/(kg·d)加入2 mL生理盐水制成混悬液连续灌胃5 d,采用盲肠结扎穿孔术(CLP)制作脓毒症大鼠模型。阿托伐他汀组高剂量用研钵粉碎阿托伐他汀,以40 mg/(kg·d)加入2 mL生理盐水制成混悬液连续灌胃5 d,采用盲肠结扎穿孔术(CLP)制作脓毒症大鼠模型。大鼠的给药量参照刘福英,刘田福主编的《实验动物学》[6]。
1.4 盲肠结扎穿孔术(CLP)
术前禁食12 h,腹腔注射3%戊巴比妥钠45 mg/kg麻醉,无菌条件下取下腹正中切口2 cm,暴露盲肠,用丝线结扎盲肠总长度的30%[7],注意避开系膜血管,9号注射针头在盲肠游离端选2个相距3 mm点分别刺孔穿透盲肠,然后将盲肠还纳腹腔,逐层缝合切口,即刻皮下注射生理盐水3 mL/100 g体重以补充术中丢失的液体。术后置笼内活动,不禁饮食。
1.5 大鼠脓毒症严重程度评分标准
采用改良的评定标准[8]进行评分。见表1。
1.6 标本收集
24 h 各取5只大鼠麻醉后,剪去一侧颈部外侧被毛,剪开皮肤,剥离组织,找到颈静脉或动脉后,使各组分别在术后0 h,3 h,6 h,12 h,用注射器采血,在采血管中在静置30 min,4 ℃以4 000 r/min离心15 min,分离出血浆后于-80 ℃冰箱中保存。
1.7 标本检测
CRP应用凯基大鼠 CRP ELISA 试剂盒测定。
1.8 组织病理观察
各组分别在术后0、24 h取空肠标本,置10%甲醛溶液中固定,依次进行常规脱水、石蜡包埋、制成切片、苏木精-伊红(HE)染色后,光镜下检查组织病理学改变。
1.9 统计学方法
采用SPSS 13.0软件包进行统计学处理,计量资料以均数±标准差表示,正态分布变量多组间的比较用方差分析,非正态分布变量用秩和检验,四个处理组之间均数两两比较用LSD-t检验法,以P<0.05为差异具有统计学意义。

表1 大鼠CLP后脓毒症严重程度评分标准
2 结 果
2.1 大鼠一般情况
脓毒症大鼠逐渐出现活动少,不再扎堆取暖,冷漠,皮毛失去光泽,停止饮水,竖毛,有些大鼠呼吸快,眼睛变双环,对被动仰卧无反抗,感觉迟钝,短期内病死率高。腹腔肠系膜充血,肠管显著扩张,结扎盲肠坏死,血性腹水,病灶处大网膜包裹不佳,肝肿大,肺表面充血明显等。 低剂量组出现厌食,竖毛,活动少甚至不活动等情况,肠管轻度扩张,腹水微臭,坏死盲肠被大网膜及周围肠管包裹良好,但局部可见坏死,高剂量组亦出现厌食,竖毛,活动少等情况,肠管轻度扩张腹水减少,坏死盲肠被大网膜及周围肠管包裹明显,对照组没有相关表现。各组大鼠脓毒症严重程度评分见表2。
2.2 各组血浆CRP浓度的比较
0 h各组动物血浆CRP浓度比较差异无显著性意义(P>0.05)。对照组血浆CRP浓度在各时间点变化不明显,在3 h、6 h、12 h、24 h阿托伐他汀低剂量组、阿托伐他汀高剂量组的血浆CRP浓度与脓毒症组和对照组比较差异均有显著性意义,明显低于脓毒症组(P<0.01),阿托伐他汀高剂量组较阿托伐他汀低剂量组血浆CRP浓度降低更明显(P<0.01)。见表3。
2.3 大鼠大体解剖检查
对照组无明显病理改变。脓毒症组均有严重的腹腔炎症,腹腔内有多量浑浊脓性渗出液,可见有血性腹水,肠管水肿粘连,盲肠肿胀坏疽,肝肾充血肿大。阿托伐他汀组脓性渗出液略少,肠管粘连较脓毒症组轻,盲肠肿胀坏疽减轻。高剂量组较低剂量组脓性渗出液少,盲肠肿胀坏疽轻。
2.4 光学显微镜下小肠的病理改变
对照组肠黏膜正常。脓毒症组肠黏膜部分上皮脱落,重度炎症。阿托伐他汀组肠黏膜中度炎症。见图1。
3 讨 论
自从脓毒症被描述到现在,由于其复杂的临床过程加大了治疗的难度,其死亡率一直居高不下。虽然近年来对人体的病理生理有了突破性的认识,并采取了一些创新的治疗技术,但是重症脓毒症的死亡率仍然保持在40%[9],在合并脏器衰竭和休克的患者,有些甚至已超过了50%。
CRP是机体受到微生物入侵或组织损伤等炎症性刺激时肝细胞合成的急性期蛋白。CRP是机体非特异性免疫机制的一部分,它结合C-多糖,在Ca2+存在时可结合细胞膜上磷酸胆碱,可激活补体的经典途径,增强白细胞的吞噬作用,调节淋巴细胞或单核/巨噬系统功能,促进巨噬细胞组织因子的生成。人CRP主要生物学功能:通过与配体(凋亡与坏死的细胞,或入侵的细菌、真菌、寄生虫等的磷酰胆碱)结合,激活补体和单核吞噬细胞系统,将载有配体的病理物质或病原体清除。识别外来物质,激活补体系统。增强调理作用,增强吞噬细胞吞噬作用。与血小板激活因子(RAF)结合,降低炎症反应。与染色体结合,消除坏死组织里的细胞DNA[10]。
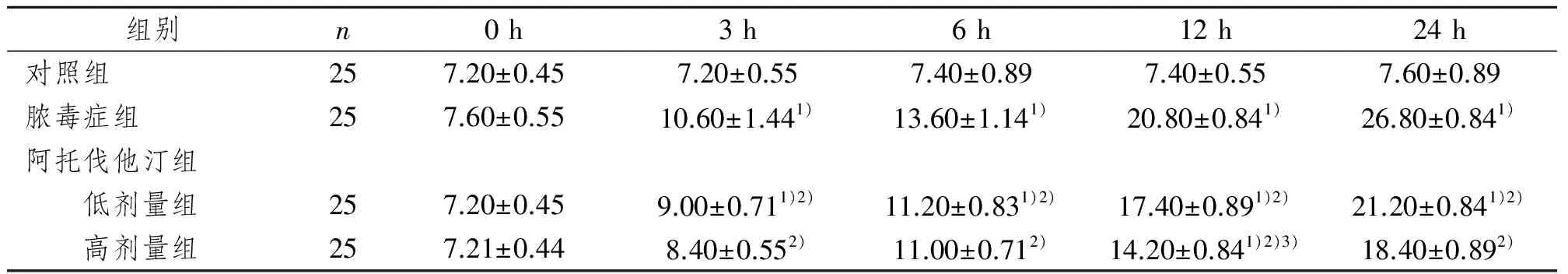
表2 四组大鼠脓毒症严重程度评分比较
1)与对照组相比,P<0.01,2)与脓毒症组相比,P<0.01,3)与低剂量组比,P<0.01

表3 阿托伐他汀对脓毒症大鼠血浆CRP浓度的影响
1)与对照组相比,P<0.01;2)与脓毒症组相比,P<0.01;3)与低剂量组相比,P<0.05

图1 大鼠小肠24 h病理改变(HE ×200)
CRP在炎症开始数小时就升高,48 h即可达峰值,随着病变消退、组织、结构和功能的恢复降至正常水平。此反应不受放疗、化疗、皮质激素治疗的影响。因此,CRP的检测在临床应用相当广泛,包括急性感染性疾病的诊断和鉴别诊断。
近年来研究发现,他汀类药物可以抑制炎性因子的释放,抑制炎性细胞的粘附,降低脓毒血症的发生率和病死率。Thomsen等[11]研究指出,菌血症患者的短期病死率没有影响,但是却可以明显改善细菌感染后30~180 d的病死率 。虽然目前大多数的研究结果支持他汀类药物能改善脓毒血症的预后,但需要有大样本的前瞻性的随机对照研究结果来证实。他汀类药物可降低脓毒症患者的病死率,其中主要机制之一可能与保护血管内皮细胞功能有关。他汀类药物是羟甲基戊二酸辅酶A(HMGCoA)还原酶抑制剂,干扰胆固醇代谢,是目前广泛应用的降脂药物,临床上主要用于高脂血症、冠心病等。越来越多研究显示,他汀类药物不但有降脂作用,还能降低脓毒症患者的病死率[12]。他汀类药物成为近年脓毒症治疗研究的热点,其主要机制之一可能与保护血管内皮功能有关。他汀类药物对脓毒症的有益作用首先在一些动物实验中得到证明。Merx等[5]采用盲肠结扎穿孔术(CLP)复制小鼠脓毒症模型,研究表明,经过他汀类药物预处理的小鼠的平均存活率是对照组的4倍。有临床观察研究表明,他汀类药物治疗对脓毒症患者有益。Kruger等[13]对438例患者66例 (占总人群的15%)入院前正在服用他汀类药物,而且其中85%患者入院后仍继续接受他汀类药物治疗进行的回顾性调查研究发现,他汀类药物治疗对脓毒症患者有益,他汀治疗组与对照组相比,28 d总病死率(10.6%vs 23.1%,P=0.022)和由脓毒症所致的病死率(6.1% vs 18.3%,P=0.014)显著下降。Alomog等[14]在对肺炎、泌尿系感染和蜂窝织炎患者(这些患者的APACHEⅡ评分11.1±7.2)的前瞻性队列研究中也表明,他汀类药物可降低严重脓毒症发生率和ICU住院率。
临床研究资料显示他汀类药物能够显著降低患者体内的多种炎症介质,从而抑制炎症细胞因子、趋化因子及黏附分子的表达,降低CRP的水平。在Reversal试验中阿托伐他汀具有更强的降低CRP的作用。在新近发表的TARA研究表明,阿托伐他汀治疗6个月后病变活跃积分(DAS28)显著改善,CRP及ESR指标同样有显著改善。大量临床研究提示他汀类药物具备独特的抗炎效果[15]。其抗炎作用机制主要包括减弱炎症细胞向斑块内趋化聚集、抑制巨噬细胞可溶性细胞间黏附分子以及金属蛋白酶的表达等,其中减少巨噬细胞和白细胞介素-6(IL-6)的合成是主要机制。目前不少研究的结果也提示他汀类药物的抗炎作用与免疫调节密切相关。
本实验研究结果提示,脓毒症组CRP指标较阿托伐他汀组均明显升高,阿托伐他汀高剂量组的CRP指标低于低剂量组,考虑阿托伐他汀可能具有抗脓毒症作用。希望逐渐把相关的研究应用于临床,对脓毒症的治疗带来益处。
[1] Kumana CR,Cheang BM,Lauder IJ. Simvastatin reduced mortality and vascular events in high-risk patients[J].ACP J Club,2003,138(1):2-3.
[2] Ascan W,Sabine G Z,Thomas M. Should treatment of sepsis include statins?[J]. Circulation,2005,111(14):1735-1737.
[3] Almog Y,Shefer A,Novack V,et al. Prior statins therapy is associated with a decreased rate of severe sepsis[J]. Circulation,2004,110(7):880-885.
[4] Gao F,Linhartova L,Johnston AM,et al. Statins and sepsis[J].Br J Anaesth,2008,100(3):288-298.
[5] Merx MW,Liehn EA,Janssents U,et al. HMG-CoA reductase inhibitor simvastatin profoundly improves survival in a murine model of sepsis[J]. Circulation,2004,109(21):2560-2565.
[6] 刘福英,刘田福.实验动物学[M]. 北京:中国科学技术出版社,2005:209-210.
[7] 燕晓雯,李维勤,黎介寿,等. 通过改变盲肠结扎长度制造不同感染程度的大鼠盲肠结扎穿孔模型[J].中华实验外科杂志,2007,24(12):1340.
[8] Terblanche M,Almog Y,Rosenson RS,et al. Statins and sepsis: multiple modifications at multiple levels[J].Lancet Infect Dis,2007,7(5):358-368.
[9] Balk RA. Pathogenesis and management of multiple organ dysfunction of failure in severe sepsis and septic shock[J]. Crit Care Clin,2000,16(2):337-352.
[10] Sierna R,Rello J,Bailen MA,et al. C reative protein used as an early indicator of infection in patients with systemic inflammatory response syndrome[J].Intensive Care Med,2004,30:2038-2045.
[11] Thomsen RW,Hundborg HH,Johnsen SP,et al. Statin use and mortality within 180 day after bacteremia: A population based cohort study[J].Cirt Care Med,2006,34(4):1080-1086.
[12] Hackam DG,Mamdani M,Li P,et al. Statins and sepsis in patients with cardiovascular disease: a population-based cohort analysis[J]. Lancet,2006,367(9508):413-418.
[13] Kruger P,Fitzsimmons K,Cook D,et al. Statin therapy associated with patients with bacteremia [J]. Intensive Care Med,2006,32(1):75-79.
[14 ] Alomog Y,Shefer A,Novack V,et al. Prior statin therapy associated with a decrease rate of severe sepsis [J] .Circulation,2004,110(7):880-885.
[15] McCarey DW,Melunes IB,Madhok R,et al.Trial of Atorvastatin in Rheumatoid Arthritis(TARA):double-blind,randomized placebo-controlled trial[J].Lancet,2004,363(9426):2015-2021.
EffectsofAtorvastatinonlevelsofC-responseproteininsepsisrats
GUJin-ping,YUJian,WANGZhi-yu,QUMao-xing
(IntensiveCareUnit,theSecondAffiliatedHospitalofDalianMedicalUniversity,Dalian116027,China)
ObjectiveTo investigate the influences of atorvastatin on C-response protein (CRP) of rats with sepsis. To discuss whether the statins would affect the host response to inflammation.MethodsSepsis models were establishing using 100 male SD rats. The rats were manufactured models by cecal ligation and puncture (CLP). A total of 100 healthy rats randomly were divided into 4 groups (n=25): Sham-operation group,CLP group,low-dose atorvastatin group and high-dose atorvastatin group. Blood samples of five rats in each group were collected at postoperative 0,3,6,12 and 24 hours to detect CRP in plasma. We observed and compared the activity of rats in each group. Specimens of small intestine were taken for pathological examination by optical microscope.ResultsAt 0 h,plasma CRP levels were not significantly different among the groups.CRP levels in low-dose and high-dose atorvastatin groups were both significantly lower at postoperative 3,6,12 and 24 hours (P<0.01) than those in CLP group. CRP levels in high-dose atorvastatin group were significantly lower than those in low-dose group (P<0.01) at the four time points.ConclusionAtorvastatin could inhibit the expression of CRP in blood plasma of sepsis rats,and might have anti-septic effect.
sepsis; atorvastatin; C response protein; rat
10.11724/jdmu.2013.06.06
R631
A
1671-7295(2013)06-0533-05
顾金萍,于健,王之余,等.阿托伐他汀对脓毒症大鼠C反应蛋白的影响[J].大连医科大学学报,2013,35(6):533-537.
大连医科大学附属第二医院院内青年科研基金项目(2008)
顾金萍(1976-),女,山东陵县人,副主任医师,硕士。E-mail:gjpking5460@163.com
于 健,教授。E-mail:yujian@medmail.com.cn
2013-09-11;
2013-11-10
