人血清白蛋白基因在鹌鹑两种细胞上表达的研究
2013-12-18洪志勇李玉芳2李明张兴峰林秀娇李鸿翔庄益芬张文昌
洪志勇李玉芳,2李 明张兴峰林秀娇李鸿翔庄益芬张文昌*
(1.福建农林大学动物科学学院 福州 350002;2.黄淮学院 河南驻马店 463000)
鹌鹑属于鸟类,是高等脊椎动物,与其他动物相比,以转基因技术为依托的禽类生物反应器有着巨大的经济效益。然而,鹌鹑在长期的生物进化中,形成了自己独特的生理结构与生活习性,尤其是其独特的生殖解剖和生殖生理特点,完全不同于哺乳动物的特殊生殖模式,使得现有的应用于哺乳动物的基因转移方法不能完全套用,须在深入了解禽类具体的生理特点的基础上,结合哺乳动物基因转移策略进行创新和改进。
制备转基因鹌鹑,通过对转基因鹌鹑蛋中的蛋清蛋白进行分析,是检测构建的表达载体有效与否的最准确的方法,但是转基因鹌鹑的制备需要耗费大量的人力、物力,并且试验周期长,步骤繁琐,在试验过程中,不同的转基因个体也存在着很大差异,也会对表达的结果造成许多偏差。通过细胞培养技术可以弥补以上不足,首先对输卵管上皮细胞进行体外培养,然后利用脂质体介导转染技术将外源基因导入细胞内,通过检测外源基因在输卵管上皮细胞上的表达来验证表达载体构建及目的基因表达的正确性。相对于转基因的个体而言,该方法简单,结果明确,试验周期短,常用于制备转基因动物前对载体各元件功能的检测和筛选。
Ochiai等[1-2]将 1.35 kb 的卵清蛋白基因 5’调控区调控的人促红细胞生成素(EPO)基因通过电穿孔法导入原代输卵管上皮细胞,探讨了hEPO基因转录的可能性;接着又用电脉冲法导入活鸡的输卵管上皮细胞,证明了hEPO在输卵管内表达的可能性。宇丽等[3]把1.1 kb的卵清蛋白5’端调控区调控的CAT基因通过脂质体技术,转染鸡原代输卵管上皮细胞和鸡成纤维细胞,结果在鸡原代输卵管上皮细胞转染48 h后表达量最高;而在鸡成纤维细胞,不论有无类固醇存在,均不表达。结果说明,在输卵管细胞中存在细胞特异性转录因子。
20世纪60年代Banghan发明了脂质体,Robert在80年代初将脂质体用于质粒的包裹,1987年美国生命技术公司推出了合成的脂质体试剂,使之广泛应用于动物细胞的转染。脂质体介导的方法具有可重复、持续、高效、易操作,对细胞毒害作用小,不受外源基因大小及细胞种类(指动物细胞)的限制,体内外都有较高的转染效率等优点[4-6],在转基因动物的制备研究中深受欢迎,应用越来越广泛,尤其是近几年发展得更快,己成为动物细胞转染的常规方法。但该方法尚存在稳定性及核酸包裹率等问题也不能用于带壁细胞,仍需进一步完善。
试验选择培养2种细胞对构建的载体进行检测,筛选出阳性细胞,目的是通过将构建的人血清白蛋白表达载体在这两种鹌鹑自身的细胞中进行转染,然后提取基因组DNA用PCR方法和SDSPAGE方法来对构建的蛋白表达载体的有效性进行检测和筛选。
1 材料和方法
1.1 材料
1.1.1 细胞和质粒 日本鹌鹑及幼雏由本研究室饲养和孵化;人血清白蛋白基因真核荧光表达载体:pEGFP-VH。
1.1.2 主要试剂 质粒提取试剂盒购自上海生物工程公司;胎牛血清、DMEM-F12培养液均购自厦门泰京生物公司;Lipofectin TM Reagent购自Introgen公司;雌二醇、皮质酮、胰岛素均购自华美公司。
1.2 方法
1.2.1 质粒pEGFP-VH的纯化 从37℃培养16~20 h的新鲜培养板中挑取1个大肠杆菌单菌落,转到含有100 mL LB培养基的锥形瓶中,37℃振荡培养16~24 h,提取质粒并纯化。
1.2.2 鹌鹑输卵管上皮细胞的原代培养 取4日龄鹌鹑幼雏,连续10 d饲喂15 mg乙烯雌酚(DES),然后撤掉DES,1周后改为连续15 d饲喂25 mgDES,在幼雏处死之前48 h撤掉DES。处死幼雏,取输卵管膨大部分,剪成 1~2 mm 碎块(净重 0.5~1 g),在40 mL 解离液(F12)中孵育 30 min。放置 2~3 min,去除上清液。其余部分加入新鲜的解离液,继续孵育30 min。静置2~3 min后,将上清液移入50 mL离心管中,加入胎牛血清,离心5 min,清洗沉淀2次。最后将细胞重新悬浮在无血清DMEM-F12(1:1)混合培养液中(含抗生素和0.1%BSA),以1×106ce11/孔接种到24孔培养板,立即转染。
1.2.3 鹌鹑成纤维细胞的培养
1)胚胎的采取。取10日龄鹌鹑胚胎,气室端用5%碘酒消毒,敲开一小口,用镊子将胚胎取出,置于无菌平皿内(事先放入PBS液)。去头、内脏和四肢。
2)成纤维细胞的分离。用Hanks去除血细胞、色素物质及细胞碎片后,移入链霉素小瓶内,剪成1~2 mm碎块。再用PBS液洗2~3次。加入500μL 0.25%胰蛋白酶-0.02%EDTA混匀后,37℃消化10 min,过滤,将上清液离心(600 r/min、10 min),弃上清液,再用DMEM-F12培养液悬浮沉淀,过滤,移至另一离心管中,离心(1 500 r/min、5 min),培养液洗涤细胞2次,取沉淀物加营养液(含3%小牛血清),于细胞计数板上计数。
3)成纤维细胞的培养。将成纤维细胞稀释成5×105/mL左右放入100 mL培养瓶中,加入10 mL培养液,放入37℃、5%CO2、湿度75%的二氧化碳培养箱中培养。24 h后倒掉营养液,用PBS洗2次,去除杂质细胞,每24 h更换营养液。待细胞铺满瓶底时倒弃营养液,再用PBS溶液洗涤细胞,加入1 mL消化液,室温消化1 min,在显微镜下观察到梭形细胞纤维消失、大部分细胞收缩成圆球形时,加入2 mL含15%FBS的培养液,混匀,终止消化。将消化后的细胞悬液转至离心管中,3 000 r/min离心5 min后弃上清,加入DMEM-F12培养液,离心洗涤2次后,加1 mL营养液混匀,显微镜下用细胞计数器计数,放入37℃、5%CO2、湿度75%的二氧化碳培养箱中继续培养。
1.2.4 转染 制备DNA-Lipofectamine(即 DNA-脂质体)混合物(30 min内完成),并设计转染HAS基因的试验组、对照组和转染空质粒的输卵管上皮细胞组。将转染后细胞放到50 mL离心管中离心5 min。再以DMEM-F12悬浮细胞,离心弃上清液。加入含有10%胎牛血清的F12培养液、10-7mo1/L雌二醇、10-6mo1/L皮质酮、40 ug/L胰岛素,加培养液至3 mL,37℃、5%二氧化碳培养箱中孵育培养。
1.2.5 观察与检测 转化的细胞用荧光显微镜观察,收集细胞及上清液,检测转染水平。每隔12 h将其置于倒置荧光显微镜上观察pEGFP-VH质粒在鹌鹑原代输卵管上皮细胞和鹌鹑成纤维细胞中绿色荧光蛋白的表达。待转染72 h收集细胞上清液。
1.2.6 转染细胞外源基因表达的初步检测 稳定转染鹌鹑输卵管上皮细胞采用PCR检测和HSA蛋白表达检测。
2 结果与分析
2.1 鹌鹑输卵管上皮细胞的培养及其转染结果
试验获得的鹌鹑输卵管上皮细胞培养16 h时,细胞开始贴壁;48 h后细胞增多,贴壁上皮细胞蔓延生长,呈圆形或条状;72 h后细胞增长缓慢,体积变大,少数细胞脱落死亡。见图1-图2。
图1 原代培养的鹌鹑输卵管上皮细胞

图2 HSA真核表达载体在鹌鹑原代输卵管上皮细胞中的表达
2.2 鹌鹑成纤维细胞的培养及转染结果 试验分离的鹌鹑成纤维细胞及其细胞核均呈圆形或椭圆形,细胞前期贴壁生长良好,呈梭形(传代后1 d),生长速度快,DMEM-F12培养液(含10%FBS)能很好地维持其生长需要,接种后2 h左右开始贴壁生长,2~3 d即可铺满瓶底,经过3~5次传代后,生长速度明显变慢,体积成不规则状,见图3。pEGFPVH在鹌鹑胚胎成纤维细胞中48 h时未见绿色荧光表达。

图3 鹌鹑胚胎成纤维细胞
2.3 转染细胞外源基因表达的初步检测 提取转染的、未转染的和转染空质粒的输卵管上皮细胞基因组DNA,PCR检测显示仅在转染组扩增获得约1 900 bp的片段,而对照组无此条带,说明HSA基因已经稳定整合到输卵管上皮细胞基因组中(见图4)。
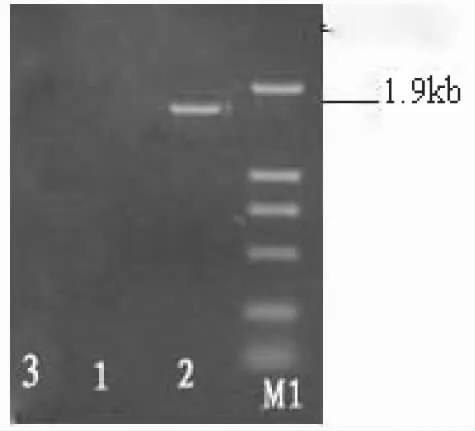
图4 转染的阳性细胞PCR检测结果
2.4 HSA表达检测结果 在分泌表达载体转染鹌鹑输卵管上皮细胞和成纤维细胞培养72 h后收集细胞上清液,用盐析方法沉淀蛋白,透析、浓缩,最后进行SDS-PAGE电泳检测蛋白成分。结果显示,仅在转染HSA基因的鹌鹑输卵管上皮细胞培养液上清中出现了分子量约68 kDa的蛋白条带,而在未转染的和转染空质粒的鹌鹑输卵管上皮细胞的培养液上清中未见目的蛋白条带,结果见图4-图5。

图5 HSA蛋白的SDS-PAGE结果(银染色)
3 讨论
本试验通过脂质体阳离子介导方法将HAS基因导入到鹌鹑输卵管上皮细胞成纤维细胞,在培养48 h后荧光显示。输卵管生物反应器的研究是从输卵管上皮细胞的培养以及在培养的输卵管细胞内和在活鸡的输卵管内研究外源基因的表达开始的。1967年Ma11ey等首先进行了鸡输卵管组织的培养,虽然输卵管能贴壁成单层的细胞,但生长缓慢。最初培养输卵管细胞的目的并不是用来制作生物反应器,1978年Mcknight等用输卵管细胞来研究抗生物素蛋白。Sa11y等[7]首先研究成功鸡输卵管细胞培养系统,输卵管细胞能快速增殖,并被诱导表达了白蛋白。
目前,研制生物反应器,需要供受体动物的数量较多,试验周期较长,研制成本较高[8]。为了减少试验的盲目性、缩短试验周期和降低成本,不同的转基因个体也存在着很大差异,也会对表达的结果造成许多偏差。有必要在动物转基因之前,利用一些简便、经济、客观的方法对基因的表达特性进行初步验证。目前常用的方法有细胞表达分析法和转基因小鼠分析法。禽类输卵管生物反应器成功的关键在于使用卵清蛋白调控元件,构建合理有效的输卵管组织特异性表达载体。因此,表达载体构建的合理性和有效性,快速检测系统的建立对于这一研究领域具有重要意义。禽类输卵管上皮细胞是研究乳蛋白基因表达及调控的理想细胞模型。体外适当条件下培养的原代输卵管上皮细胞能保持原有的细胞分化和表达能力,利用脂质体介导转染方法将外源基因导入到细胞中,通过提取基因组DNA、PCR方法检测外源基因整合到细胞的情况;蛋白水平检测,主要通过SDS-PAGE检测外源蛋白的分泌表达。
显微镜观察荧光表达情况,输卵管上皮细胞中有表达报告基因GFP的细胞,分泌型的EGFP在细胞质中分布不均,呈斑点状存在,荧光强度参差不齐,细胞核不易分辨,这可能与分泌型蛋白在细胞质网膜系统中运转有关。而在鹌鹑成纤维细胞中未见清晰的荧光表达细胞,这可能是成纤维细胞缺乏卵清蛋白调控序列所需的凡是作用因子有关。宇丽等[9]将氯霉素乙酰转移酶(CAT)基因与克隆的鸡卵清蛋白上游5’调控区1.1 kb的序列融合,构建了表达载体,转染鸡原代输卵管上皮细胞和鸡成纤维细胞,结果在鸡成纤维细胞上,不论有无类固醇激素存在,均不表达;而在鸡原代输卵管上皮细胞上,转染后48 h表达量最高,为 0.67 μg/L。Dierich等[10]用纤维注射的方法将含有卵清蛋白5’调控序列的质粒表达载体转入多种细胞,结果外源基因也不在鸡胚成纤维细胞、肾细胞和其他非鸡源细胞中表达。这与本试验的结果是一致的。
[1] Muramatsu T,Imai T.Gene gun-mediated in vivo ana1ysis of tissue repression of gene transcription driven by the chicken ova1bumin promotor the 1iver and oviduct of 1aying hens[J].Mo1Ce11Biochem,1998,185(1/2):27-32.
[2] Ochiai H,Park H M,Sasaki R,et a1.Gene gun-mediated human erythropoietin gene expression in pI cu1tured oviduct ce11s from 1aying hens[J].Asian-Aust JAnim Sci,1999,12(1):9-14.
[3] 宇丽,赵君,张艳玲,等.鸡卵清蛋白基因上游调控序列表达载体的构建及其在鸡原代输卵管上皮细胞及鸡成纤维细胞的表达[J].中国兽医学报,2001,21(1):21-24.
[4] 王瓞,林其谁.核酸转染技术和阳离子脂质体[J].细胞生物学杂志,1998,20(1):21-25.
[5] 陈吉祥,薛飞群,李广林,等.脂质体介导基因转移的研究进展[J].微生物学通报,1999,26(3):223-225.
[6] 杨静平,孔玉英.脂质体——高效介导DNA转染的新试剂[J].生物化学与生物物理学报,1993,25(3):231-237.
[7] Sa11y S,Seaver S,Raird,et a1.The chicken oviduct intissue cu1ture[J].Exp Ce11Res,1984,155:256-260.
[8] 李震,陈永福.乳腺生物反应器细胞模型建立的问题探讨[J].农业生物技术学报,1997,5(2):148-152.
[9] Yu L,Zhao J,Zhang Y L,et a1.Construction of the expression vector 5’f1anking regu1atory regions of the chicken ova1bumin gene in chicken primary oviduct ce11 and chicken fibrob1asts ce11 cu1tures.[J].Chinese Journa1 of Veterinary Science,2001,21(1):21-24.
[10] Dierich A,Gaub M P,Lepennec JL,et a1.Ce11-specificity of the chicken ova1bumin and cona1bumin promoter[J].EMBOJ,1987(6):2305-2312.
