银杏内酯B对TNFα诱导的人内皮细胞活性氧产生的影响及其机制
2013-12-18于晓红王小明
于晓红, 王小明, 朱 皓, 李 真, 刘 俊
(1. 大连医科大学 附属第一医院 心内科,辽宁 大连 116011;2. 中国协和医科大学 基础医学院 病理生理系,北京 100005)
基础医学
银杏内酯B对TNFα诱导的人内皮细胞活性氧产生的影响及其机制
于晓红>1, 王小明>2, 朱 皓>1, 李 真>1, 刘 俊>1
(1. 大连医科大学 附属第一医院 心内科,辽宁 大连 116011;2. 中国协和医科大学 基础医学院 病理生理系,北京 100005)
目的探讨银杏内酯B(GB)对TNFα刺激的人脐静脉内皮细胞(HUVECs)中活性氧(ROS)产生的影响及其机制。方法将预先培养好的HUVECs分组:正常对照组;TNFα刺激组;GB预处理组:分别用GB(25 mg/L),GB(50 mg/L),GB(100 mg/L)预处理细胞1 h后再用TNFα刺激24 h;质粒转染组:用转染p47phox的siRNA作用24 h后再用TNFα刺激24 h。用小分子RNA干扰(siRNA)技术消除人脐静脉内皮细胞的NADPH 氧化酶p47phox亚基; 用分子探针2,7-DCF测定各组细胞内ROS的产生量;用RT-PCR、细胞免疫组化及Western blotting等方法检测处理后各组细胞的p47phoxmRNA和蛋白的表达。结果TNFα刺激使细胞内ROS的产生量较对照组增加了155.4%(P=0.003);GB(25 mg/L),GB(50 mg/L),GB(100 mg/L) 分别使TNFα诱导的HUVECs内ROS的水平降低了9.2%(P=0.157),35.4%(P=0.014),48.0%(P=0.005)。TNFα作用细胞24 h后, p47phox的mRNA表达水平较对照组增加了212.8%(P=0.009),蛋白表达增加了156.2%(P=0.001);GB预处理使TNFα诱导的p47phoxmRNA表达水平降低了43.6%(P=0.021),蛋白表达水平降低了53.0%(P=0.002)。p47phox的siRNA完全阻断TNFα诱导ROS的产生。结论GB能够抑制内皮细胞中TNFα诱导的ROS的产生,主要机制是通过抑制NADPH氧化酶p47phox亚基的表达。
银杏内酯B;肿瘤坏死因子α;内皮细胞;活性氧
血管内皮细胞损伤是动脉粥样硬化、高血压等常见心血管病的重要发病原因。活性氧(reactive oxygen species, ROS)的过度产生或与其清除机制的失衡能够导致氧化应激,损害血管内皮细胞的功能,甚至导致细胞凋亡或坏死[1-2]。因此,有效地阻断ROS引起的血管内皮细胞的氧化应激损伤是预防动脉粥样硬化、高血压等心血管疾病的重要途径之一。近年来,银杏叶提取物以其众多的有效成分在治疗心脑血管疾病方面引起国内外学者的重视,对其化学成分,药理作用及应用作了大量的研究工作,但对其是否能阻断ROS引起的人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)中氧化应激损伤报道较少。本研究旨在探讨银杏内酯B(ginkgo biloba, GB)对肿瘤坏死因子α(tumor necrosis factor, TNFα)刺激的HUVECs中ROS产生的影响及其机制。
1 材料和方法
1.1 材 料
主要试剂:Medium 200培养基、50×低血清细胞生长补充物为美国Cascade公司产品;TNFα和RNAi-Ready pSIREN-Shuttle 载体为美国R&D公司产品;银杏内酯B购自国家药品监督管理局生物制品检定所;Ⅰ型胶原酶和胰酶购自美国Sigma公司;TRIZOL试剂opti-MEM Ⅰ 培养基和 LIPOFECTAMINETM 试剂为美国Giboco公司产品;p47phox抗体购自美国Santa Cruz 公司;siRNA片段、p47phox等基因的扩增引物由上海博亚公司合成;其余试剂均为进口分装或国产分析纯化。
1.2 方 法
1.2.1 p47phoxsiRNA表达载体的构建:根据p47phox的基因序列设计并合成siRNA片段,其序列为:5′GATCCGCTATGCAGGTGAGCCATACTTCAAGAGA-GTATGGCTCACCTGCATAGTTTTTACGCGTG3′和5′AATTCACGCGTAAAAAACTATGCAGGTGAGCCATA-CTCTCTTGAAGTATGGCTCACCTGCATAGCG3′,将两段互补的寡核苷酸退火后进行5′末端磷酸化,反应体系为10 μL,其中10×T4 DNA多核苷酸激酶反应缓冲液(Tris-HCl 500 mmol/L, MgCl2100 mmol/L, DTT 50 mmol/L )1 μL,ATP(10 mmol/L)2.5 μL,退火产物2.5 μL,T4 DNA 多核苷酸酶(10 U/μL ) 1 μL,ddH2O 3 μL。反应在37 ℃进行30 min。将磷酸化后的产物与具有BamH1和EcoR1黏性末端的RNAi-Ready pSIREN-Shuttle 载体相连接,反应体系为:10×T4 DNA 连接酶反应缓冲液(Tris-HCl 660 mmol/L, MgCl266 mmol/L,DTT 100 mmol/L, ATP 1 mmol/L)1 μL,RNAi-Ready pSIREN-Shuttle 载体 1 μL,磷酸化产物4 μL,T4 DNA连接酶1 μL,ddH2O 3 μL,总体系10 μL,16 ℃反应16 h。
将5 μL连接产物转化大肠杆菌DH5α感受态细胞,用北京天为时代公司的DP109型质粒小量提取试剂盒(无内毒素型)提取质粒。构建成功的p47phoxsiRNA表达载体,最后经酶切鉴定和测序证实。
1.2.2 HUVECs的培养及处理:HUVECs的分离参照Jaffe等[4]的方法进行。无菌条件下取健康新生儿脐带,用0.2%胶原酶消化,收集细胞,加入含50×低血清细胞生长补充物的Medium 200培养液,置37 ℃、5%CO2培养箱中培养,待细胞达90%融合时,进行实验或传代,本实验选用第2~5代细胞,采用内皮细胞的形态及其特异表达Ⅷ因子免疫组化法进行了阳性鉴定。细胞分为(1)正常对照组:正常培养的HUVECs细胞;(2)TNFα刺激组:应用TNFα(200 U/mL)作用24 h;(3)GB预处理组:分别用GB(25 mg/L),GB(50 mg/L),GB(100 mg/L)预处理1 h,之后再用TNFα(200 U/mL)作用24 h;(4)质粒转染组:用转染p47phox的siRNA作用24 h,之后再用TNFα(200 U/mL)作用24 h,同时应用转染空载体(hU6pro vector)作为对照。各组光镜下检测活细胞数均>95%。
1.2.3 质粒转染:HUVECs接种至6孔板,用无血清、无抗生素培养基培养至80%~90%融合时转染p47phox的siRNA,同时用转染空载体(hU6pro vector)的细胞作对照。转染时,先将转染试剂lipofectinTM3 μL和质粒DNA 1 μg分别用Opti-MEM培养基稀释至100 μL,然后混匀,在室温孵育15~45 min后加入800 μL Opti-MEM培养基,将混和液均匀加入6孔板内。细胞移入37 ℃的孵箱中孵育6 h,并更换完全培养基继续培养18 h后加入TNFα。
1.2.4 细胞内ROS的测定:细胞内ROS测定采用2,7-二氯荧光黄(DCF)。2,7-DCF 以二乙酯的形式进入细胞, 在ROS 的作用下转变为2,7-DCF,其发射荧光强度反映氧应激水平。于测定ROS前,在经过上述处理的HUVECs中加入50 μmol/L 2,7-DCF,作用50 min。用0.25%胰蛋白酶消化细胞,收集至1.5 mL EP管中,细胞用Hank's 液洗2次,用1 mL Hank's 液重悬细胞,然后用荧光分光光度计测定荧光强度(fluorescence intensity,FI),其激发波长为488 nm, 发射波长为510 nm。
1.2.5 半定量RT-PCR分析:用Trizol试剂按说明提取细胞总RNA,测定RNA浓度后进行RT-PCR反应。反转录反应体系为20 μL,含 RNA 2 μg,随机引物0.5 μg,M-MLV RT 5×缓冲液(Tris-HCl 250 mmol/L, KCl 375 mmol/L, MgCl215 mmol/L, DTT 50 mmol/L)4 μL, dNTPs(2.5 mmol/L) 3 μL, MMLV反转录酶 100 U和ddH2O 10 μL,37 ℃反应90 min。p47phox基因的上游引物:5′ACC TTC ATC CGT CAC ATC G 3′,下游引物:5′TCA AAC CAC TTG GGA GCT G 3′,扩增产物p47phox基因为250 bp;内参照GADPH的上游引物:5′GCG CCT GGT CAC CAG GGC TGC TT 3′,下游引物:5′TGC CGA AGT GGT CGT GGA TGA CCT 3′,扩增产物为465 bp。反应条件:95 ℃预变性3 min, 于80 ℃水浴中加入Taq 酶后,95 ℃变性40 s,52 ℃退火40 s,72 ℃延伸90 s,循环35次后于72 ℃延伸5 min。PCR产物以1.0%琼脂糖凝胶电泳,并在紫外线下成像、扫描。
1.2.6 Western blotting 检测:胞核蛋白的制备:参考文献进行[5],弃去培养基,冷PBS冲洗2遍,刮下细胞于15 mL离心管中离心5 min,除去上清。加入300 μL Buffer A,冰浴30 min,加入10% NP-40 18 μL,振荡10 s,吹打。4 ℃, 离心10 min,弃去上清。加入100 μL Buffer B,充分吹打于-70 ℃和37 ℃冻融循环1次,4 ℃,离心15 min,收集上清液即为胞核蛋白,Bradford蛋白定量后分装,于-70 ℃保存备用。Buffer A、B的配制参照文献进行[6]。
Western 印迹分析:参照文献进行[6],20 μg胞核蛋白经10% SDS聚丙烯酰胺电泳分离后,电转到PVDF膜上,与p47phox抗体4 ℃孵育过夜,与相应的二抗室温孵育1 h,采用增强化学发光法进行检测。
1.2.7 细胞免疫化学分析:PBS洗细胞3次,4%多聚甲醛固定,4 ℃,30 min。PBS冲洗3次,新配制的3% H2O2作用细胞30 min,以消除内源性过氧化物酶(HP)的活性。去上清,PBS冲洗3次,0.5% Triton X-100 PBS作用细胞20 min,以增加细胞膜通透性。去上清,PBS冲洗3次,10%山羊血清室温孵育15 min,以封闭所有抗体。弃血清,加入1∶100倍稀释的相关抗原抗体(阴性对照组除外),置于湿盒内,4 ℃过夜。PBS冲洗3次,加入1∶200稀释的生物素标记的二抗,湿盒内室温作用15~30 min。PBS冲洗3次,加入1∶100稀释的HP标记的链霉卵白素(Strepavdin),37 ℃,湿盒内作用15~30 min。PBS冲洗3次,加入现配制的DAB液发色,显微镜下观察,及时流水终止反应,明胶封片,照相。
1.3 统计学方法
2 结 果
2.1 GB对TNFα刺激的人内皮细胞ROS产生的影响
结果如图1所示,TNFα(200 U/mL)作用 HUVECs 24 h 使细胞内ROS的产生量较对照组增加了155.4%(P=0.003);预先用不同浓度的GB处理HUVECs 1 h,再以TNFα作用24 h,GB剂量依赖的抑制TNFα诱导的细胞内ROS的水平。GB(25 mg/L),GB(50 mg/L),GB(100 mg/L) 分别使TNFα诱导的HUVECs内ROS的水平降低了9.2%(P=0.157),35.4%(P=0.014),48.0%(P=0.005)。
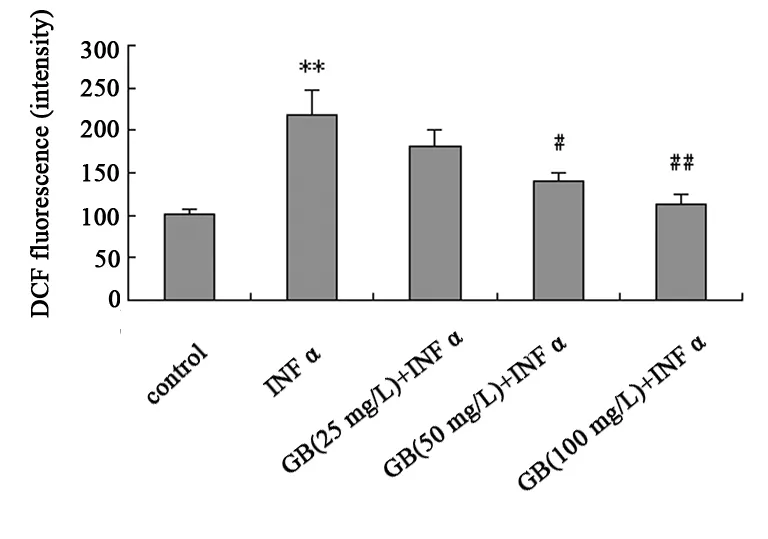
图1 GB剂量依赖的抑制TNFα诱导的HUVECs内ROS的水平
** compared with the controlP<0.01; # compared with the group treated by TNFα aloneP<0.05; ## compared with the group treated by TNFα aloneP<0.01
2.2 转染p47phoxsiRNA对TNFα刺激内皮细胞p47phoxmRNA和蛋白表达的影响
采用siRNA技术消除HUVECs的NADPH 氧化酶p47phox亚基后,在对照组的HUVECs中,p47phoxmRNA和蛋白的表达非常低,TNFα(200 U/mL)作用24 h后, p47phoxmRNA和蛋白的表达均较对照组明显增加;但在转染p47phoxsiRNA的细胞, TNFα作用后细胞内几乎未见p47phoxmRNA及蛋白的表达。见图2和图3。
2.3 转染p47phoxsiRNA对TNFα刺激内皮细胞ROS产生的影响
图4显示,TNFα(200 U/mL) 作用HUVECs 24 h后,细胞内ROS的产生量较对照组增加了155.4%(P=0.003);而转染p47phoxsiRNA完全阻断了TNFα诱导的细胞内ROS的产生。
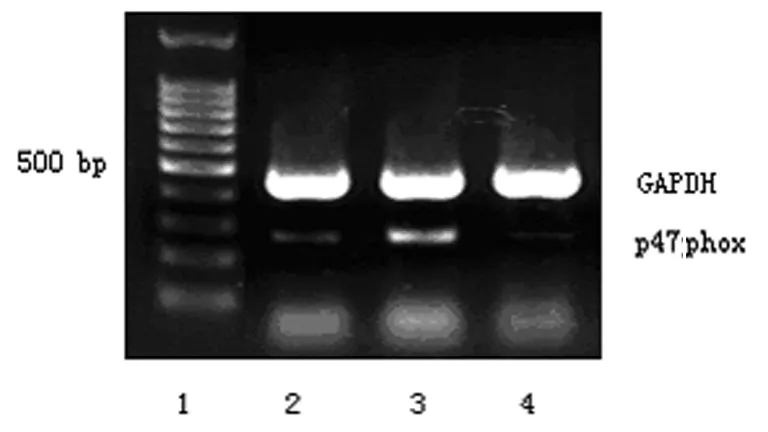
图2转染p47phoxsiRNA对TNFα诱导HUVECs内p47phoxmRNA表达的影响
Fig 2 Effect of p47phoxsiRNA on TNFα-induced mRNA expression of p47phoxin HUVECs
1. 100 bp DNA ladder; 2. control; 3. TNFα; 4. p47phoxsiRNA+TNFα

图3 免疫细胞化学方法检测转染p47phoxsiRNA对TNFα诱导HUVECs 中p47phox蛋白表达的影响 (×40)
A.对照组细胞,p47phox蛋白表达非常低;B.应用TNFα(200 U/mL)作用24 h后细胞内p47phox蛋白表达明显增加;C.转染p47phoxsiRNA 24 h后再用TNFα(200 U/mL)作用24 h,细胞内几乎未见p47phox蛋白表达

图4转染p47phox的siRNA对TNFα诱导的HUVECs内ROS产生的影响
** compared with the controlP<0.01; ## compared with the group treated by TNFα aloneP<0.01
2.4 GB对TNFα刺激内皮细胞p47phoxmRNA和蛋白表达的影响
结果如图5,6所示,在对照组的HUVECs中,p47phoxmRNA和蛋白的表达非常低,而TNFα(200 U/mL)作用24 h后,p47phox的mRNA表达水平较对照组增加了212.8%(P=0.009),蛋白表达增加了156.2%(P=0.001);GB(50mg/L)预处理分别使TNFα诱导的p47phoxmRNA和蛋白表达下降43.6%(P=0.021)和53.0%(P=0.002)。

图5 GB对TNFα诱导HUVECs中p47phoxmRNA表达的影响
Fig 5 Effects of GB on TNFα-induced mRNA expression of p47phoxin HUVECs
0:100 bp DNA ladder; 1:control; 2:TNFα; 3:GB+TNFα
** compared with the controlP<0.01; # compared with the group treated by TNFαaloneP<0.05

图6 GB对TNFα诱导HUVECs中p47phox蛋白表达的影响
Fig 6 Effects of GB on TNFα-induced protein expression of p47phoxin HUVECs
** compared with the controlP<0.01; ## compared with the group treated by TNFα aloneP<0.01
3 讨 论
近年来大量证据表明,NADPH氧化酶途径是内皮细胞ROS的主要来源之一。内皮细胞NADPH氧化酶复合体由多个胞质和胞膜亚基组成,其中p47phox亚基非常重要,NADPH氧化酶的激活需要该亚基活化后由胞质转移到膜上。本实验观察到,TNFα作用24 h后,HUVECs中p47phoxmRNA和蛋白表达均明显增高,提示TNFα长时间作用后还存在p47phox亚基的重新合成,而转染p47phoxsiRNA可以完全抑制p47phoxmRNA和蛋白的表达以及TNFα对ROS的诱导作用,提示NADPH氧化酶途径是内皮细胞ROS的主要来源。
抗氧化药物能够降低或消除氧化应激损伤,保护血管内皮细胞的功能,对心血管疾病具有预防和治疗的潜能。早期研究显示,抗氧化药物GB是银杏叶的众多有效成分之一,它在银杏叶中含量为0.2%,可以通过抑制细胞色素P-450系统抑制ROS的生成[3],具有强大的抗氧化作用[4-6],在减轻体外培养细胞的氧化损伤、降低离体大鼠心脏的缺血再灌注损伤等过程中起重要作用[7-8]。已有很多报道表明,GB对神经系统缺血-再灌注损伤具有明显的保护作用。因此早已被用于中风等疾病的治疗。本实验结果显示,GB剂量依赖的抑制TNFα诱导的HUVECs内ROS的水平。提示GB具有抗氧化应激作用,与文献报道结果一致。进一步研究结果显示,50 mg/L 的GB明显降低TNFα诱导的p47phoxmRNA和蛋白的表达。提示GB的抗氧化应激作用主要是通过抑制内皮细胞NADPH氧化酶来源的ROS实现的。但是与文献报道[3]不同的是,我们的结果显示GB主要通过抑制NADPH氧化酶途径影响ROS的生成,而不是主要通过抑制细胞色素P-450系统。
本研究组前期研究已经证实[9-10],转染p47phox的siRNA能阻断TNFα对ERK的激活和转录因子SP-1的核转位,明显抑制NF-ΚB的核转位;明显降低TNFα诱导的HO-1蛋白的表达及胞浆游离钙水平。GB对TNFα刺激的HUVECs中ROS激活信号通路及基因表达的影响尚在进一步研究中。
[1] Silva BR, Pernomian L, Bendhack LM. Contribution of oxidative stress to endothelial dysfunction in hypertension [J]. Front Physiol, 2012,3:441.
[2] Yung LM, Leung FP, Yao X, et al. Reactive oxygen species in vascular wall [J]. Cardiovasc Hematol Disord Drug Targets,2006,6(1):1-19.
[3] Zou L, Harkey MR, Henderson GL. Effects of herbal components on cDNA-expressed cytochrome P450 enzyme catalytic activity [J]. Life Sci,2002,71(13):1579-1589.
[4] Diamond BJ, Bailey MR. Ginkgo biloba: Indications, Mechanisms, and Safety [J]. Psychiatr Clin North Am,2013,36(1):73-83.
[5] Tian X, Zhang L, Wang J, et al. The protective effect of hyperbaric oxygen and Ginkgo biloba extract on Aβ25-35-induced oxidative stress and neuronal apoptosis in rats [J]. Behav Brain Res,2013,242:1-8.
[6] Jaracz S, Stromgaard K, Nakanishi K. Ginkgolides: selective acetylations, translactonization, and biological evaluation [J]. J Org Chem,2002,67(13):4623-4626.
[7] Varga E, Bodi A, Ferdinandy P, et al. The protective effect of EGb 761 in isolated ischemic/reperfused rat hearts: a link between cardiac function and nitric oxide production [J]. J Cardiovas Pharmacol,1999,34:711-717.
[8] Sastre J, Millan A, Garcia dlA, et al. A Ginkgo biloba extract (EGb 761) prevents mitochondrial aging by protecting against oxidative stress [J]. Free Radical Biol Med,1998,24:298-304.
[9] 于晓红,刘俊,张妍,等.α-玉米赤霉醇对肿瘤坏死因子α诱导的人内皮细胞HO-1基因表达及胞浆游离钙水平的影响[J].中华医学杂志,2009,89(46):3280-3284.
[10] 于晓红,王小明,斯琴,等.α-玉米赤霉醇对肿瘤坏死因子α诱导的人内皮细胞活性氧产生及其激活信号通路的影响[J].中华医学杂志,2009,89(4):266-270.
EffectofginkgobilobaongenerationofROSandthemechanisminvolvedinthetumornecrosisfactorα-stimulatedhumanendothelialcells
YUXiao-hong1,WANGXiao-ming2,ZHUHao1,LIZhen1,LIUJun1
(1.DepartmentofCardiology,theFirstAffiliatedHospitalofDalianMedicalUniversity,Dalian116011,China; 2.DepartmentofPathophysiology,BasicMedicalAcademy,PekingUnionMedicalCollege,Beijing100005,China)
ObjectiveTo investigate the effect of ginkgo biloba (GB) on generation of ROS and the mechanism involved in the tumor necrosis factor α-stimulated human endothelial cells.MethodsCultured HUVECs were divided into normal group; TNFα stimulation group; GB pretreatment group: HUVECs were stimulated 24 h by TNFα after pretreatment 1 h by GB(25 mg/L),GB(50 mg/L),GB(100 mg/L); Plasmid transfection group: HUVECs were stimulated 24 h by TNFα after pretreatment 24 h by p47phoxsiRNA.The siRNA expression vector for p47phoxwas constructed and used to block the NADPH oxidase in the HUVECs. The intracellular ROS production was detected by using 2,7-dichlorofluorescin diacetate as probe. The mRNA and protein expression of the p47phoxwas determined by using semiquantitative RT-PCR, immunocytochemistery analysis and western blotting analysis in each group after treatment.ResultsTNFα stimulation caused ROS output increased by 155.4% of control(P=0.003); GB was able to reduced the production of ROS in a dose-dependent manner, GB(25 mg/L),GB(50 mg/L),GB(100 mg/L) made the TNFα-induced ROS output decreased 9.2%(P=0.157),35.4 %(P=0.014),48.0% (P=0.005)respectively. TNFα stimulation caused p47phoxmRNA increased by 212.8% of control(P=0.009), and also increased p47phoxprotein expression by 156.2% of control(P=0.001); Pretreatment with GB attenuated TNFα-induced p47phoxmRNA by 43.6% (P=0.021)and protein by 53.0%(P=0.002). Knock down of the p47phoxsubunit for NADPH oxidase by siRNA abolished the production of ROS.ConclusionGB has a potent inhibitory effect on the ROS production in the TNFα- stimulated endothelial cells, mainly through the inhibition of NADPH oxidase.
ginkgo biloba;TNFα;endothelial cells;reactive oxygen species
10.11724/jdmu.2013.04.04
R339
A
1671-7295(2013)04-0320-05
于晓红, 王小明, 朱皓,等.银杏内酯B对TNFα诱导的人内皮细胞活性氧产生的影响及其机制[J].大连医科大学学报,2013,35(4):320-324.
辽宁省教育厅科学研究一般项目(L2011155、L2012321)
于晓红(1970-),女,辽宁大连人,主治医师。E-mail:yuxiaohong0707@163.com
刘 俊,教授。E-mail:dalianliujun@medmail.com.cn
2013-05-07;
2013-06-18)
