NaCl胁迫对洋甘菊种子萌发与幼苗生长和生理指标及解剖结构的影响
2013-12-14邰玉玲杨秀梅余德强
邰玉玲,杨秀梅,袁 艺,江 玲,余德强,胡 芳
(安徽农业大学生命科学学院,安徽合肥230036)
洋甘菊(Matricaria chamomilla Linn.)又称母菊,为菊科(Asteraceae)母菊属(Matricaria Linn.)一年或多年生草本植物。洋甘菊体内含有挥发油,具有消炎、抑制真菌、解痉镇静、抗肿瘤及促进小鼠伤口愈合等作用[1-4],是一种极具开发及应用价值的香料植物。近年来,洋甘菊在药疗、美容及装饰等方面的应用越来越广泛。
土壤盐渍化已是一个世界性的资源与生态问题。据统计,全世界大约有3.8×108hm2土地存在不同程度盐渍化,约占全球陆地面积的三分之一。在中国,盐渍土是分布广、类型多、对农业生产影响较大的一类低产土壤,盐渍土的生物治理和综合开发是未来农业发展的重大课题[5-6]。NaCl胁迫是影响植物生长和发育、导致作物产量降低的不利因素之一,直接影响种子萌发和幼苗生长,最终使作物产量和品质下降[7]。由于洋甘菊可在多种类型土壤中生长,在低盐土壤中能较好生长、在高盐土壤中也能生长[8],因而,洋甘菊可作为谷类作物的轮作植物。Dadkhah[9]的研究结果表明:在低浓度NaCl(质量浓度0.3%NaCl)胁迫下洋甘菊的挥发油含量比对照组增加了18.2%,说明轻度NaCl胁迫有利于洋甘菊体内有效成分的积累。因此,洋甘菊作为具有经济开发价值的药用植物之一,可在低盐渍土壤中种植,对提高土地利用率有一定作用。近年来,国内外有关洋甘菊的研究主要集中在化学成分分析[10-11]、逆境条件下化学成分含量变化[12-13]、栽培和快速繁殖方法研究[14-15]及药理作用分析[16-17]等方面,有关NaCl胁迫对洋甘菊种子萌发、幼苗生长以及不同器官解剖结构的影响尚未见研究报道。
作者对不同浓度NaCl胁迫条件下洋甘菊种子萌发状况、幼苗生理和生长状况以及不同器官横切面解剖结构的变化进行了研究,以期明确洋甘菊的耐盐性,为洋甘菊的进一步开发利用及其在盐渍土上的推广种植提供实验依据。
1 材料和方法
1.1 材料
供试洋甘菊种子由安徽宣城跃平生态有限公司提供,挑选颗粒饱满、大小一致的种子(含水量约8%,千粒质量0.167 g)备用。
1.2 方法
1.2.1 NaCl胁迫处理方法 用蒸馏水分别配制质量浓度0.2%、0.4%、0.6%、0.8%、1.0%、1.2% 和1.4%NaCl溶液,对照为蒸馏水(0.0%NaCl)。随机取100粒种子,均匀排列在垫有2层定性滤纸的培养皿(直径9 cm)中,分别滴加相应浓度的NaCl溶液至滤纸完全湿润,每处理3次重复;置于温度约23℃的光照培养箱中培养,每天光照12 h;培养期间每天补充无菌水至滤纸完全湿润以保持NaCl浓度恒定。定时观察种子萌发情况及幼苗生长状况。
将洋甘菊种子包裹在无菌纱布中,用质量浓度0.1%HgCl2溶液浸泡消毒5 min,无菌水清洗3次后用于播种。以过筛并消毒的细沙为盆栽基质,每一栽培盆中装1.0 kg细沙,每盆播种10粒洋甘菊种子,其上覆1层基质,置于温室中培养萌发;待种子萌发后,每天用1/2 Hoagland营养液(用蒸馏水配制)浇灌;2周后,每盆保留4株长势一致的幼苗,分别用含质量浓度 0.0%(对照)、0.2%、0.4%、0.6%、0.8%、1.0%和1.2%NaCl的1/2 Hoagland营养液浇灌,每处理3盆。以细沙湿润为标准,根据耗水量定期补充1/2 Hoagland营养液以保持盆栽基质中含水量的相对稳定;每次补充水分的同时用1/2 Hoagland营养液冲洗底部接水盘并浇入盆栽基质中,以保持盆栽基质中NaCl质量浓度的相对稳定。NaCl胁迫处理持续4个月后取样测定洋甘菊植株的生理指标。然后保留质量浓度0.6%NaCl处理组继续进行NaCl胁迫处理至12个月,取不同器官制作石蜡切片,用于不同器官横切面解剖结构观察。
1.2.2 种子萌发及幼苗生长指标测定 以胚根长度为种子长度的1/2作为发芽标准,每天早上8:00观察记录发芽种子数,计算相对萌发率;在发芽第4天计算种子发芽势,第7天计算种子萌发率以及相对盐害率。
在处理的第7天,每一处理组随机取10株幼苗,用直尺测量根长和株高。同时,每一处理组随机取10株幼苗,用纯净水清洗干净,吸干表面水分后用AR124CN型电子天平(上海奥豪斯仪器有限公司,精度0.000 1 g)称取单株鲜质量;然后置于105℃杀青10 min,并于80℃烘箱中干燥至恒质量,称取单株干质量[18],结果取平均值。
1.2.3 生理指标测定 每一处理随机混合采集洋甘菊植株同一高度的叶片,先用自来水冲洗再用蒸馏水清洗,吸干表面水分后分别称取0.5 g,用于各项生理指标测定。采用酸性茚三酮比色法[19]测定脯氨酸含量;采用蒽酮比色法[20]195-197测定可溶性糖含量;参照文献[20]134-137的方法测定叶绿素a、叶绿素b和总叶绿素含量;采用愈创木酚法[21]测定过氧化物酶(POD)活性。
1.2.4 不同器官横切面解剖结构观察 用质量浓度0.6%NaCl连续胁迫处理12个月后,分别采集对照组和处理组洋甘菊植株同一生长时期的根、茎和叶片,参照文献[22]的方法制作石蜡切片,切片厚度10 μm,番红-固绿染色,树胶封片。采用数码互动系统显微镜(Olympus VANOX万能研究显微镜)观察并拍摄记录。
1.3 数据计算及统计分析
按照下列公式分别计算种子发芽势、相对萌发率和相对盐害率:发芽势=(4天内正常发芽的种子数/供试种子总数)×100%;相对萌发率=(处理组种子萌发率/对照组种子萌发率)×100%;相对盐害率=〔(对照组种子萌发率-处理组种子萌发率)/对照组种子萌发率〕×100%。
采用DPS v7.05软件进行统计分析,用单因素方差分析方法进行差异显著性检验。
2 结果和分析
2.1 NaCl胁迫对洋甘菊种子萌发的影响
在不同质量浓度NaCl胁迫条件下洋甘菊种子的相对萌发率见表1;其发芽势、萌发率及相对盐害率见表2。
由表1可知:随NaCl质量浓度的提高,洋甘菊种子的相对萌发率均逐渐降低;与对照相比,经不同质量浓度NaCl胁迫处理3~7 d洋甘菊种子的相对萌发率均低于对照,差异均达到极显著水平(P<0.01)。随萌发时间的延长,各处理组洋甘菊种子的相对萌发率总体呈逐渐增加的趋势。在质量浓度1.4%NaCl胁迫条件下,洋甘菊种子不能正常萌发,表明高浓度NaCl胁迫对洋甘菊种子萌发有明显抑制作用。
由表2可见:经NaCl胁迫处理后,随NaCl质量浓度提高,洋甘菊种子的发芽势和萌发率均逐渐降低,而相对盐害率逐渐增大,其中各处理组的种子发芽势和萌发率均显著(P<0.05)或极显著(P<0.01)低于对照,而各处理组的相对盐害率均高于对照,且除0.2%NaCl处理组外,其他处理组的相对盐害率均与对照有极显著差异(P<0.01)。表明中、高浓度NaCl胁迫对洋甘菊种子萌发均有明显抑制作用。
2.2 NaCl胁迫对洋甘菊幼苗生长的影响
2.2.1 对幼苗生长指标的影响 在不同质量浓度NaCl胁迫条件下洋甘菊幼苗根长、株高及单株鲜质量和干质量的变化见表3。
表1 NaCl胁迫条件下洋甘菊种子相对萌发率的变化(±SD)1)Table 1 Change of relative germination rate of Matricaria chamomilla Linn.seeds under NaCl stress(±SD)1)
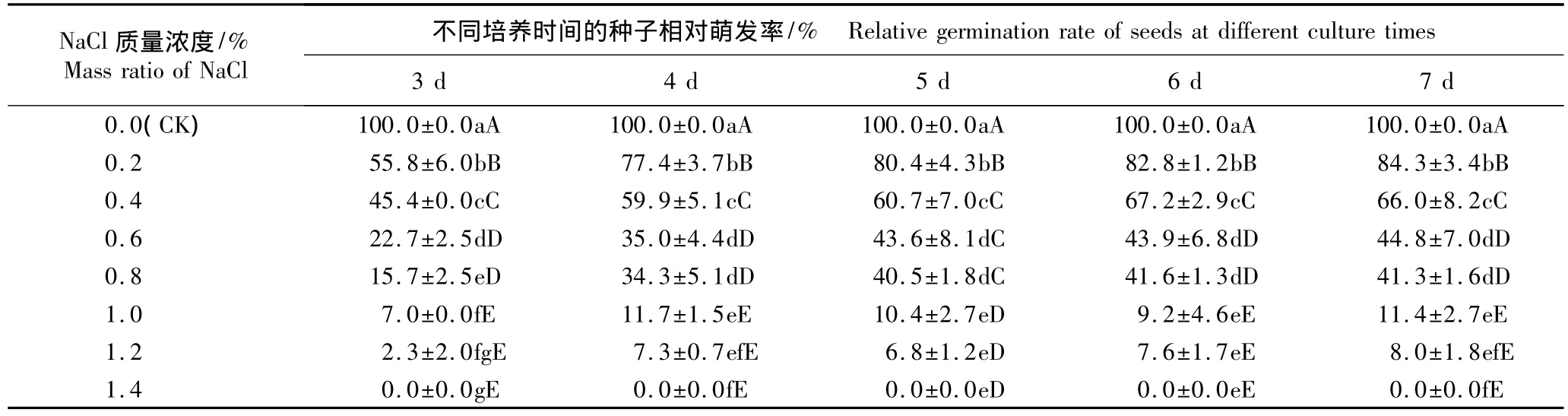
表1 NaCl胁迫条件下洋甘菊种子相对萌发率的变化(±SD)1)Table 1 Change of relative germination rate of Matricaria chamomilla Linn.seeds under NaCl stress(±SD)1)
1)同列中不同的大写和小写字母分别表示差异极显著(P<0.01)和显著(P<0.05)Different capitals and small letters in the same column indicate the extremely significant difference(P<0.01)and the significant difference(P<0.05),respectively.
?
表2 NaCl胁迫条件下洋甘菊种子萌发指标及相对盐害率的比较(±SD)1)Table 2 Comparison of seed germination indexes and relative salt injury rate of Matricaria chamomilla Linn.under NaCl stress(±SD)1)
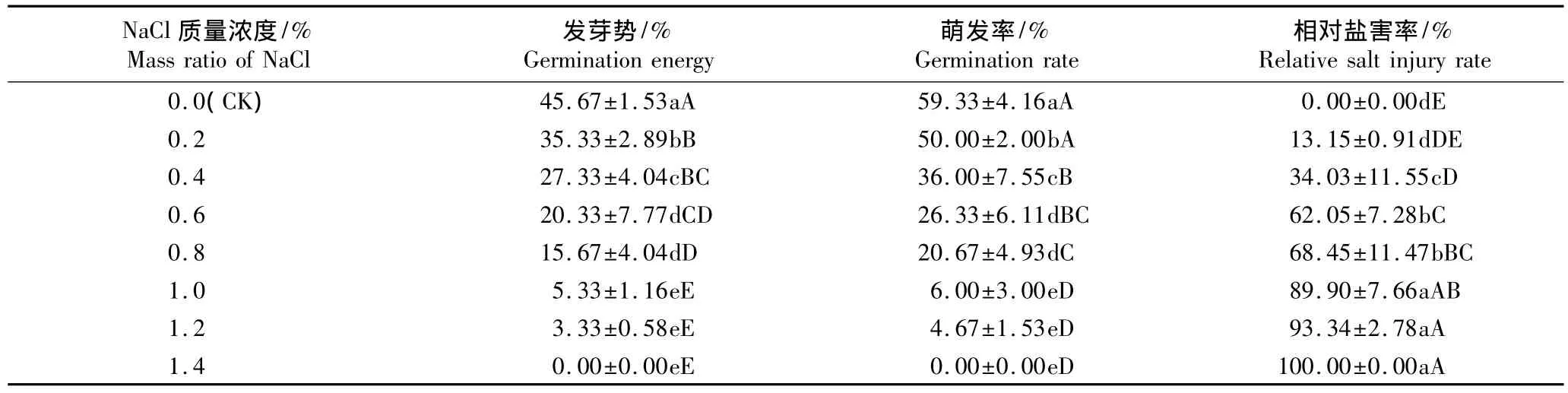
表2 NaCl胁迫条件下洋甘菊种子萌发指标及相对盐害率的比较(±SD)1)Table 2 Comparison of seed germination indexes and relative salt injury rate of Matricaria chamomilla Linn.under NaCl stress(±SD)1)
1)同列中不同的大写和小写字母分别表示差异极显著(P<0.01)和显著(P<0.05)Different capitals and small letters in the same column indicate the extremely significant difference(P<0.01)and the significant difference(P<0.05),respectively.
?
表3 NaCl胁迫对洋甘菊幼苗生长的影响(±SD)1)Table 3 Effect of NaCl stress on seedling growth of Matricaria chamomilla Linn.(±SD)1)
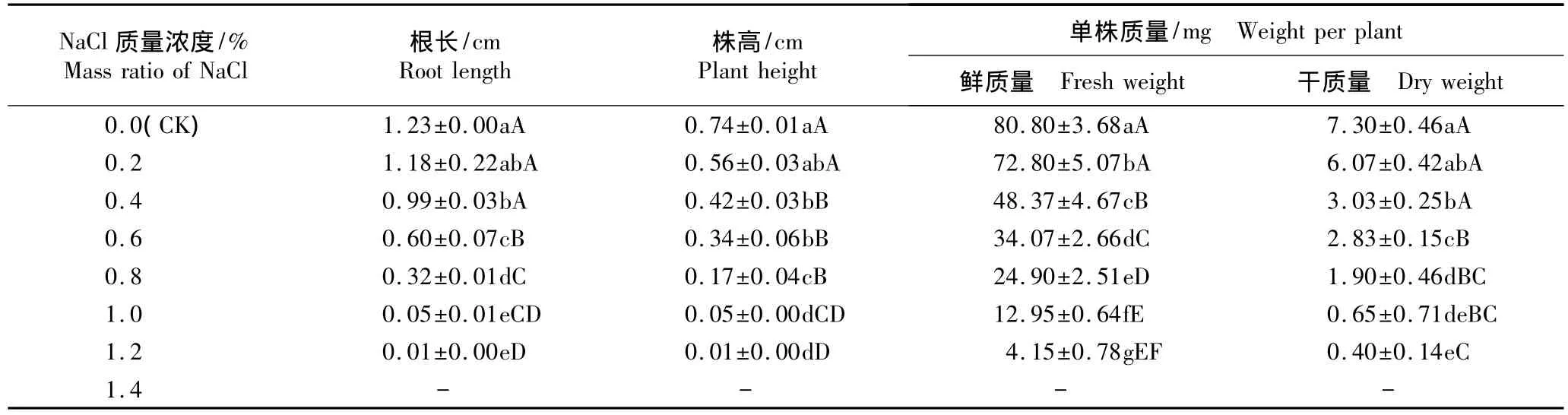
表3 NaCl胁迫对洋甘菊幼苗生长的影响(±SD)1)Table 3 Effect of NaCl stress on seedling growth of Matricaria chamomilla Linn.(±SD)1)
1)同列中不同的大写和小写字母分别表示差异极显著(P<0.01)和显著(P<0.05)Different capitals and small letters in the same column indicate the extremely significant difference(P<0.01)and the significant difference(P<0.05),respectively.-:因种子未萌发,无测定数据 Without determination datum because of seed ungerminated.
?
由表3可见:在NaCl胁迫条件下洋甘菊幼苗的根长、株高以及单株鲜质量和干质量均低于对照,其差异达到显著(P<0.05)或极显著(P<0.01)水平。随NaCl质量浓度的提高,洋甘菊幼苗的根长、株高及单株鲜质量和干质量均呈逐渐下降的趋势,在1.2%NaCl胁迫条件下各项指标均最低;但相比较而言,根长的降幅大于株高、鲜质量的降幅大于干质量,说明NaCl胁迫对洋甘菊根长的影响大于对株高的影响,对单株鲜质量的影响大于对单株干质量的影响。造成这一现象的原因与本实验采用的水培方法有关,也与NaCl处理液直接作用于根系有关。
需要说明的是,由于在质量浓度1.4%NaCl胁迫条件下种子未能正常萌发,因而未能获得该胁迫条件下幼苗各项生长指标数据。
2.2.2 对幼苗形态的影响 经不同质量浓度NaCl胁迫处理后洋甘菊幼苗的形态变化见图1。随NaCl质量浓度的提高,洋甘菊幼苗表现出株高矮小且植株干硬、叶片变小且叶片肉质化程度增大等现象,这些变化是洋甘菊在NaCl胁迫条件下维持正常生长发育所表现出的适应性特征。叶片肉质化程度的增大在一定程度上可提高单位叶面积的光合效率,而叶片变小可以减少蒸腾面积防止水分过度散失。
2.3 NaCl胁迫对洋甘菊叶片部分生理指标的影响
在不同质量浓度NaCl胁迫条件下洋甘菊幼苗叶片叶绿素、可溶性糖和脯氨酸含量及POD活性的变化见表4。
由表4可知:除质量浓度1.2%NaCl处理组叶片叶绿素a、叶绿素b和总叶绿素含量显著(P<0.05)或极显著(P<0.01)低于对照外,在NaCl胁迫条件下洋甘菊叶片的叶绿素(包括叶绿素a、叶绿素b和总叶绿素)含量、可溶性糖含量、脯氨酸含量及POD活性均高于对照,其差异达到显著(P<0.05)或极显著(P<0.01)水平。

图1 经不同质量浓度NaCl处理4个月后洋甘菊幼苗的形态变化Fig.1 Morphological change of Matricaria chamomilla Linn.seedlings treated by NaCl with different mass ratios for four months
表4 NaCl胁迫对洋甘菊幼苗叶片叶绿素、可溶性糖和脯氨酸含量及POD活性的影响(±SD)1)Table 4 Effects of NaCl stress on contents of chlorophyll,soluble sugar and proline and POD activity in leaf of Matricaria chamomilla Linn.seedlings(±SD)1)

表4 NaCl胁迫对洋甘菊幼苗叶片叶绿素、可溶性糖和脯氨酸含量及POD活性的影响(±SD)1)Table 4 Effects of NaCl stress on contents of chlorophyll,soluble sugar and proline and POD activity in leaf of Matricaria chamomilla Linn.seedlings(±SD)1)
1)同列中不同的大写和小写字母分别表示差异极显著(P<0.01)和显著(P<0.05)Different capitals and small letters in the same column indicate the extremely significant difference(P<0.01)and the significant difference(P<0.05),respectively.
?
总体上看,随NaCl质量浓度提高,洋甘菊幼苗叶绿素含量呈先升高后下降趋势,而可溶性糖含量、脯氨酸含量以及POD活性总体上呈逐渐增加的趋势;其中,在质量浓度1.2%NaCl胁迫条件下,叶绿素a、叶绿素b及总叶绿素含量均最低,可溶性糖含量、脯氨酸含量及POD活性均最高。说明高浓度NaCl胁迫对洋甘菊幼苗叶片叶绿素合成有较大影响。
2.4 NaCl胁迫对洋甘菊不同器官横切面解剖结构的影响
经质量浓度0.6%NaCl胁迫处理12个月后洋甘菊茎、根和叶片横切面解剖结构的变化见图2。
观察结果显示:洋甘菊茎横切面的解剖结构可分为表皮、皮层和维管柱3部分,维管柱中包含维管束、髓和髓射线;与对照(图2-1)相比较,经NaCl胁迫处理后洋甘菊茎皮层内厚角组织增多、薄壁组织中气隙数量增加且维管束内导管更加发达(图2-2)。洋甘菊根横切面的解剖结构可分为表皮、皮层和维管柱3部分,维管柱为多元型;与对照(图2-3)相比较,经NaCl胁迫处理后洋甘菊根皮层内气隙数量增多、维管柱内导管较为发达(图2-4)。洋甘菊叶轴的横切面解剖结构可分为表皮、叶脉和薄壁组织;与对照(图2-5)相比较,经NaCl胁迫处理后洋甘菊叶轴薄壁组织中气隙数量增加(图2-6)。洋甘菊叶片横切面的解剖结构可分为表皮、叶肉和叶脉3部分;与对照(图2-7)相比较,经NaCl胁迫处理后洋甘菊叶片表皮细胞皱缩、栅栏组织层数明显增多(图2-8)。
总体上看,经质量浓度0.6%NaCl胁迫处理后洋甘菊根、茎和叶轴中气隙数量增多,形成的通气组织有利于洋甘菊进行呼吸作用;茎及根中导管数量的增多有利于洋甘菊体内水分及矿质元素的运输;而叶片中栅栏组织增多有利于其光合作用的增强。这些器官解剖结构的变化都是洋甘菊对NaCl胁迫环境的一种适应性变化。
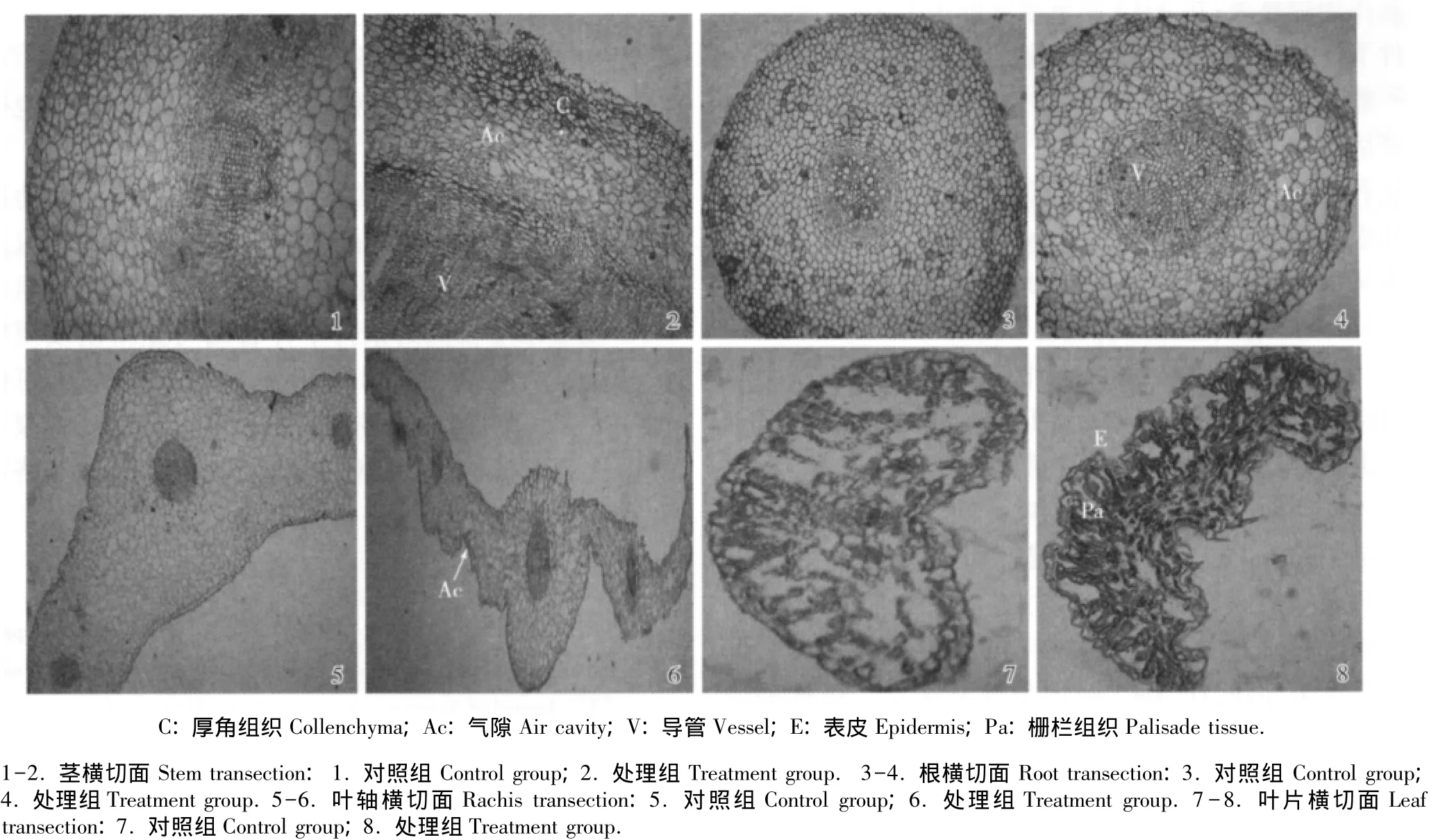
图2 经质量浓度0.6%NaCl处理12个月后洋甘菊不同器官横切面解剖结构变化Fig.2 Change of transection anatomical structure of different organs of Matricaria chamomilla Linn.treated by mass ratio 0.6%NaCl for twelve months
3 讨 论
在逆境胁迫条件下植物体内会发生一系列的生理生化变化,以提高植株对逆境胁迫的抵抗能力。植物对NaCl胁迫的适应性反应是一个非常复杂的生理生态学过程,其不同器官解剖结构的变化与其生理生态特征的变化紧密相关,是植物对逆境胁迫的综合反应。
盐渍土是指表土层含0.1% ~2%可溶性盐的一类土壤[23-24]。本研究结果表明:随NaCl质量浓度的提高,洋甘菊种子的萌发率及幼苗的根长和株高以及单株干质量和鲜质量均呈明显的下降趋势,但质量浓度较低的NaCl胁迫对洋甘菊种子发芽的抑制作用较小,这一研究结果与沈禹颖等[25]的研究结论基本一致;质量浓度大于0.4%的NaCl胁迫对洋甘菊种子萌发的抑制作用较为明显,且质量浓度大于0.6%的NaCl胁迫对其幼苗根长生长的抑制作用较显著,质量浓度大于0.8%的NaCl胁迫对其幼苗株高生长的抑制作用较显著;在NaCl质量浓度低于1.4%的胁迫条件下洋甘菊种子均有发芽能力。表明洋甘菊可以在一般的盐土中萌发生长,可作为提高盐渍土利用率的经济作物之一。在NaCl胁迫条件下洋甘菊幼苗的根长和株高及单株干质量和鲜质量均随NaCl质量浓度的提高而降低,可能是由于NaCl胁迫一方面导致植物从土壤中摄取的无机物减少,另一方面限制了植株生长,因此造成植株生物量的下降。
在NaCl胁迫条件下,洋甘菊体内活性氧产生与清除的动态平衡被破坏,而POD活性的增加可以清除由于NaCl胁迫产生的过量活性氧。在本研究中,在NaCl胁迫条件下,洋甘菊叶片可溶性糖和脯氨酸含量均随NaCl质量浓度的提高而逐渐增加,可溶性糖和脯氨酸具有调节细胞渗透势、保护蛋白质分子、增加蛋白质分子的水合度、维持光合活性和清除活性氧等作用,因此在NaCl胁迫条件下这2个指标的增加有利于洋甘菊抵御NaCl胁迫的伤害,这与张海燕等[26]的研究结果基本一致。
在一系列抗性生理指标中,叶绿素含量是较为敏感的指标之一。本研究中,在NaCl质量浓度小于0.6%的条件下洋甘菊叶片的叶绿素含量随NaCl质量浓度的提高而增加,而在NaCl质量浓度0.6% ~1.2%的条件下其叶绿素含量随NaCl质量浓度的提高而降低,金美芳等[7]的研究也得出了类似的结果。其原因可能是由于在NaCl质量浓度较低的条件下洋甘菊叶片细胞脱水间接导致单位面积内叶绿素含量的增加,而在NaCl质量浓度较高的条件下洋甘菊根系受损且无法吸收足够的水分和矿质营养,致使叶绿素合成受阻,直接导致叶绿素含量降低;也可能是由于NaCl胁迫使洋甘菊体内蛋白质合成受到破坏,叶绿素与蛋白质间的结合趋于松弛,干扰了植物光合作用的正常进行[27]。
通过本研究,作者认为叶绿素、可溶性糖和脯氨酸含量以及POD活性的变化可作为洋甘菊耐盐性评价的重要参考指标,对于洋甘菊耐盐种质资源的筛选有一定的参考作用。
此外,长期处于NaCl胁迫条件下洋甘菊植株表现出一些适应盐生环境的结构。石蜡切片观察结果表明:经质量浓度0.6%NaCl胁迫处理12个月后洋甘菊叶片栅栏组织层数明显增多,叶片的这种结构变化可增加光合作用面积,是对NaCl胁迫环境的一种适应性变化;经NaCl胁迫后洋甘菊根和茎的皮层内气隙增多,这些气隙与叶的气孔连接形成通气组织通道,使植株在盐渍环境条件下能获得足够的氧气[28],以保障植株生理活动的正常进行。陆静梅等[29]也得出了类似的研究结果。
由以上分析可见:虽然不同质量浓度NaCl胁迫对洋甘菊种子的萌发及幼苗的生长和生理指标以及不同器官横切面的解剖结构均有一定的影响,但在NaCl质量浓度较低的条件下洋甘菊可正常萌发及生长,因此,洋甘菊对NaCl胁迫具有一定的耐性,可作为一种具有耐盐性的经济作物进行推广种植,不仅有利于盐渍土壤的改良和利用,还可获得一定的经济和社会效益。
[1]LEE S H,HEO Y,KIM Y C.Effect of German chamomile oil application on alleviating atopic dermatitis-like immune alterations in mice[J].Journal of Veterinary Science,2010,11(1):35-41.
[2]OGATA I,KAWANAI T,HASHIMOTO E,et al.Bisabololoxide A,one of the main constituents in German chamomile extract,induces apoptosis in rat thymocytes[J].Archives of Toxicology,2010,84(1):45-52.
[3]NAYAK B S,RAJU S S,RAO A V.Wound healing activity of Matricaria recutita L.extract[J].Journal of Wound Care,2007,16(7):298-302.
[4]袁 艺,龙子江,杨俊杰,等.洋甘菊挥发油抗炎作用的研究[J].药物生物技术,2011,18(1):052-055.
[5]阎秀峰,孙国荣,李 晶,等.碱性盐胁迫下星星草幼苗中几种渗透调节物质的变化[J].植物研究,1999,19(3):347-353.
[6]谢德意,王惠萍,王付欣,等.盐胁迫对棉花种子萌发及幼苗生长的影响[J].种子,2000,19(3):10-11,13.
[7]金美芳,朱晓清.NaCl胁迫对油菜种子萌发和幼苗生长的影响[J].种子,2009,28(9):76-79.
[8]徐 勇.西洋甘菊挥发性成分及抗过敏、抗炎研究[D].上海:上海交通大学生命科学与技术学院,2007:10.
[9]DADKHAH A R.Effect of salt stress on growth and essential oil of Matricaria chamomilla[J].Research Journal of Biological Sciences,2010,5(10):643-646.
[10]SZABÓ K,NÉMETH É,SÁROSI S,et al.Essential oil content of Hungarian wild chamomile(Chamomilla recutita L.)and its composition during primary processing-survey of practice[J].Zeitschrift für Arznei-& Gewürzpflanzen,2010,15(2):63-68.
[11]KRÜGER H.Characterisation of chamomile volatiles by simultaneous distillation solid-phase extraction in comparison to hydrodistillation and simultaneous distillation extraction[J].Planta Medica,2010,76(8):843-846.
[12]BAGHALIANA K,HAGHIRYB A,NAGHAVI M R,et al.Effect of saline irrigation wateron agronomicaland phytochemical characters of chamomile(Matricaria recutita L.)[J]. Scientia Horticulturae,2008,116(4):437-441.
[13]KARAMI A,KHUSH-KHUI M,SAHARKHIZ M J,et al.Essential oil content and compositions of German chamomile(Chamomilla recutita L.Rauschert)cultivated in temperate and subtropical zones of Iran[J].Journal of Essential Oil Bearing Plants,2009,12(6):703-707.
[14]石建红,赵士春,池美娜.母菊播种方式初探[J].农业科技通讯,2006(10):54.
[15]沙 红,廖 康.药用植物洋甘菊的组织培养研究[J].新疆农业大学学报,2004,27(4):16-18.
[16]SAFAYHI H,SABIERAJ J,SAILER E R,et al.Chamazulene:an antioxidant-type inhibitor of leukotriene B4 formation[J].Planta Medica,1994,60(5):410-413.
[17]REKKA E A,KOUROUNAKIS A P,KOUROUNAKIS P N.Investigation of the effect of chamazulene on lipid peroxidation and free radical processes[J].Research Communications in Molecular Pathology and Pharmacology,1996,92(3):361-364.
[18]杨 姝,杜桂娟.盐胁迫下沙打旺种子的萌发特性[J].现代畜牧兽医,2011(1):50-51.
[19]邹 琦.植物生理学实验指导[M].北京:中国农业出版社,2000:161-162.
[20]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[21]陈建勋,王晓峰.植物生理学实验指导[M].2版.广州:华南理工大学出版社,2006:68-77.
[22]滕红梅,苏仙绒,崔东亚.运城盐湖4种藜科盐生植物叶的比较解剖研究[J].武汉植物研究,2009,27(3):250-255.
[23]张 葛.GLS改碱剂对盐碱土的改良作用[D].长春:吉林农业大学资源与环境学院,2008:2.
[24]张凤娟.河北省海岸带盐生植物资源及其耐盐结构的研究[D].长春:东北师范大学生命科学学院,2002:13-16.
[25]沈禹颖,王锁民,陈亚明.盐胁迫对牧草种子萌发及其恢复的影响[J].草业学报,1999,8(3):54-60.
[26]张海燕,赵可夫.盐分和水分胁迫对盐地碱蓬幼苗渗透调节效应的研究[J].植物学报,1998,40(1):56-61.
[27]郇树乾,刘国道,张绪元,等.NaCl胁迫对刚果臂形草种子萌发及幼苗生理效应的研究[J].中国草地,2004,26(6):45-49.
[28]韦存虚,张 军,王建军,等.星星草营养器官适应盐胁迫的结构特征[J].植物资源与环境学报,2006,15(1):51-56.
[29]陆静梅,李建东,景德章,等.Aneurolepidium chinense(Trin.)Kitag.抗逆性解剖研究[J].东北师大学报:自然科学版,1993(4):77-80.
