黄连素通过S1P2-MAPK信号通路抗糖尿病肾纤维化作用机制研究
2013-12-14刘慰华刘世明林双峰黄河清
刘慰华,刘世明,林双峰,黄河清
(1.广州医学院第二附属医院广州心血管疾病研究所,广东广州 510260;2.广州中医药大学第一附属医院,广东 广州 510405;3.中山大学药学院药理毒理实验室,广东广州 510006)
黄连素(berberine,[C20H18NO4]+)存在于小檗属植物黄连(Coptidis Rhizoma,CR)、黄柏(Cortex Phellodendri)中,属于异喹啉类生物碱。研究表明黄连素通过降低血糖、调节脂质代谢、减轻氧化应激,改善胰岛素抵抗和胰岛细胞保护等多方面发挥抗糖尿病的作用[1-2],我们以往研究显示黄连素通过Akt信号通路增加糖尿病小鼠肝糖原合成从而降低血糖[3],还发现黄连素从抑制多元醇通路,减少氧化应激,抑制NF-κB信号通路等方面发挥改善糖尿病肾功能损伤的作用[4-7]。研究证据充分显示出黄连素多靶点,作用广泛,机制复杂的药理学特点。
S1P2受体是1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)2型高亲和力受体,介导S1P诱导的细胞增殖、存活、细胞迁移,MAPK、Rho 激活等[8-9]。近年的研究主要从免疫调节、炎症、血管生成等方面阐述S1P受体在糖尿病并发症中的作用,然而S1P受体尤其是S1P2受体的作用及其机制目前仍未完全阐明。我们既往研究表明:糖尿病肾组织及肾小球系膜细胞鞘氨醇激酶1(sphingosine kinase 1,SphK1)-S1P信号通路激活、优势表达的S1P2受体参与细胞外基质包括纤维连接蛋白(fibronectin,FN)等生成增加过程,提示SphK1/S1P/S1P2通路在糖尿病肾病(diabetic nephropathy,DN)病理进程中发挥重要调节作用[10-11]。近期研究发现黄连素改善糖尿病小鼠肾脏肥大,减少细胞外基质生成如TGF-β1、FN和胶原IV的作用与其减少SphK1表达及活性,减少S1P生成相关,提示SphK1-S1P通路可能是黄连素抗糖尿病肾纤维化另一个新颖的作用机制[12]。在此基础上,黄连素是否影响S1P2受体的变化,从受体环节发挥抑制糖尿病肾脏细胞外基质积聚的作用需要进一步研究。
本研究主要观察黄连素干预后四氧嘧啶诱导的糖尿病小鼠肾组织、高糖培养的系膜细胞中S1P2受体mRNA和蛋白水平的表达变化情况,以及对高糖条件下S1P2受体介导的FN生成和MAPK信号通路的影响。
1 材料与方法
1.1 动物实验 动物实验参照中国动物福利法案,经中山大学实验动物伦理委员会批准后进行。健康♂ C57BL/6小鼠,SPF级,40只,体质量为(20±5)g,购自广东省医学实验动物中心,实验动物质量合格证明号:0055294,生产许可证号:SCXK(粤)2008-0002。动物实验在中山大学实验动物中心动物实验部屏障环境实验室进行,小鼠禁食6 h后,给予单次腹腔注射200 mg·kg-1四氧嘧啶 (Alloxan)制作糖尿病小鼠模型。注射72 h后测禁食6 h血糖,小鼠血糖值≥11.1 mmol·L-1确定为糖尿病小鼠。随机分为4组:正常、糖尿病、黄连素低剂量(0.15 g·kg-1)和高剂量(0.3 g·kg-1)组,每天灌胃给药,共观察12周,实验期间小鼠自由进食、饮水,不使用胰岛素等降糖药物。每周定期称量记录各组动物体重变化。实验结束前1 d,用代谢笼收集24 h尿液,用磺基水杨酸-硫酸钠比浊法检测24 h尿蛋白(urine protein for 24 hours,UP 24 h)。实验结束时大鼠禁食6 h后称重,麻醉取血,分离血清,用于检测血糖、血尿素氮(BUN)、血肌酐(Scr)。肾脏剥离并称量后-80℃保存,用于Real-time PCR和Western blot等检测。
1.2 细胞实验 常规原代培养肾小球系膜细胞于含10%胎牛血清(Gibco,USA)的DMEM培养基中,37℃,5%CO2,每2~3 d用含0.25%的胰酶消化传代,取3~15代细胞用于后续实验。细胞无血清同步化处理后进行分组干预实验。分为6组:①正常糖组 (NG,5.5 mmol·L-1glucose);② 高糖组(HG,22 mmol·L-1glucose);③ HG+S1P(1 μmol·L-1);④ HG+S1P+siRNA;⑤ HG+S1P+berberine(30 μmol·L-1);⑥ HG+S1P+siRNA+berberine,处理24 h后,提取蛋白用于Western blot检测。
1.3 Real-time PCR 用TRIzolTM试剂 (Invitrogen,USA)抽提肾组织总RNA,应用相应试剂盒[TaKaRa(大连)有限公司]进行逆转录和PCR反应。小鼠S1P2受体引物序列为:Forward:5'-GCTCTACGGCAGTGACAAAAGC-3';Reverse:5'-GAGAGGCAGCACGGTGGAGCAG-3'。
1.4 小分子 RNA干扰(small interfering RNA,siRNA) S1P2受体特异性的小分子干扰RNA(siRNA)序列购自广州市锐博生物科技有限公司。S1P2-siRNA序列为:sense:5'-CAGGAACACUACAAUUACADTDT-3',antisense:5'-UGUAAUUG UAG UGUUCCUGDTDT-3'。按照产品说明书采用 Lipofectamine 2000(Invitrogen,USA)瞬时转染系膜细胞24 h后收集细胞。
1.5 Western blot 用于检测 S1P2,FN,磷酸化MAPK等的蛋白表达。肾皮质或细胞经裂解液处理后收集蛋白用 BCA法(BCATMProtein Assay Kit,Pierce,USA)进行蛋白定量。10%SDS-PAGE电泳、电转、封闭后4℃孵育一抗过夜,所用一抗如下:S1P2(1 ∶500,Cayman Chemical Company,USA),FN(1 ∶1 000,Santa Cruz Biotechnology,USA),MAPK(ERK1/2,p38MAPK,JNK,1 ∶1 000,Sigma,USA),tubulin(1∶1 000,Sigma,USA)。分别用相应的辣根过氧化物酶标记的二抗(anti-rabbit IgG或anti-mouse IgG,1 ∶10 000,Cell Signaling Technology,USA)室温孵育1 h。加增强型化学发光液ECL液(Pierce,USA),X线片曝光,显影,定影。利用图像分析系统(UVP's Gel Documentation System GDS8000和Gel works LABWORK 4.0 Analysis Software)扫描确定X线片目的条带的光密度值。
1.6 统计学分析 实验数据用SPSS 11.5统计软件分析,多组比较用方差分析(单因素方差分析、LSD法),组间比较、组内比较用t检验,结果用±s表示。
Tab 1Biochemical characteristics of alloxan-induced diabetic mice treated with berberine(±s)

Tab 1Biochemical characteristics of alloxan-induced diabetic mice treated with berberine(±s)
KW/BW:kidney weight/body weight,BUN:blood urea nitrogen,Cr:creatinine,UP 24h:urine protein for 24 hours,*P<0.05 vs normal,#P<0.05 vs diabetes
Items Normal(n=10)Diabetes(n=6)Diabetes+Berberine(0.15 g·kg-1,n=7)Diabetes+Berberine(0.3 g·kg-1,n=10)Blood glucose/mmol·L -1 5.00 ±0.69 28.25 ±4.51* 22.67 ±4.59* 19.26 ±3.64*#Bodyweight/g 24.20 ±0.51 17.83 ±0.79* 18.29 ±0.87* 18.80 ±0.44*Kidneyweight/g 0.33 ±0.01 0.30 ±0.02 0.31 ±0.02 0.29 ±0.02 KW/BW/% 1.36 ±0.05 1.72 ±0.13* 1.73 ±0.12* 1.56 ±0.08 BUN/mmol·L -1 14.26 ±0.98 20.87 ±1.04* 13.51 ±1.46# 13.32 ±2.03#Cr/μmol·L -1 8.33 ±1.55 13.00 ±1.69* 11.50 ±0.76 8.14 ±1.08#UP24 h/μg·d-1 13.26 ±0.12 36.48 ±1.56* 30.72 ±1.61 21.57 ±1.14#
2 结果
2.1 黄连素作用下四氧嘧啶诱导的糖尿病小鼠生化指标的变化 与正常小鼠相比较,糖尿病小鼠空腹血糖明显升高,体重降低,第12周时肾重/体重比增加,血尿素氮、血肌酐和24 h尿蛋白明显增加(P<0.05)。黄连素明显抑制糖尿病小鼠血糖升高,改善血尿素氮、血肌酐,24 h尿蛋白等肾功能相关指标(P<0.05,Tab 1)。

Fig 1 Effectof berberine on the renal S1P2 receptor mRNA level in alloxan-induced diabetic mice(±s)
2.2 黄连素对糖尿病小鼠肾组织S1P2受体表达的影响 糖尿病小鼠肾组织S1P2受体mRNA水平与正常小鼠相比增加约3倍(P<0.05)。黄连素干预后,S1P2受体mRNA表达降低约75%,几乎接近正常水平(P<0.05,Fig 1)。与S1P2受体mRNA表达变化相一致,糖尿病小鼠肾组织S1P2受体蛋白水平较正常组增加约2.5倍(P<0.05)。黄连素明显减少S1P2受体蛋白表达,与模型组相比降低约60%(P<0.05,Fig 2)。
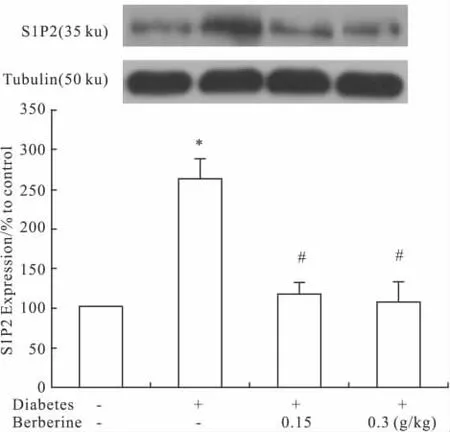
Fig 2 Effect of berberine on the renal S1P2 receptor protein level in alloxan-induced diabetic mice(±s)
2.3 黄连素对高糖培养系膜细胞S1P2受体介导的FN表达的影响 我们既往研究表明黄连素可以降低糖尿病小鼠肾脏和高糖培养的系膜细胞FN表达[3,12]。黄连素下调FN表达的作用是否与其影响S1P2受体表达相关,我们引入了S1P2-siRNA作为阳性对照,观察黄连素对高糖下S1P-S1P2受体介导的FN表达的影响。高糖环境下S1P2受体和FN表达明显增加(P<0.05),外源性S1P明显上调FN表达(P<0.05)。S1P2-siRNA明显抑制S1P诱导的FN表达(P<0.05)。与S1P2-siRNA结果相似,黄连素也明显降低了高糖环境下S1P2受体和FN表达水平(P<0.05)。S1P2-siRNA预处理后再给予黄连素,发现S1P2受体和FN表达抑制作用更加明显,几乎完全取消S1P诱导的FN表达的作用(P<0.05,Fig 3A、B)。

Fig 3 Effect of berberine on fibronectin expression induced by S1P-S1P2 axis in mesangial cells under hyperglycemic condition(±s)
2.4 黄连素对高糖培养系膜细胞S1P2受体介导的MAPK信号通路的影响 我们以往研究发现黄连素抑制p38MAPK信号通路激活从而减少FN生成[13],那么黄连素是否通过 S1P2受体发挥调节MAPK信号通路的作用,本研究显示高糖环境下,p-ERK1/2、p-p38MAPK和p-JNK磷酸化水平明显增加(P<0.05 Fig 4A、B)。外源性 S1P刺激下 p-ERK1/2,p-p38MAPK和p-JNK磷酸化程度进一步增强(P<0.05)。S1P2-siRNA干预后S1P诱导的ERK1/2和p38MAPK磷酸化增加的作用被抑制,p-ERK1/2、p-p38MAPK蛋白水平明显降低(P<0.05)。给予黄连素干预,S1P诱导的p-ERK1/2,pp38MAPK和p-JNK磷酸化水平均明显下降(P<0.05)。S1P2-siRNA预处理再给予黄连素后发现,与单独S1P2-siRNA相比,p-ERK1/2,p-JNK表达水平进一步降低,p-p38MAPK表达则无明显改变。总的ERK1/2、p38MAPK和JNK蛋白表达没有明显变化。
3 讨论
在四氧嘧啶诱导的糖尿病小鼠肾损伤模型中,黄连素降低血糖、改善肾功能作用与我们既往研究结果相一致[7,12]。然而黄连素抗糖尿病肾损伤的作用机制目前尚未完全明确。本研究发现黄连素明显抑制糖尿病小鼠肾脏S1P2受体表达上调,黄连素抗糖尿病效应是否与影响S1P2受体作用密切相关值得进一步研究。

Fig 4 Effect of berberine on MAPK signaling pathway elicited by S1P-S1P2 axis in mesangial cells under hyperglycemic condition(±s)
近年来,关于S1P受体在糖尿病肾病发病过程中作用及其机制的研究主要集中在免疫调节、炎症、血管生成等方面。有研究显示S1P和S1P2受体拮抗剂JTE-013联合局部注射可促进糖尿病db/db小鼠的伤口愈合,可能与促进肉芽组织血管生成,增强成纤维细胞化学趋化性等有关[14]。另有研究发现在STZ诱导的糖尿病大鼠肾皮质中S1P2/S1P1表达分布失衡,引起血管通透性改变,参与血管内皮损伤病变过程[15]。我们既往研究表明在四氧嘧啶诱导的糖尿病小鼠肾组织和高糖培养的系膜细胞中,SphK1-S1P通路激活和S1P2受体优势表达促进糖尿病肾脏纤维化发生发展过程[10-12]。这些研究结果提示SphK1-S1P-S1P2信号通路在DN病理进程中可能发挥重要作用。本研究发现黄连素在下调系膜细胞S1P2受体蛋白表达的同时,也降低S1P诱导的FN表达水平;S1P2-siRNA和黄连素联合处理后高糖状态下S1P诱导FN表达增加效应几乎完全消失,提示下调S1P2受体表达可能是黄连素抗糖尿病肾脏纤维化作用机制之一。
研究证据显示在肾损伤疾病中包括糖尿病肾病、炎症、毒性反应等,丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号转导通路在细胞增殖和细胞外基质积聚病理病变过程中发挥重要作用[16-18]。MAPK家族包括5大类:细胞外信号调节激酶(extracellular signal-regulated protein kinase,ERK1/2)、p38MAPK、c-Jun N 端激酶(c-jun NH2-terminal kinase,JNK)/应激激活的蛋白激酶(stress activated protein kinase,SAPK)以及 ERK5/BMK1。糖尿病状态下,高血糖、高血脂、氧化应激等均可激活MAPK,进而磷酸化下游转录因子如AP-1、CREB等,调节与细胞增殖和细胞外基质相关的基因和蛋白表达,导致或加速糖尿病肾病的发生发展。我们研究发现S1P2受体介导S1P诱导的系膜细胞增殖和FN表达增加的作用与激活MAPK(主要是 ERK1/2、p38MAPK)信号通路密切相关[11]。本研究显示黄连素可通过抑制S1P-S1P2-MAPK(ERK1/2和p38MAPK)信号通路而减少FN等细胞外基质的生成。另外还发现与S1P2-siRNA干预后ERK1/2和p38MAPK磷酸化水平降低不同的是,黄连素除了抑制ERK1/2、p38MAPK激活外,也明显降低JNK磷酸化水平,提示除了S1P2受体,黄连素可能存在其他的抑制MAPK信号通路激活的途径。S1P2-siRNA预处理后再给予黄连素,与单独干预相比ERK1/2磷酸化水平进一步降低而p-p38MAPK没有出现预期的叠加变化,考虑可能与黄连素对MAPK各成分的抑制作用强度不同有关。
综上,黄连素作用广泛,机制复杂,减少S1P2受体表达,抑制S1P2-MAPK(ERK1/2和p38MAPK)通路介导的FN表达增加是其抗糖尿病肾纤维化可能作用机制之一。黄连素降低S1P2受体表达的具体调节机制是我们感兴趣并将继续深入研究的内容。
[1] Tang L Q,Wei W,Chen L M,et al.Effects of berberine on diabetes induced by alloxan and a high-fat/high-cholesterol diet in rats[J].J Ethnopharmacol,2006,108(1):109-15.
[2] Yu S,Yu Y,Liu L,et al.Increased plasma exposures of five protoberberine alkaloids from Coptidis Rhizoma in streptozotocin-induced diabetic rats:is P-GP involved[J]?.Planta Med,2010,76(9):876-81.
[3] Xie X,Li W Y,Lan T,et al.Berberine ameliorates hyperglycemia in alloxan-induced diabetic C57BL/6 mice through activation of Akt signaling pathway[J].Endocrine J,2011,58(9),761-8.
[4] 刘慰华,黄河清,邓艳辉,等.黄连素对糖尿病肾损伤大鼠肾功能、氧化应激、肾脏醛糖还原酶的影响[J].中国药理学通报,2008,24(7):955-9.
[4] Liu W H,Huang H Q,Deng Y H,et al.Effects of berberine on renal function,oxidative stress and renal aldose reductase in rats with diabetic nephropathy[J].Chin Pharmacol Bull,2008,24(7):955-9.
[5] Liu W,Liu P,Tao S,et al.Berberine inhibits aldose reductase and oxidative stress in rat mesangial cells cultured under high glucose[J].Arch Biochem Biophys,2008,475(2):128-34.
[6] Jiang Q,Liu P,Wu X,et al.Berberine attenuates lipopolysaccharide-induced extracelluar matrix accumulation and inflammation in rat mesangial cells:involvement of NF-kappaB signaling pathway[J].Mol Cell Endocrinol,2011,331(1):34-40.
[7] Liu W,Zhang X,Liu P,et al.Effects of berberine on matrix accumulation and NF-kappa B signal pathway in alloxan-induced diabetic mice with renal injury[J].Eur J Pharmacol,2010,638(1-3):150-5.
[8] Siehler S,Manning D R.Pathways of transduction engaged by sphingosine 1-phosphate through G protein-coupled receptors[J].Biochim Biophys Acta,2002,1582(1-3):94-9.
[9] Takuwa Y.Subtype-specific differential regulation of Rho family G proteins and cell migration by the Edg family sphingosine-1-phosphate receptors[J].Biochim Biophys Acta,2002,1582(1-3):112-20.
[10]Lan T,Liu W H,Xie X,et.al.Sphingosine kinase-1 pathway mediates high glucose-induced fibronectin expression in glomerular mesangial cells[J].Mol Endocrinol,2011,25(12):2094-105.
[11]Liu W H,Lan T,Xie X,et al.S1P2 receptor mediates sphingosine-1-phosphate-induced fibronectin expression via MAPK signaling pathway in mesangial cells under high glucose condition [J].Exp Cell Res,2012,318(8):936-43.
[12]彭 晶,兰 天,黄凯鹏,等.黄连素调节鞘氨醇激酶-1-磷酸鞘氨醇信号通路抗糖尿病小鼠肾损伤的研究[J].中国药理学通报,2011,27(11):1544-9.
[12]Peng J,Lan T,Huang K P et al.Berberine ameliorates diabetic mouse renal injury through inhibition of SphK1-S1P signaling pathway[J].Chin Pharmacol Bull,2011,27(11):1544-9.
[13]覃肇源,刘慰华,黄河清.黄连素对高糖培养的大鼠肾小球系膜细胞FN及p38MAPK信号通路的影响[J].中国药理学通报,2009,25(9):1201-5.
[13]Qin Z Y,Liu W H,Huang H Q,et al.Effects of berberine on fibronectin and p38MAPK signal pathway in rat glomerul armesangial cells cultured under high glucose condition[J].Chin Pharmacol Bull,2009,25(9):1201-5.
[14]Kawanabe T,Kawakami T,Yatomi Y,et al.Sphingosine 1-phosphate accelerates wound healing in diabetic mice[J].J Dermatol Sci,2007,48(1):53-60.
[15]Imasawa T,Kitamura H,Ohkawa R,et al.Unbalanced expression of sphingosine 1-phosphate receptors in diabetic nephropathy[J].Exp Toxicol Pathol,2010,62(1):53-60.
[16]Ha H,Kim M S,Park J,et al.Mycophenolic acid inhibits mesangial cell activation through p38 MAPK inhibition[J].Life Sci,2006,79(16):1561-7.
[17]Cuenda A,Rousseau S.p38 MAP-kinases pathway regulation,function and role in human diseases[J].Biochim Biophys Acta,2007,1773(8):1358-75.
[18]王月华,侯延娟,任韫卓,等.抗氧化肽SS-31对高糖诱导的小鼠肾小球系膜细胞凋亡的影响[J].中国药理学通报,2013,29(1):102-7.
[18]Wang Y H,Hou Y J,Ren Y Z,et al.Influence of antioxidant peptide SS-31 on HG induced mouse mesangial cells apoptosis[J].Chin Pharmacol Bull,2013,29(1):102- 7.