海地瓜硫酸软骨素对3T3-L1前脂肪细胞增殖和分化的影响
2013-12-07龙腾腾王静凤常耀光武凤娟王玉明薛长湖
龙腾腾,王静凤,常耀光,贺 敏,武凤娟,王玉明,薛长湖
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
肥胖症是指体内脂肪积聚过多和(或)分布异常、体重增加,是导致Ⅱ型糖尿病以及冠心病、高血压、慢性肾衰等代谢综合征的重要危险因子[1-2]。脂肪合成的过程包括前脂肪细胞的增殖和分化,在分化过程中,PPARγ、C/EBPα和 SREBP-1c等调控脂肪合成相关基因的表达,对脂肪积蓄起关键作用[3]。因此,抑制前脂肪细胞的增殖和分化可减少机体脂肪的储存,是治疗或预防肥胖的策略之一。
海参多糖是海参体壁的重要功效成分之一,包括海参硫酸软骨素和海参岩藻聚糖硫酸酯两种组分[4]。其中,海参硫酸软骨素(sea cucumber chondroitin sufate,SC-CHS)是一种具有硫酸岩藻糖支链的类硫酸软骨素,主要由D-N-乙酰氨基半乳糖、D-葡萄糖醛酸和L-岩藻糖组成的分子杂多糖。近年来研究表明,海参硫酸软骨素具有抗肿瘤、提高机体免疫力、抗凝血、抗病毒等生理功效[5],尚未发现其降脂功效的相关报道。
本文以体外培养的小鼠3T3-L1前脂肪细胞为研究对象,检测AM-CHS对其增殖和分化的抑制作用,并对作用的靶时期和作用机制进行探讨,以期为新型海洋功能食品的开发和低值海参的高值化利用提供理论依据。
1 材料与方法
1.1 材料与试剂 海地瓜(Acaudina Molpadioides)干品,购自青岛市南山集贸市场;3T3-L1前脂肪细胞,购自 American Type Culture Collection公司;DMEM(Dulbecco's Modified Eagles Medium)培养基、小牛血清(Calf Serum,CS)由美国Gibco公司提供;四甲基偶氮唑盐(MTT)、二甲基亚砜(Dimethyl sulfoxide,DMSO)、3-异丁基-1-甲基黄嘌呤(3-Isobutyl-1-methylxanthine,IBMX)、胰岛素(insulin)、地塞米松(dexamethasone,Dex)、胰蛋白酶、油红 O染料,由美国Sigma公司提供;Taq酶、MMLV由日本TaKaRa公司提供;甘油三酯(Triglycerides,TG)测定试剂盒,由北京普利莱基因技术有限公司提供;小鼠过氧化物酶体增殖体激活受体(PPARγ)、CCAAT增强子结合蛋白α(C/EBPα)、固醇调节元件结合蛋白-1c(SREBP-1c)及β-actin引物,由上海生工生物技术公司提供;其它试剂均为国产分析纯。
1.2 仪器与设备 680型酶标仪(美国Bio-Rad公司);2711型CO2培养箱(德国Heraeus公司);TGL-16G型台式离心机、WGP-300型隔水恒温培养箱(上海安亭科学仪器厂);DL-CJ-1N型超净工作台(北京东联哈尔仪器制造有限公司);HH-8型数显恒温水浴锅(金坛市双捷实验仪器厂);TC-96 Life Pro基因扩增仪(杭州博日科技公司);JS-780全自动凝胶成像分析仪(上海培清科技公司);IX51倒置显微镜系统(Olympus公司)。
1.3 AM-CHS的制备 海地瓜干品粉碎,丙酮脱脂。用木瓜蛋白酶在60℃水浴下酶解24 h,加入10%的CPC溶液沉淀出粗多糖。粗多糖溶解于3 mol·L-1NaCl∶乙醇(100 ∶15V/V)中,加入 95%乙醇调溶液醇度至45%,4℃放置24 h,离心取上清。上清调醇度至75%,过夜取沉淀,得CHS粗品。CHS粗品过DEAE-52阴离子交换柱,以0~1.4 mol·L-1NaCl连续梯度缓冲盐溶液进行洗脱,每7 ml收集一管。洗脱液过液相TSK4000柱子,检测组分单一的管,收集后透析,真空冷冻干燥,得AM-CHS纯品[6]。
1.4 3 T3-L1前脂肪细胞的培养与分化 3T3-L1前脂肪细胞培养于含体积分数为10%小牛血清的DMEM培养基,其中含1×105U·L-1青霉素和1×105μg·L-1硫酸链霉素。以0.25%的胰酶消化传代,于37℃、5%CO2、饱和湿度的孵箱中常规传代贴壁培养。
取对数生长期的3T3-L1前脂肪细胞,用DMEM完全培养基调细胞浓度接种于培养板内。待细胞融合后接触抑制48 h(此时为诱导分化的0 d),换用含 0.5 mmol·L-1IBMX、1 μmol·L-1DEX、10 mg·L-1胰岛素的完全培养基培养48 h,再换用含10 mg·L-1胰岛素的完全培养液培养48 h,以后每2 d更换1次完全培养液,并于d 8进行脂肪含量检测。
1.5 AM-CHS对3T3-L1前脂肪细胞增殖活性的影响 取密度为2×107·L-1的3T3-L1前脂肪细胞悬液接种于96孔板内,每孔100 μl。24 h后弃培养基,加入含不同浓度AM-CHS的完全培养基(分别为 0、50、100 和 200 mg·L-1),每孔 200 μl,每个浓度4个复孔,分别培养24、48、72和96 h。于实验结束前4 h加MTT,继续培养4 h后吸弃培养基,加入酸化异丙醇200 μl/孔,吹打至蓝色结晶完全溶解,于酶标仪570 nm处测定吸光度A值,细胞增殖活性以样品组A值/对照组A值×100%表示。
1.6 AM-CHS对不同分化时期的3T3-L1脂肪细胞增殖活性的影响 取密度为2×107·L-1的3T3-L1前脂肪细胞悬液接种于96孔板内,每孔200 μl。诱导细胞分化方法如“1.4”所述,分别在细胞分化的早期(0 d)、中期(2 d)、晚期(4 d)加入不同浓度的 AM-CHS(分别为 0、50、100 和 200 mg·L-1),并在d 8用MTT法于570 nm处测定吸光度A值,并计算样品组A值/对照组A值×100%。
1.7 AM-CHS对3T3-L1成熟脂肪细胞增殖活性的影响 取密度为2×107·L-1的3T3-L1前脂肪细胞悬液接种于96孔板内,每孔200 μl。诱导细胞分化方法如“1.4”所述,在分化后的d 8加入不同浓度的 AM-CHS(分别为 0、50、100 和 200 mg·L-1),分别培养24、48、72和96 h,MTT法于570 nm 处测定吸光度A值,并计算样品组A值/对照组A值×100%。
1.8 AM-CHS对3T3-L1前脂肪细胞分化的影响
取密度为3×107·L-1的3T3-L1前脂肪细胞悬液接种于24孔板内,每孔1 ml。诱导细胞分化方法如“1.4”所述,分别在细胞分化的早期(0 d)、中期(2 d)、晚期(4 d)加入不同浓度的AM-CHS(分别为0、60、120和240 mg·L-1),将诱导分化8 d的脂肪细胞用10%多聚甲醛固定1 h,0.5%油红O染色30 min后,于倒置显微镜下观察并拍照。加入异丙醇溶解脂肪细胞中的油红O,于490 nm波长下检测吸光度值,半定量检测细胞内的脂肪含量[7]。
将诱导分化8 d的脂肪细胞用PBS洗3次去除释放的甘油,加入细胞裂解液并超声破碎,离心取上清,参照试剂盒检测TG含量。
1.9 Real time PCR 检测 PPARγ、C/EBPα 和SREBP-1c mRNA的表达 3T3-L1细胞分化干预方法如“1.8”所述,于分化的d 8收集细胞,采用Trizol法提取总RNA。取1 μg总RNA逆转录成cDNA,采用30 μl反应体系进行PCR扩增。反应体系包括 500 ng cDNA、45 mmol·L-1MgCl2、3 μl 10 ×缓冲液、12 mmol· L-1dNTPs、6 μmol 引物、3U TaqDNA聚合酶。PCR反应条件为:94℃预变性5 min,94℃变性 45 s,退火 30 s,72℃延伸 45 s,最后72℃延伸10 min,不同基因的引物序列、退火温度和循环数见Tab 1。产物经1%琼脂糖凝胶电泳,并进行条带的灰度扫描,以β-actin作为内参校正,目的基因的相对表达量以目的基因灰度值/β-actin灰度值×100%表示。
1.10 统计学分析 数据分析采用SPSS11.0软件进行单因素方差分析,同时进行LSD两两比较,实验结果用±s表示。
2 结果
2.1 AM-CHS对分化不同时期3T3-L1细胞增殖活性的影响 结果如Fig 1所示,与正常组相比,AM-CHS能明显抑制3T3-L1前脂肪细胞(Fig1A)的增殖,其96 h的抑制率达到18.73%(P<0.01)。AM-CHS可明显抑制3T3-L1成熟脂肪细胞(图1C)的增殖,其72 h和96 h的平均抑制率分别为20.40%(P<0.01)和21.61%(P<0.01)。AMCHS对分化不同时期3T3-L1细胞(Fig 1B)的增殖均无明显性影响。说明AM-CHS对3T3-L1前脂肪细胞和成熟脂肪细胞有高度的靶向性,而并不影响分化过程中的3T3-L1细胞数目。
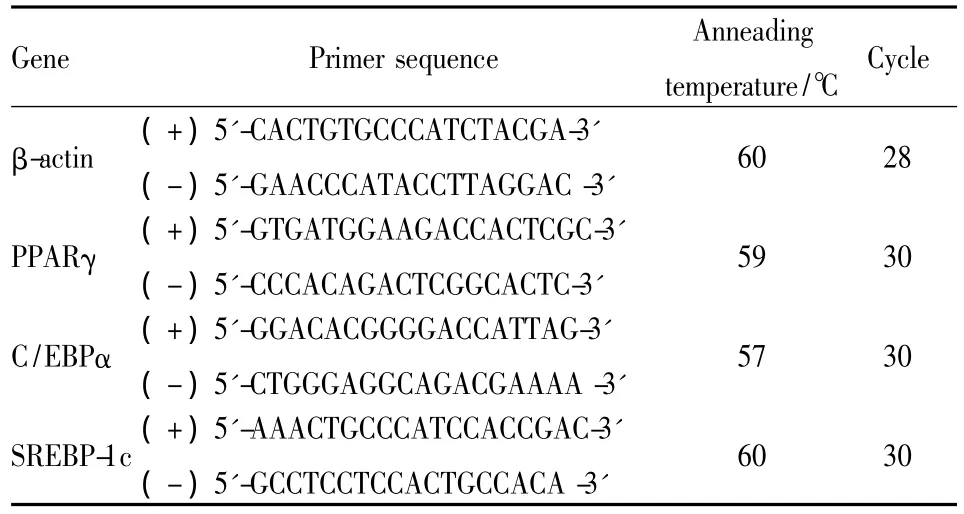
Tab 1 Primer sequences,annealing temperature and cycles of different genes
2.2 AM-CHS对分化不同时期3T3-L1脂肪细胞成脂的影响 如Fig 2所示,正常组细胞呈现典型的脂肪细胞表型,90%以上的细胞富含脂滴。分别在分化的d 0和d 2加入AM-CHS均可明显抑制3T3-L1细胞分化,细胞的脂滴明显减少,与正常组相比,其平均抑制率分别为27.82%(P<0.01)和12.14%(P<0.01);另外,d 0加样后抑制分化作用呈现量效关系,200 mg·L-1AM-CHS处理组抑制作用最强,抑制率达到33.26%(P<0.01)。当d 4加入AM-CHS后对3T3-L1细胞分化作用影响甚微,差异未见显著性。提示海地瓜AM-CHS能明显抑制3T3-L1细胞的分化,减少脂质聚集,以早期抑制作用最强。
2.3AM-CHS对PPARγ mRNA表达水平的影响
过氧化物酶体增殖体激活受体(PPARγ)是脂肪细胞特异性的转录因子,能转录、激活脂肪酸结合蛋白、磷酸烯醇式丙酮酸羧激酶等脂质合成基因的表达而促进脂滴聚集,在脂肪细胞分化和脂肪生成中起关键作用。
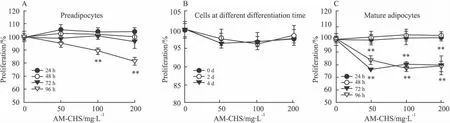
Fig 1 Effects of AM-CHS on the proliferation activities of 3T3-L1 cells at different time(n=6)
由Fig 3可见,分化d 0和d 2的3T3-L1细胞经AM-CHS干预后,其PPARγ mRNA表达量明显降低(P<0.01),较正常对照组平均降低了58.14%(P<0.01)和40.78%(P<0.01)。分化d 4干预后,PPARγ mRNA表达量较正常对照组降低了13.49%,但差异无显著性。提示AM-CHS可以通过降低分化关键基因PPARγ mRNA的表达,抑制3T3-L1细胞的分化,且干预的最佳时期是分化早期。
2.4 AM-CHS对C/EBPα mRNA表达水平的影响 CCAAT增强子结合蛋白α(C/EBPα)在脂肪细胞分化中具有促进PPARγ的高表达,保持分化细胞表型的作用[8]。Fig 4显示,在3T3-L1细胞分化的d 0、2、4分别加入 AM-CHS后,其 C/EBPα mRNA 表达量均明显降低,分别较正常对照组平均降低了67.95%(P<0.01)、42.78%(P<0.01)和 37.87%(P<0.01)。其中,AM-CHS对3T3-L1细胞分化早期的干预作用最为明显。
2.5AM-CHS对SREBP-1c mRNA表达水平的影响 固醇调节元件结合蛋白-1c(SREBP-1c)能够激活关键生脂基因而增加脂肪酸和脂肪的合成,在脂肪细胞分化中起重要的正调控作用。Fig 5显示,在3T3-L1细胞分化的d 0、2、4加入AM-CHS干预后,其SREBP-1c mRNA表达量均明显降低,分别较正常对照组平均降低了58.47%(P<0.01)、45.12%(P<0.01)和28.56%(P<0.01)。提示 AM-CHS可以通过抑制SREBP-1c mRNA的表达从而抑制3T3-L1细胞的分化,且早期干预抑制作用最强。
3 讨论
脂肪细胞的分化过程伴随着细胞数量增加、体
积增大及TG聚积[9]。当前脂肪细胞数目过度增多和分化失常时可引起脂肪组织堆积,继而导致肥胖的发生[10]。因此抑制前脂肪细胞的增殖和分化是抗肥胖的一个重要思路。近年来脂肪细胞分化的调控及其与肥胖发病机制的关系一直是国内外的研究热点。本实验以体外培养的3T3-L1前脂肪细胞为研究对象,研究AM-CHS对3T3-L1前脂肪细胞增殖和分化的影响以及作用机制的初探。结果表明,AM-CHS能明显地抑制3T3-L1细胞的增殖和分化,减少脂肪细胞分化过程中脂质的堆积。提示AMCHS可能具有潜在的减肥降脂效应。
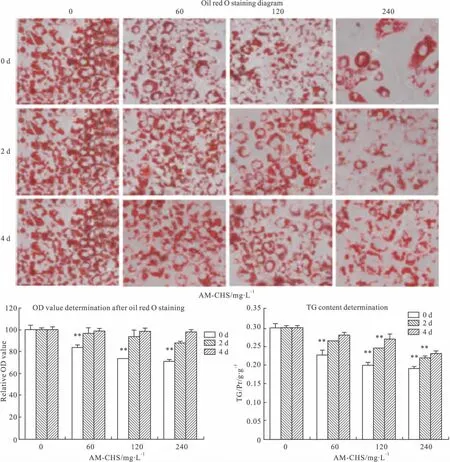
Fig 2 Effects of AM-CHS on the degree of differentiation of 3T3-L1 cells at different time(n=6)
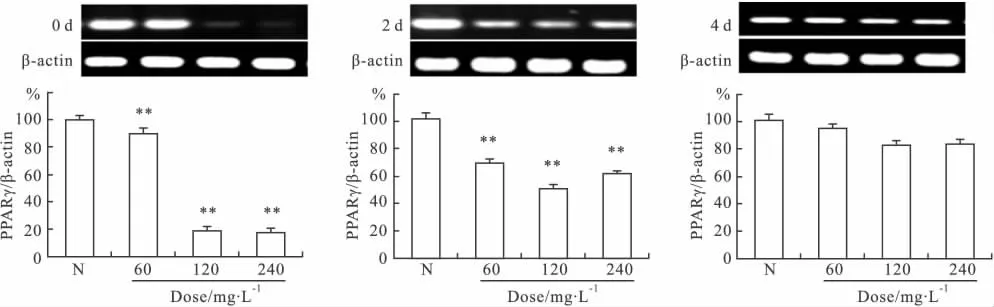
Fig 3 Effects of AM-CHS on the PPARγ mRNA expression level of 3T3-L1 adipocytes at different time(n=6)
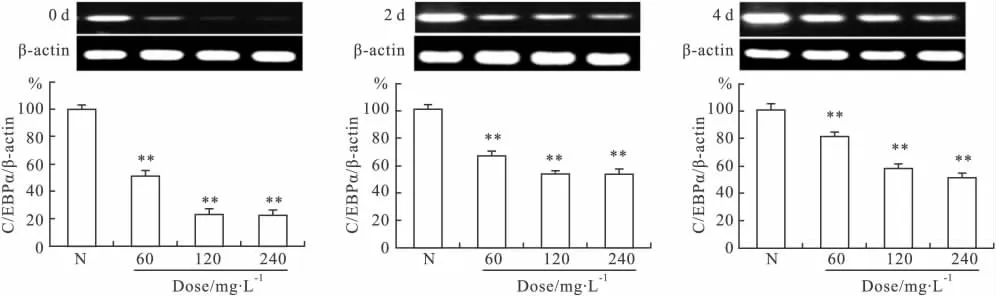
Fig 4 Effects of AM-CHS on the C/EBPα mRNA expression level of 3T3-L1 adipocytes at different time(n=6)
脂肪细胞分化是一个高度精细的调控过程,受到激素、基因和信号转导通路的调控。目前研究认为,PPARγ、C/EBPα和 SREBP-1c 3者是调节脂肪形成最主要的转录因子。
PPARγ是特异性表达于脂肪组织中的核转录因子,主要调节与脂肪酸代谢相关基因的表达,最终促进脂肪的合成。Kadowaki等[11]研究表明,杂合的PPARγ基因缺失小鼠在高脂饮食情况下不会发生肥胖,说明降低PPARγ表达能防止高脂饮食引起的脂肪细胞过度肥大。本研究结果显示,AM-CHS能明显抑制PPARγ mRNA的表达,说明抑制PPARγ的表达是AM-CHS抑制3T3-L1前脂肪细胞分化的有效途径之一。
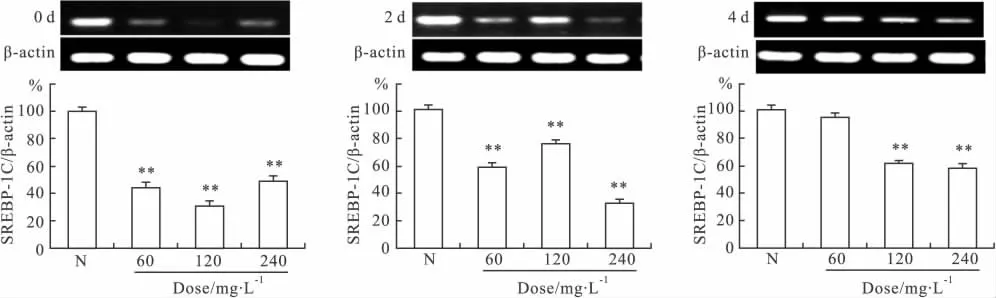
Fig 5 Effects of AM-CHS on the SREBP-1c mRNA expression level of 3T3-L1 adipocytes at different time(n=6)
C/EBPα属于亮氨酸拉链转录因子家族,可诱导成纤维细胞中的脂肪形成。活化的C/EBPα不仅能促进自身的表达增加,而且还能够与PPARγ起协同作用,共同诱导细胞分化。Wu等[12]研究表明C/EBPα的异位表达可诱导成纤维细胞中的脂肪形成,而反义表达则抑制前体脂肪细胞分化,说明C/EBPα在调控脂肪合成方面起正调控作用。本研究结果显示,AM-CHS能通过抑制脂肪细胞分化相关基因C/EBPα mRNA的表达而抑制3T3-L1前脂肪细胞向成熟脂肪细胞的分化。
SREBP是一种能和固醇调节元件特异性结合的核转录因子,在调控胆固醇、脂肪酸和甘油三酯合成方面起重要作用。Kim等[13]已证明SREBP-1c能够通过PPARγ启动子中的E盒基序促进内源性PPARγ的产生,并与 PPARγ和 C/EBPα共同调控脂肪细胞的分化。Shimano等[14]研究表明,SREBP-1c缺失的小鼠中促进脂质合成的基因表达量下降,脂肪含量明显降低。本研究结果显示,AM-CHS能明显抑制 SREBP-1c mRNA的表达,继而抑制PPARγ和 C/EBPα的表达,具有直接抑制3T3-L1前脂肪细胞分化的作用。
综上所述,AM-CHS可明显抑制3T3-L1前脂肪细胞和成熟脂肪细胞的增殖,抑制前脂肪细胞向成熟脂肪细胞分化,其机制与下调分化关键基因PPARγ、C/EBPα和SREBP-1c mRNA的表达有关,其中干预早期抑制作用最强。但其如何作用于PPARγ、C/EBPα 和 SREBP-1c,作用后其下游相关基因如何表达变化以及信号通路还有待于进一步研究。
[1]Petersen K F,Shulman G I.Etiology of insulin resistance[J].The American J Med,2006,119:10s-6s.
[2]Waki H,Tontonoz P.Endocrine functions of adipose tissue[J].Annual Review Patbol,2007,2:31-56.
[3]陈思凡,肖新才,孙延双,等.白藜芦醇对小鼠3T3-L1细胞增殖与分化的影响及其机制[J].中国药理学通报,2010,26(1):108-11.
[3]Chen S F,Xiao X C,Sun Y S,et al.Effect of resveratrol on proliferation and differentiation of murine 3T3-L1 preadipocytes and the underlying mechanisms[J].Chin Pharmacol Bull,2010,26(1):108-11.
[4]徐雷雷,王静凤,李 辉,等.岩藻糖基化海参硫酸软骨素抑制肿瘤血管新生作用的研究[J].中国海洋药物,2012,32(4):14-9.
[4]Xu L L,Wang J F,Li H,et al.Study on the antiangiogenesis effect of chondroitin sulfate isolated from Isostichopus badionotus[J].Chin J Mar Drugs,2012,32(4):14-9.
[5]盛文静,薛长湖,王静凤,等.两种海参酸性粘多糖化学组成及对血管内皮细胞保护作用的比较[J].中国海洋大学学报,2006,12:62-6.
[5]Shang W J,Xue C H,Wang J F,et al.Analysis of chemical composition of polysaccharides from two sea cucumbers and their protective effects on vascular endothelial cells[J].Period Ocean Univ China,2006,12:62-6.
[6]Chen S G,Xue C H,Ying L A,et al.Comparison of structures and anticoagulant activities of fucosylated chondroitin sulfates from different sea cucumbers[J].Carbohydr Polym,2011,83:688-96.
[7]Madera H,Hosokawa M,Sashima T,et al.Fucoxanthin and its metabolite,fucoxanthinol,suppress adipocytes differentiation in 3T3-L1 cells[J].J Mol Med,2006,18(1):147-52.
[8]Ramji D P,Foka P.CCAAT/enhancer-binding proteins:structure,function and regulation[J].Biochem J,2002,365:561-75.
[9]Billon N,Monteiro M C,Dani C.Developmental origin of adipocytes:New insights into a pending question[J].Biol Cell,2008,100(10):563-75.
[10]巫冠中,郭永起,苏 欣,等.大豆黄素衍生物LRXH609的减肥作用及机理探讨[J].中国临床药理学与治疗学,2009,14(5):519-23.
[10]Wu G Z,Guo Y Q,Su X,et al.Studies on the antiobesity action and mechanisms of daidzein derivative:LRXH609[J].Chin J Clin Pharmacol Ther,2009,14(5):519-23.
[11]Kadowaki T,Hara K,Kubota N,et al.The role of PPARγ in high-fat diet-induced obesity and insulin resistance[J].J Diabetes Complications,2002,16(1):41-5.
[12]Wu Z,Rosen E D,Brun R,et al.Cross-regulation of C/EBP alpha and PPAR gamma controls the transcriptional pathway of adipogenesis and insulin sensitivity[J].Mol Cell,1999,3(2):151-8.
[13]Kim J B,Wright H M,Wright M,et al.ADD1/SREBP1 activates PPAR gamma through the production of endogenous ligand [J].Proc Natl Acad Sci USA,1998,95(8):4333-7.
[14]Shimano H,Shimomura I,Hammer RE,et al..Elevated levels of SREBP-2 and cholesterol synthesis in livers of mice homozygous for a targeted disruption of the SREBP-1 gene [J].J Clin Invest,1997,100(8):2115-24.