人参皂苷Rh2抑制实验性大鼠子宫异位内膜增殖及其作用机制探讨
2013-12-07郝树芳周洁芸周娴颖郭湘洁谢淑武
盛 磊,郝树芳,周洁芸,杨 英,周娴颖,郭湘洁,李 钊,谢淑武,朱 焰
(1.复旦大学,上海 200032;2.上海市计划生育科学研究所生殖药理组,国家人口和计划生育委员会计划生育药具重点实验室,上海生殖健康药具工程技术研究中心,上海 200032;3.山西省儿童医院妇幼保健院,山西太原 030002;4.宁夏银川市第一人民医院,宁夏银川 750001)
子宫内膜异位症(Endometriosis,EMs)虽然是一种良性妇科疾病,但具有恶性肿瘤种植、生长、浸润等特点。育龄期女性子宫内膜异位症的发病率高达10~15%[1]。EMs的治疗原则是根据患者年龄、症状、病变部位、病情严重程度和范围以及患者对生育的要求情况等因素采用药物治疗、手术治疗或手术联合药物治疗等方法[2]。人参皂苷是人参中最主要的活性成分。研究显示人参皂苷Rh2可抑制癌细胞向其它器官转移,并通过调控肿瘤细胞增殖周期、诱导细胞分化和凋亡来发挥抗肿瘤作用[3]。因此,我们应用实验性EMs大鼠模型,观察人参皂苷Rh2对实验性大鼠子宫内膜异位症的治疗作用,并研究了人参皂苷Rh2对血清E2、P和EMAb水平的影响,以及异位内膜中凋亡相关蛋白Bcl-2、Bax、Caspase-9、Caspase-3表达的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 ♀成熟未孕清洁级SD(Sprague Dawley)大鼠60只,实验前体重为200 g~250 g,由上海西普尔-必凯公司提供,合格证号:SCXK(沪)2008-0016。
1.1.2 药品和试剂 人参皂苷Rh2:HPLC>99%,购自上海顺博生物工程有限公司,批号:20100811。Elisa试剂盒(雌激素E2、孕激素P、抗子宫内膜抗体EMAb)购自美国ADL生物科技公司;蛋白裂解液、BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;Bax、Bcl-2、β-actin购自美国Santa Cruz公司;Caspase-9、Caspase-3、HRP标记的羊抗兔 IgG,HRP标记的羊抗小鼠IgG购自abcam公司。
1.2 方法
1.2.1 动物模型制备 参照文献[4]选取动情周期规则的SD大鼠35只进行造模,其中造模成功的大鼠共30只。手术在无菌环境中进行,以3%戊巴比妥钠麻醉大鼠1 ml·kg-1。将大鼠仰卧四肢固定于手术台上,腹部消毒后做2~3 cm切口,游离右侧子宫,剪取靠近卵巢处约1.5 cm一段子宫置入含生理盐水的培养皿中,肌层与子宫内膜层分离后,将内膜剪成5 mm×5 mm大小与腹壁肌肉缝合固定,常规关腹。
1.2.2 模型的判定 模型建立21 d后,第2次开腹,用电子游标卡尺测量移植物的长mm、宽mm、高mm,按照V=D1×D2×D3计算异位内膜体积(D1,D2,D3分别是异位内膜长,宽,高),记录观察移植物的生长情况,存活与否。EMs模型建模成功观察标准[5]:移植灶体积增大(体积大于25 mm3;高度大于1 mm),呈透明的结节状、囊状、有澄清液体积聚,移植物被结缔组织覆盖并有血管形成,质地软。
1.2.3 分组给药及解剖取材 造模成功的大鼠共30只,每组6只,按模型异位内膜大小随机分为5组:模型对照组给予溶剂0.5%羧甲基纤维素钠(0.5%CMC-Na 1.5 ml·kg-1·d-1)、阳性对照组给予孕三烯酮(1.5 mg·kg-1·d-1)、Rh2 低、中、高组分别给予 Rh2(5、10、40 mg·kg-1·d-1),分别相当于人(60 kg)用剂量 50、100、400 mg·d-1。Rh2混溶于0.5%CMC-Na中配成混悬液。连续灌胃21 d,在末次给药24 h内麻醉解剖大鼠,经腹主动脉取血,测量异位内膜大小,立即取出异位内膜组织,于4%多聚甲醛和液氮保存。异位内膜抑制率按如下公式计算:抑制率/%=(V给药前- V给药后)/V给药前×100%,V为异位内膜体积。
1.2.4 HE染色 将置于4%多聚甲醛中固定的正常子宫和异位内膜进行常规石蜡包埋,HE染色,光学显微镜下观察正常子宫及异位内膜组织病理形态学特点。
1.2.5 ELISA 检测 血清中 E2、P和 EMAb水平测定方法按照说明书操作步骤进行,所有样本均设置复孔检验以减少误差。最后在450 nm波长处读取吸光度值,做出标准曲线读出各指标的浓度。
1.2.6 Western blot分析 异位内膜组织加蛋白裂解液冰上匀浆,12 000×g离心15 min后取上清液,BCA蛋白测定试剂盒测定蛋白浓度。每组每份样本取100 μg进行12%的聚丙烯酰胺凝胶电泳(浓缩胶80 V,15 min;分离胶110 V,1 h),转膜(110 V,1.5 h),Bcl-2(1 ∶1 000)、Bax(1 ∶1 000)、β-actin(1∶1 000)、Caspase-9(1∶1 000)和 Caspase-3(1∶1 000)4℃孵育过夜,HRP标记的山羊抗兔IgG(1∶2 000),HRP标记的山羊抗小鼠 IgG(1∶5 000)室温孵育1 h,ECL显色液显影,暗室曝光扫描灰度值。各目的条带与β-actin条带灰度值比值作为该目的蛋白的相对表达量。
2 结果
2.1 Rh2对在位子宫内膜及异位内膜形态结构的影响 组织学观察结果显示,模型对照组的异位内膜体积明显增大(Fig 1A~B),而Rh2高剂量组(40 mg·kg-1)明显抑制异位内膜生长,异位内膜明显缩小(Fig 1C~D)。
模型对照组大鼠与Rh2各剂量组大鼠在位子宫无明显差异。均可见子宫平滑肌层较薄,平滑肌细胞细长,内环外纵,规则排列。内膜腺体形态规则,呈圆形或椭圆形,数量多,腺腔小,腺体上皮细胞均为单层立方或柱状,核下可见空泡和顶浆分泌(Fig 2A)。与在位内膜相比,手术移植的异位内膜生长良好,在镜下可见生成一个腔样结构,囊内有丰富的分泌物(Fig 2B),提示异位内膜模型建立成功。给药21 d后,与模型对照组相比,Rh2各剂量组大鼠异位内膜生长受到不同程度抑制,并可观察到异位内膜组织萎缩,间质疏松,腺体数目减少,腺腔明显萎缩,腔内积液体积缩小(Fig 2D~F)。
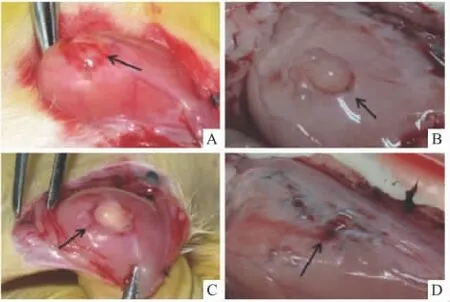
Fig 1 Effect of Rh2 on gross morphology of ectopic endometrium in the rat model of endometriosis
2.2 Rh2对SD大鼠异位内膜生长的抑制作用在连续给予21 d 0.5%CMC-Na、孕三烯酮和Rh2后,模型对照组异位内膜体积明显增大,而孕三烯酮组和Rh2低、中、高剂量组在给予不同剂量后异位内膜生长受到抑制,异位内膜体积明显减小。Rh2(5、10、40 mg·kg-1)对异位内膜生长的抑制率呈剂量依赖性地增加。与模型对照组相比,孕三烯酮(1.5 mg·kg-1)和 Rh2(5、10、40 mg·kg-1)能明显抑制异位内膜生长(P<0.05)(Tab 1)。
2.3 Rh2对血清中E2,P,EMAb水平的影响结果显示,连续给予 Rh2(5、10、40 mg·kg-1)21 d后,大鼠血清中E2、P和EMAb水平呈剂量依赖性地降低。与模型对照组相比,Rh2(40 mg·kg-1)血清中E2、P和 EMAb水平明显降低(P<0.05)(Tab 2)。

Fig 2 Effect of Rh2 on histopathological change of ectopic endometrium in the rat model of endometriosis
Tab 1 Inhibitory effect of Rh2 on the growth of ectopic endometrium in the model rat of endometriosis(±s,n=6)
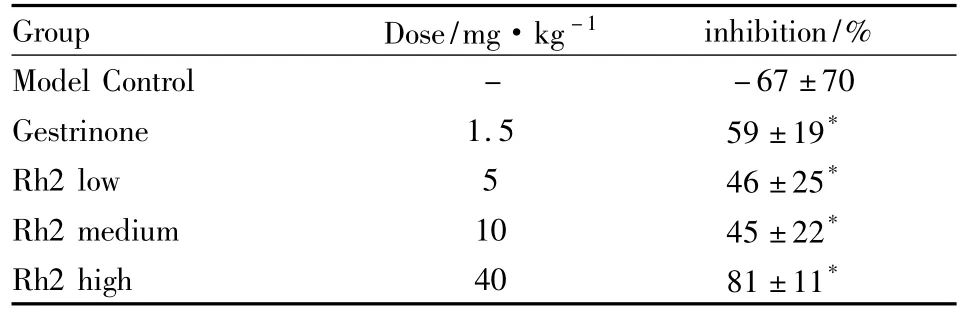
Tab 1 Inhibitory effect of Rh2 on the growth of ectopic endometrium in the model rat of endometriosis(±s,n=6)
*P<0.05 vs model control
Group Dose/mg·kg-1inhibition/%Model Control - -67±70 Gestrinone 1.5 59 ±19*Rh2 low 5 46±25*Rh2 medium 10 45±22*Rh2 high 40 81±11*
Tab 2 Effect of Rh2 on the serum level of E2,P and EMAb in the rat model of endometriosis( ± s,n=6)
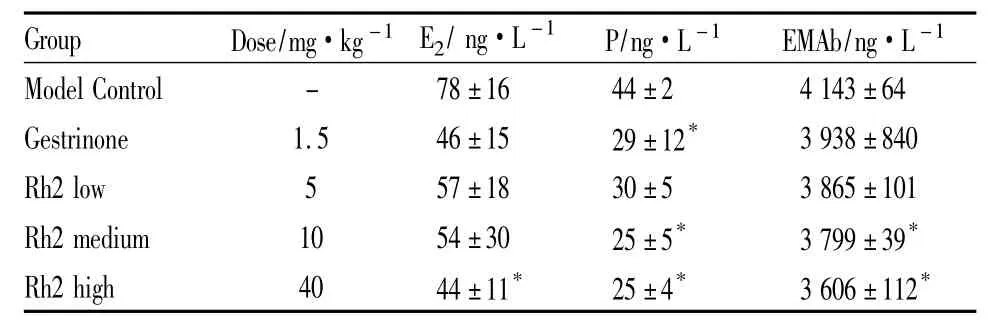
Tab 2 Effect of Rh2 on the serum level of E2,P and EMAb in the rat model of endometriosis( ± s,n=6)
*P<0.05 compared with model control
Group Dose/mg·kg-1 E2/ng·L -1 P/ng·L-1 EMAb/ng·L -1 Model Control - 78±16 44±2 4 143±64 Gestrinone 1.5 46±15 29±12* 3 938±840 Rh2 low 5 57±18 30±5 3 865±101 Rh2 medium 10 54±30 25±5* 3 799±39*Rh2 high 40 44±11* 25±4* 3 606±112*
2.4 Rh2对 Bcl-2、Bax表达的影响 Western blot结果显示,Bax随Rh2剂量增大表达增加,而Bcl-2随Rh2剂量增大表达减少。与模型对照组相比,Rh2高剂量组(40 mg·kg-1)Bax蛋白的表达差异有显著性(P<0.05),Bax/Bcl-2的比例明显增加(P<0.05)(Fig 3)。
2.5 Rh2对Caspase-3 and Caspase-9表达的影响Western blot结果显示,在模型对照组中,Caspase-3、剪切后Caspase-3和Caspase-9蛋白表达较少;而在孕三烯酮对照组和 Rh2(5、10、40 mg·kg-1)组中,Caspase-3、剪切后Caspase-3和Caspase-9蛋白表达增加,且与Rh2剂量效应呈正相关。与模型对照组相比,在Rh2高剂量组(40 mg·kg-1)中Caspase-3、剪切后Caspase-3和Caspase-9表达明显升高(P<0.05)(Fig 4)。
3 讨论
人参是我国名贵的中药材,其中人参皂苷是人参主要的生物活性物质。到目前为止,已分离鉴定40余种单体,人参皂苷单体化合物中Rg1、Rb1、Re、Rb2等含量较高,往往作为主要人参皂苷进行研究。而Rh2、Rd、Rg3和Compound K等稀有皂苷,药理活性则优于主要人参皂苷,与其他化疗药物联合应用有协同作用,现在也逐渐成为研究的热点[6]。人参皂苷Rh2具有免疫调节和抗炎等各种生物活性,尤其抗肿瘤活性更为国内外学者所重视[7]。本文首次观察了人参皂苷Rh2对实验性大鼠子宫内膜异位症的抑制作用,目的在于探索将天然产物单体用于治疗子宫内膜异位症的可能性。我们的研究结果显示,给予人参皂苷 Rh2(5、10、40 mg·kg-1)后,异位内膜生长减缓,体积减小,随着Rh2剂量增加,对异位内膜生长的抑制率呈剂量依赖性地增加;而给予溶剂0.5%CMC-Na的模型对照组中,异位内膜生长迅速,体积增大,不能抑制异位内膜生长,提示人参皂苷Rh2可用于治疗子宫内膜异位症。
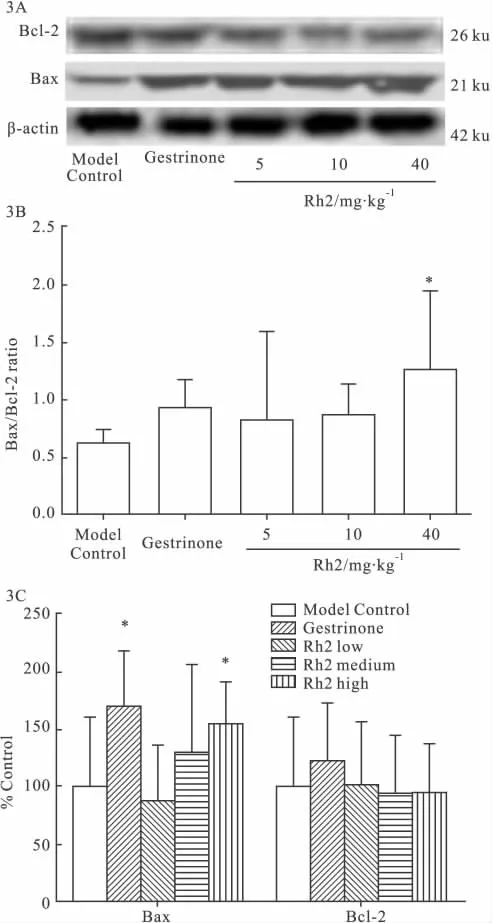
Fig 3 Effect of Rh2 on the expression of Bcl-2,Bax of ectopic endometrium in the rat model of endometriosis(n=6)
子宫内膜异位症是一种激素依赖性疾病,降低激素的水平可用来治疗该疾病。EMAb是一种自身抗体,当子宫内膜有炎症发生时EMAb的水平会明显升高,造成子宫内膜功能异常,甚至导致不孕或流产。EMAb的产生,一方面是因异位子宫内膜刺激免疫系统,另一方面是机体的免疫系统失常的原因[8]。本实验通过Elisa方法测定Rh2作用后的大鼠血清E2、EMAb和P水平,发现血清中E2、EMAb和P水平随着Rh2剂量的加大而降低,其中Rh2(40 mg·kg-1)明显降低 E2、EMAb和 P 水平,表明Rh2抑制异位内膜的生长与E2、EMAb和P水平降低有关。
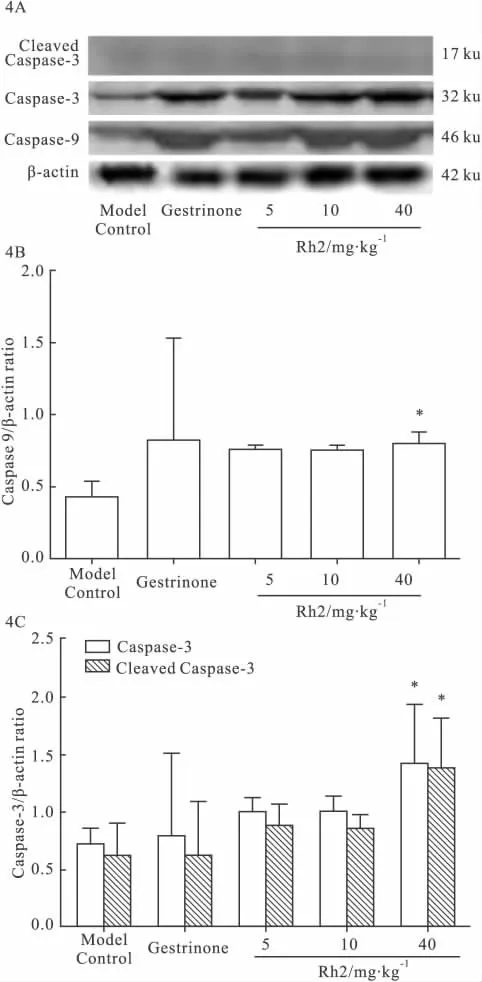
Fig 4 Effect of Rh2 on the expression of Caspase-9,Caspase-3 and cleaved Caspase-3 of ectopic endometrium in the rat model of endometriosis(n=6)
Bcl-2基因是一种原癌基因,具有抑制凋亡的作用。Bax基因属于Bcl-2基因家族,其编码的Bax可与Bcl-2形成异二聚体,对 Bcl-2产生阻抑作用[9-10]。本实验结果表明,Rh2(5、10 和 40 mg·kg-1)可增加 Bax表达,降低 Bcl-2表达,其中 Rh2(40 mg·kg-1)明显增加Bax的表达,升高Bax/Bcl-2比例(P<0.05),该结果提示Rh2可以通过增加Bax/Bcl-2的表达,发挥抑制异位内膜生长的作用。该结果和Bilotas等[11]发现GnRHa通过增加Bax表达,降低Bcl-2表达,诱导子宫异位内膜细胞的凋亡,而达到治疗疾病的结果相似。
然而凋亡发生是一个复杂的、由Caspase家族介导的蛋白酶级联反应过程,即凋亡信号首先活化启动型 Caspase(如 Caspase-2,8,9),再介导水解效应型 Caspase酶原,使效应型 Caspase活化(如Caspase-3,6,7),然后作用于底物,使蛋白分解引起细胞凋亡[12]。本实验结果显示,Rh2(40 mg·kg-1)能明显提高异位内膜细胞的 Caspase-3和Caspase-9的表达,提示了Rh2可通过Caspase家族介导的蛋白酶级联反应诱导子宫异位内膜细胞的凋亡。
综上所述,本文首次发现了Rh2(40 mg·kg-1)可明显抑制大鼠子宫异位内膜的生长,其作用机制可能与降低 E2、P、EMAb水平、上调 Bax/Bcl-2表达、激活细胞凋亡的内源性途径启动因子Caspase-9蛋白、激活执行因子Caspase-3蛋白表达和诱导子宫异位内膜细胞的凋亡有关。该结果表明天然产物单体人参皂苷Rh2可用于治疗子宫内膜异位症。
[1]郎景和.以转化医学的观念促进子宫内膜异位症的研究[J].国际妇产科学杂志,2011,38(4):261-2.
[1]Lang J H.Translational medicine in improving endometriosis researches[J].J Int Obstet Gynecol,2011,38(4):261- 2.
[2]吴兰芬,杨玉秀.子宫内膜异位症治疗进展[J].吉林医学,2012,33(3):614-5.
[2]Wu L F,Yang Y X.Advances in the treatment of endometriosis[J].Jilin Medical J,2012,33(3):614-15.
[3]李秋影,颜璐璐,马晓慧,等.20(S)-人参皂苷Rh2对人结肠癌细胞增殖和周期的影响[J].中成药,2011,33(11):1874-8.
[3]Li Q Y,Yan L L,Ma X H,et al.Effect of 20(S)-ginsenoside Rh2 on cell proliferation and cycle of human colon cancer cells[J].Chin Tradit Patent Med,2011,33(11):1874-8.
[4]郝树芳,周娴颖,谢淑武,等.诺美孕酮促进大鼠子宫内膜异位症细胞凋亡及其作用机制[J].中国药理学通报,2012,28(3):425-9.
[4]Hao S F,Zhou X Y,Xie S W et al.Effect of nomegestrol acetate on the apoptosis of endometriosis in rat models and its mechanism[J].Chin Pharmacol Bull,2012,28(3):425- 9.
[5]杨耀芳,王钦茂.建立大鼠子宫内膜异位症模型的评价方法[J].中国药理学通报,1998,14(5):469-70.
[5]Yang Y F,Wang Q M.Establishement of rats endometriosis model evaluation method[J].Chin Pharmacol Bull,1998,14(5):469-70.
[6]Xie X,Eberding A,Madera C,et al.Rh2 synergistically enhances paclitaxel or mitoxantrone in prostate cancer models[J].J Urol,2006,175(5):1926-31.
[7]Kim H S,Lee E H,Ko S R,et al.Effects of ginsenosides Rg3 and Rh2 on the proliferation of prostate cancer cells[J].Arch Pharm Res,2004,27(4):429-35.
[8]朱小凤,蒋凤艳.血清CA125、EmAb在子宫内膜异位症中的作用[J].中外医疗,2010,29(18):1-3.
[8]Zhu X F,Jiang F Y.The role of CA125 And EmAb in the serum of patients with endometriosis[J].China Foreign Med Treatment,2010,29(18):1-3
[9]Chao D T,Korsmeyer S J.BCL-2 family:regulators of cell death[J].Annu Rev Immunol,1998,16:395-419.
[10]Oltvai Z N,Milliman C L,Korsmeyer S J.Bcl-2 heterodimerizesin vivowith a conserved homolog,Bax,that accelerates programmed cell death[J].Cell,1993,74(4):609-19.
[11]Bilotas M,Baranao R I,Buquet R,et al.Effect of GnRH analogues on apoptosis and expression of Bcl-2,Bax,Fas and FasL proteins in endometrial epithelial cell cultures from patients with endometriosis and controls[J].Hum Reprod,2007,22(3):644-53.
[12]Joseph E K,Levine J D.Caspase signalling in neuropathic and inflammatory pain in the rat[J].Eur J Neurosci,2004,20(11):2896-902.