植物根尖干细胞微环境的遗传调控
2013-12-13徐庞连阳成伟李春鑫袁东柯
徐庞连,阳成伟 ,李春鑫,袁东柯
(华南师范大学生命科学学院,广东省植物发育生物工程重点实验室,广东广州510631)
干细胞是动植物体内具有自我更新和多向分化潜能的细胞群体,它们既可以经过细胞分裂维持自身细胞群的大小,也可以分化成为各种不同的组织细胞,从而形成各种复杂的组织器官[1]. 在各种生物体内,干细胞都集中分布于一个特异的区域受到严格的调控,这个维持干细胞特性的区域叫做干细胞微环境(Stem Sell Niche)[2]. 虽然研究干细胞微环境的调控机制是阐释有机体生长发育的核心问题,由于发育是一个非常复杂的过程,研究者需选择相对简单的模式生物去研究重要结构的发育机制.拟南芥根尖因其结构简单而且细胞固定不动,便成为研究干细胞维持与分化的模式系统[3]. 近年来,通过对拟南芥突变体的研究,植物干细胞领域取得了长足的进展.本文结合作者课题组的研究,对拟南芥根尖干细胞微环境的结构、特化和维持作一全面论述.
1 拟南芥根尖干细胞微环境的结构
植物干细胞定位于根尖分生组织(Root Apical Meristem,RAM)和茎尖分生组织(Shoot Apical Meristem,SAM). 在拟南芥RAM 中(图1),静止中心(Quiescent Center,QC)及其周围的干细胞一起组成根尖干细胞微环境(图1D). QC 周围的干细胞包括:维管干细胞——形成维管组织、皮层/内皮层干细胞——形成皮层与内皮层、根冠干细胞——形成根冠细胞. 简言之,QC 作为组织中心(Organization Centre)维持周围干细胞并保持干细胞的特性,而周围的干细胞根据其位置信息发育成为特定的细胞类型.因此,根尖干细胞微环境是植物根系统产生和生长的基本来源[4].
2 拟南芥根尖干细胞微环境的特化
2.1 根尖干细胞微环境特化的过程
根尖干细胞微环境的定位(Positioning)和特化(Specification)开始于胚胎时期[5].在早期胚胎的发育过程中,合子进行第1 次细胞分裂后产生1个顶细胞和1个基细胞. 顶细胞经过多次分裂发育成为SAM、子叶和下胚轴,而基细胞经过数次横向分裂产生胚轴细胞和胚柄细胞(Suspensor Cell). 在早期球形胚时期,最上层的胚柄细胞特化成胚根原(Hypophysis,图1A).胚根原在晚期球形胚时期完成一次不对称的分裂,形成大小不同的2个细胞:上层较小的透镜型细胞(Smaller Lens-Shaped Apical Cell)会发育为QC;下层的根冠前体细胞(Columella Precursor)会发育为根冠干细胞(Columella Stem Cells,CSCs)和根冠细胞(图1B).在心型胚时期,QC 招募与其直接相邻的细胞成为根尖干细胞,于是形成根尖干细胞微环境(图1C)[2,5-6].
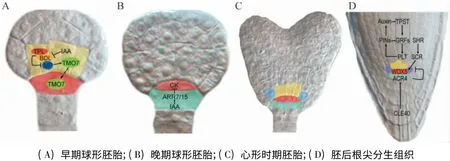
图1 拟南芥根尖干细胞微环境的特化与维持Figure 1 The specification and maintenance of stem cell niche in Arabidopsis roots
2.2 植物激素调控根尖干细胞微环境的特化
植物激素参与调控干细胞微环境的特化.其中,影响干细胞微环境定位的最关键因子是生长素,很多生长素相关的突变体都影响了胚根原的特化进而导致根的生长缺陷. 如功能获得性突变体bdl/iaa12,功能缺失性突变体mp 和tmo7,以及生长素载体缺失突变体等[7-9]. 通过分析这些突变体之间的遗传关系,总结出目前生长素调控胚根原特化的模型:在早期球型胚时期,生长素的最大值定位于胚胎基极.高浓度的生长素与Aux/IAA 蛋白BODENLOS(BDL)结合并促进其发生蛋白酶体介导的降解,然后解除BDL 及其辅阻遏物TPL(TOPLESS)对MP(MONOPTEROS/ARF5)的抑制. MP 作为转录激活子,激活转录因子TMO7(TARGET OF MP 7)的转录,TMO7 从其合成的位置移动到胚柄细胞,介导胚柄细胞特化成为胚根原(图1A). 在这个过程中,PIN1 介导生长素运输到胚柄细胞并达到最高值,也是胚根原的特化所必需的[10].
在晚期球型胚时期,生长素主要分布于下层的根冠前体细胞.高浓度的生长素激活2个A 型反应调节子ARR7/15 表达,从而限定细胞分裂素主要分布在上层较小的透镜型细胞. 于是细胞分裂素介导上层的透镜型细胞特化成为QC(图1B).这表明生长素和细胞分裂素相互作用共同调控根尖干细胞微环境的特化[11].
2.3 转录因子调控根尖干细胞微环境的特化
转录因子也是根尖干细胞微环境特化的主要调节子. AP2/EREBP 类的转录因子PLT1/2 在早期胚胎表达分布于胚胎的基极. plt1 plt2 双突变的胚胎基部出现异常分裂,QC 标记基因在整个胚胎时期都没有表达,而且超表达PLT 基因能够诱导根尖干细胞微环境的异位形成[2,12].这些结果说明PLT1/2在根尖干细胞微环境的特化中扮演关键的角色. 最近研究报道,PLT 通过拮抗HD-ZIP III 转录因子从而调控胚胎基极的特化以及胚根的发育[13-14].除了PLT 通路以外,GRAS 转录因子家族的2个成员SHR 和SCR 也是在胚胎时期就开始表达. 在shr 和scr 突变体中,胚胎基部的皮层/内皮层起始区出现缺陷,导致形成单层的基本组织[15];此外,QC 不能维持其功能,进而导致根尖分生组织的衰竭[16].
综上所述,生长素在PINs 介导的极性运输之下,在胚胎基极积累形成最大值,激活ARF(如MP),并上调PLT 的表达.PLT 途径与SHR/SCR 途径共同调控QC 细胞的形成.QC 周围的细胞同样表达了PLT,从QC 中获得短距离信号,从而特化成为干细胞[2,12].总之,在胚胎发育时期,植物激素和转录因子共同调控根尖干细胞微环境的特化. 而在胚后生长时期,干细胞细胞微环境的维持也需要各种因子的参与才能保证植物胚后的生长发育.
3 拟南芥根尖干细胞微环境的维持
3.1 转录因子对根尖干细胞微环境维持的作用
在哺乳动物中,胚胎干细胞的命运是由Oct4、Nanog 和Sox2 等多能转录因子调节的[17]. 在植物中,通过鉴定拟南芥短根突变体也发现,转录因子调控网络在根尖干细胞微环境的维持中发挥着核心的角色.2 条平行的转录因子途径共同调控植物根尖干细胞微环境的维持(图1D):生长素及其下游的PLT(PLETHORA)基因家族决定其在纵向(Radial)的定位,SHR(SHORT ROOT)/SCR(SCARECROW)途径决定其在横向(longitudinal)的定位[18].
PLT1/2 在RAM 的分布与生长素的最大值位点重叠,主要在QC 及其周围的干细胞区域表达.突变PLT1/2 基因导致RAM 中QC 细胞减少或消失、根冠干细胞出现分化、RAM 活性降低和主根变短;结合上文所述的,plt1plt2 胚胎基部的干细胞微环境出现缺陷.这说明PLT 不但调节根尖干细胞微环境的特化,而且调控根尖干细胞微环境的维持[2]. 此外,PLT 作用于生长素的下游:生长素介导PLT 的表达,生长素输出载体PINs 限定PLT 的表达区域;反过来,PLT 蛋白也调节PIN 的表达以及生长素的极性运输(图1D),揭示了一种精细的反馈调节机制[19].研究[12]发现,PLT 的作用存在剂量效应:高浓度的PLT 与生长素的最大值促进干细胞微环境的形成和维持,低浓度的PLT 促进分生区的细胞分裂,更低的PLT 浓度与分化区的细胞分化有关.这种浓度效应模型可以解析根尖在纵向上相继形成分生区、延长区和分化区.
SHR 在中柱(Stele)表达,其翻译产物通过细胞间的信号传递移动到相邻的细胞层中(包括QC、内皮层/皮层干细胞、内皮层),并激活下游的SCR 进行表达(图1D)[20-21]. 反过来,SCR 蛋白与SHR 蛋白互作,这种互作抑制SHR 蛋白向外层移动,使其只分布在内皮层的细胞核. 反馈调节机制一方面可以解析根尖在辐射方向上形成中柱、内皮层、皮层和表皮,另一方面也巧妙地调控根尖干细胞微环境的横向定位[3].SHR 和SCR 都参与皮层/内皮层干细胞的分裂,所以shr 和scr 突变体都仅有1 层基本组织.有趣的是,突变SHR 和SCR 都导致QC 标记基因的缺失表达和根冠干细胞的异常分化,最终引起RAM 活性降低以及短根等表型. 当SCR 在QC细胞表达时,能够恢复干细胞微环境缺陷等表型.综上可知,SHR 和SCR 是维持根尖干细胞微环境所必需的[16].
此外,作用于SCR 下游的WOX5(WUSCHEL-RELATED HOMEOBOX5)编码1个同源结构域类的转录因子,它在QC 区域专一性地表达(图1D). 突变WOX5 导致根冠干细胞出现分化,而过表达WOX5 则抑制干细胞的分化,这说明WOX5 的功能是维持根尖干细胞并保持正常的干细胞状态.WOX5是WUS(WUSCHEL)的同源基因,WUS 在茎尖组织中心表达,它能激活CLAVATA3 (CLV3)的表达,而CLV3 则限定WUS 的表达区域,从而保持周围干细胞的状态和数量[22]. 在干细胞WOX5 和WUS 的功能的调控中可互换[22],暗示根尖和茎尖干细胞微环境的维持之间可能存在保守的信号调控机制. 最近的研究证实了这种推测,CLV3 的同源基因CLE40在根冠表达,激活下游受体激酶ACR4,限定WOX5在QC 区域特异性表达(图1D),从而限制根尖干细胞的范围与数量[23].
3.2 植物激素对根尖干细胞微环境维持的作用
生长素的极性运输和局部合成促使生长素在QC 部位形成“积累高峰”,对根尖干细胞微环境的特化与维持起着关键的作用[24]. 比如,生长素极性运输抑制剂NPA 处理拟南芥幼苗会影响根尖的生长素积累高峰,从而导致干细胞微环境的维持出现缺陷[25].反过来,激光消融QC 细胞以后,根尖会形成一个新的生长素积累高峰,并在该区域形成一个新的干细胞微环境[26-27].这表明生长素积累高峰和干细胞微环境在功能上存在紧密的联系. 目前已经确定生长素是通过介导PLT 从而控制根尖的干细胞微环境,PLT 表达对生长素的响应迟于其他已知的生长素响应基因,因而推测生长素对PLT 的诱导反应是间接的[1].生长素和PLT 联系机制一直不甚清楚,直到最近RopGEF7 和TPST 被鉴定. RopGEF7编码RAC/ROP 小G 蛋白的活化因子,RNA 干扰下调表达RopGEF7 引起胚胎和胚后PLT 的表达以及根干细胞微环境的缺陷.基因表达分析发现,生长素诱导RopGEF7 的表达,而RopGEF7 又影响生长素极性运输蛋白PIN1 的积累,进而改变生长素在根中的梯度分布和应答. 可见,RopGEF7 与生长素介导的位置信息之间存在一个反馈调节机制,精细地调节PLT 的表达,从而调控根干细胞的特化与维持[28].
TPST 编码1个酪氨酸硫基转移酶,研究表明TPST 和生长素之间也存在精细的反馈调控关系:生长素在转录和蛋白质水平上调控TPST 的表达,突变TPST 则影响生长素在根尖的极性运输、局部合成和浓度梯度分布,从而导致根尖干细胞微环境的缺陷.基因表达分析发现,TPST 的突变导致PLT 在转录和蛋白质表达水平的降低,过表达PLT 则可恢复突变体干细胞微环境的缺陷[29]. 同时,植物分泌的多肽RGFs 也能够恢复tpst-1 突变的表型. 进一步研究发现,RGFs 主要在根尖干细胞区域表达,它们的表达受到生长素的诱导,同时它们也参与限定PLT 的表达区域与表达水平.总之,TPST 介导RGFs发生蛋白质硫基化是生长素和PLT 之间的一个联系纽带(图1D),从而在胚后根尖干细胞微环境的维持中发挥重要作用[29-30].除了多肽信号分子RGFs 外,多肽激素CLE40 提供一种信号抵消来自QC维持周围干细胞保持未分化的信号,促进根冠干细胞的分化,进而保持根尖干细胞在自我更新与分化之间保持平衡[23].
QC 细胞具有延长的G1 期,所以通常处于静止未分裂的状态[1,31]. 但是改变植物激素水平时,QC细胞的有丝分裂活性能够被激活.例如,乙烯能够促进拟南芥QC 细胞发生分裂. 乙烯诱导分裂所形成的细胞能表达QC 特异性报告基因,并且能够抑制周围干细胞的分化[32]. 相反,ABA 抑制拟南芥QC细胞的分裂,而且ABA 调节QC 的分裂是独立于乙烯途径的,与ABI1、ABI2、ABI3、ABI5 和ERA1 有关.同时,ABA 调节WOX5 和MONOPTEROS 的表达,抑制根尖干细胞及其子代细胞的分化,因而促进根尖干细胞微环境的维持.这揭示了ABA 在低浓度条件下促进根生长的机制[33]. 类似地,BRs 也能够促进WOX5 的表达从而控制QC 的特性.BRs 在QC的作用与根尖生长素水平和分布的改变无关,这种调节机制依赖于BRI1 的信号途径,从而抑制根冠干细胞的分化[34]. 在抑制根冠干细胞分化的调控中,生长素通过抑制WOX5 的表达,从而在该进程中也发挥关键的作用[25].
不同植物激素之间拮抗互作,巧妙地调节根尖干细胞微环境的维持. 除了生长素和细胞分裂素的互作在根尖干细胞微环境的特化中起到关键作用以外[11],最近研究揭示了茉莉酸和生长素拮抗互作在根尖干细胞微环境维持中的机制. 茉莉酸处理影响根尖干细胞微环境的结构,包括引起QC 细胞的异常分裂和根冠干细胞的异常分化,最终降低的RAM活性并导致短根的表型. 凝胶阻滞和染色质免疫共沉淀实验表明,茉莉酸信号途径的重要转录因子MYC2 直接结合PLT1/2 的启动子并抑制其表达.总之,茉莉酸通过调控生长素的生物合成、极性运输以及PLT 的表达来调节拟南芥根的发育[35-36].
概而言之,各种植物激素灵活地调节根尖干细胞微环境的维持,并协调根系生长发育的进程.这可能是植物在长期进化过程中形成的对环境的响应机制,有助于植物通过调节干细胞微环境的维持从而适应多变的环境条件. 而且,植物激素之间,以及各种遗传因子是相互影响和相互关联的,共同调控根尖干细胞微环境的维持.
3.3 染色质因子对根尖干细胞微环境维持的作用
染色质的结构会根据结合在染色质上组蛋白的化学修饰方式(如甲基化、乙酰化、磷酸化、泛素化和SUMO 化修饰等)的不同而发生相应的改变,从而决定基因的表达情况以及细胞的最终命运[37].在动物中已经确定,染色质因子以及各种化学修饰可以通过调节染色体的结构影响多能性转录因子的表达,从而调控干细胞在多能性和分化之间的平衡[17].在拟南芥中,最近研究也发现染色质因子和各种翻译后修饰也参与调节根尖干细胞微环境的维持[38].
染色质重塑复合体利用ATP 水解释放的能量去破坏组蛋白和DNA 之间的联系,通过改变DNA的可及性(Accessibility)调节特异性基因或普通转录因子结合到DNA 上,从而激活或抑制基因的表达.拟南芥基因组编码了40 多个染色质重塑复合体的蛋白,这些蛋白可分为3 类:SWI/SNF,ISMI 和CHD[39]. 虽然SWI/SNF 参与调节WUS 的活性和茎尖干细胞的维持[40],目前还不清楚它们是否与根尖干细胞有关.最近报道,CHD3 型的染色质修饰因子PKL (PICKLE)和多梳家族蛋白CLF (CURLY LEAF)拮抗地决定RAM 的活性.多梳家族蛋白CLF介导组蛋白H3 发生三甲基化(H3K27me3)对干细胞标记基因进行修饰,pkl 突变体中干细胞报告基因表达下调伴随着H3K27me3 水平的增加;而其表型表现为pkl 突变体的RAM 活性减少,而clf 突变体的RAM 活性增加.总之,PKL 和CLF 拮抗地调节干细胞标记基因的表达,从而调节RAM 的大小[41].
组蛋白的尾巴从核小体中伸出并且受到不同类型的共价修饰,包括乙酰化、甲基化、磷酸化和泛素化等. 组蛋白乙酰化转移酶GCN5 及其伴侣蛋白ADA2b 功能缺失,影响拟南芥根尖中PLT1/2 的表达和干细胞微环境的维持,说明组蛋白的乙酰化对于维持根尖干细胞微环境是非常重要的[42]. 此外,halted root (hlr)和APC/CCCS52A突变体也通过影响干细胞标记基因的表达来维持QC 细胞和干细胞的特性.其中,HALTED ROOT 编码26S 蛋白酶体的1个亚基,APC/CCCS52A编码的是APC(Anaphase-promoting Complex)泛素连接酶底物特异性的激活子,这暗示泛素化也与干细胞调节因子的稳定表达有关,从而调节干细胞微环境的维持[43-44].
组蛋白分子伴侣在染色质的组装和解体中起着重要作用. CAF-1(Chromatin Assembly Factor-1)和NAP1(Nucleosome Assembly Protein1)是2 类进化保守的组蛋白分子伴侣,分别负责H3/H4 和H2A/H2B 的沉积(deposition),维持染色体处于被抑制的状态[45].拟南芥的CAF-1 是由3个亚基组成的:FASCIATA1(FAS1),FASCIATA2(FAS2)和MULTICOPY SUPPRESSOR OF IRA1(MSI1). fas 突 变 体RAM 出现缺陷,根尖干细胞缺失,SCR 出现异位表达.其中SCR 在同一植物中不连续表达,在不同植物中表达模式也不一样,暗示突变FAS 基因后引起染色质转录抑制的状态出现随机性崩溃[46].作用与SCR 下 游 的RBR(RETINOBLASTOMA- RELATED),与CAF-1 协同地作用,通过抑制多能性转录因子的表达来抑制根尖干细胞的增殖[38,47]. 此外,拟南芥包含有4个编码NAP1 的基因和2个编码NAP1 Related Protein1/2(NRP1 和NRP2)的基因.nrp1-1 nrp2-1 双突变体出现结构混乱的RAM 以及短根的表型.进一步发现NRP1 可以在PLT2 位点上结合到核染色质上,抑制PLT2 的表达[48]. 综上可知,染色质因子一般通过影响染色质活性的变化以及多能性转录因子的表达,在表观遗传层面调控根尖干细胞微环境的维持.
3.4 基因组稳定性对根尖干细胞微环境维持的作用
干细胞在植物整个生命周期中都持续地进行自我更新与分化,从而保证植物的生长与寿命[49]. 意味着干细胞在植物生命周期中会遭受到各种不利环境条件的影响[50]. 目前已确定,很多不利环境条件(UV、高盐、干旱、高低温和重金属等非生物胁迫;病原体、真菌和昆虫等生物胁迫)以及一些正常的细胞代谢产物(活性氧、错误复制的DNA 等),会导致ROS 的快速增加,从而引起基因组的不稳定性[51],因为ROS 能够裂开DNA 产生DSBs (DNA Double-Strand Breaks)[52]. 如果干细胞中的DNA 损伤未能得到有效地修复,突变就会传播给随后产生的细胞和组织,危及植物的正常发育[53].因此,保护植物干细胞的基因组稳定性尤为重要. 全基因组基因表达水平分析发现,DNA 损伤修复和染色质动态相关的基因在拟南芥和玉米的QC 区域大量的富集[54-55],说明保护基因组完整性是植物干细胞的重要特征.
植物因其固着生长不得不长期遭受环境压力的条件,因而进化出高效的“检查点”(Checkpoint)系统去克服遗传毒性. ATM 和ATR 是检查点系统中发挥重要作用的传感器,将DNA 损伤信号传导到下游的激酶WEE1、转录因子SOG1 以及细胞周期调节子等,从而产生应答损伤的细胞反应以防止DNA损伤破坏植物遗传的完整性[56-57].由此引出了一个重要的科学问题:植物干细胞如何应对DNA 损伤?最近,Robert Sablowski 研究组对此进行了开拓性的工作,发现拟南芥干细胞对DNA 损伤剂非常敏感.在能够导致DSBs 的损伤剂处理之下,根尖干细胞及其子代细胞优先地“自杀性”死亡,因此不会让有突变的DNA 传递下去. 干细胞应对DNA 损伤的这种反应位于ATM、ATR 和SOG1 介导的DNA 损伤信号传导的下游[57-58]. 与之相一致的是,最新研究发现一些DNA 修复相关的突变体也出现根尖干细胞死亡的表型.例如,在rad50 和mre11 突变体中,由于NDA 损伤积累引起了干细胞的死亡以及发育上的缺陷[59].类似地,MDO1 (Meristem Disorganization 1)编码1个未知蛋白,通过减少DNA 损伤水平,抑制干细胞的死亡,从而维持干细胞微环境的稳定[60]. 由此可见,植物干细胞微环境的维持需要植物干细胞基因组保持完整性,其分子机制仍需开展进一步研究.本实验室沿着该思路开展工作,已发现SUMO E3 连接酶AtMMS21 在维持根尖干细胞微环境和基因组稳定性中发挥重要的作用(未发表资料).目前尚未报道SUMO 化修饰参与调节植物干细胞维持和DNA 损伤反应,因此,以AtMMS21 为突破口,对其下游靶蛋白和上游调控因子进行鉴定和功能分析,有助于了解SUMO 化修饰调控植物生长发育以及逆境响应的分子机制.
4 展望
通过比较动植物干细胞的细胞学机制及其遗传机制可以看出,动植物干细胞具有一定的相似性,它们都是维持于一个高度调节的微环境中,受到多种转录因子和染色质因子的共同调控. 但是和动物不同的是,植物只能固着生长的特点决定了植物干细胞能够根据复杂的环境条件不断地调整器官发生和发育的进程.因此,植物干细胞是植物生长发育的源泉和信号调控中心. 近年来,通过拟南芥根尖干细胞微环境的研究,发现各种植物激素协调多能性转录因子,灵活地调控干细胞微环境的特化与维持,有利于植物适应多变的环境条件. 面对各种各种环境压力,植物干细胞进化出应答复杂环境条件的机制,以防止未修复的DNA 损伤突变传播给更大范围的植物体内.但目前不清楚机制,原因是基因组稳定性与干细胞维持之间的分子联系很少被鉴定. 基于保护干细胞微环境的基因组稳定性是一个全新的、很多问题没有被研究的领域,所以研究植物干细胞如何应对DNA 损伤,有助于理解植物应对多变环境条件并保持正常生长发育的机制.
此外,植物植物干细胞的研究相对动物干细胞起步较晚,存在很多不清楚的问题有待决. 比如,植物干细胞维持特定基因表达状态的分子和表观机制是怎样?染色质因子和基因组维持因子如何保持干细胞染色质和基因组的特定状态?哪些因子促使植物干细胞保持多能性?利用植物干细胞多能性和多向分化潜能是否可以提高水稻等作物的产量和抗逆性?不同植物干细胞之间以及植物干细胞与分化细胞之间有哪些相似性和差异性?植物干细胞不对称分裂和分化的机理?这些问题的解决将有助于我们理解干细胞微环境的调控机制,甚至为干细胞的研究与应用提供新思路. 因为动物中与干细胞相关的基因容易造成突变致死,而植物中这种情况相对较少.因此,利用模式植物根尖干细胞微环境所具有的优势,通过正反向遗传学大量筛选和鉴定干细胞缺陷突变体,并结合使用高通量的基因组学、生化分子技术以及现代影像技术进行系统研究,将会对了解植物甚至动物干细胞微环境的调控网络有推动作用.
[1]AICHINGER E,KORNET N,FRIEDRICH T,et al.Plant stem cell niches[J]. Annu Rev Plant Biol,2012,63:615-636.
[2]AIDA M,BEIS D,HEIDSTRA R,et al. The PLETHORA genes mediate patterning of the Arabidopsis root stem cell niche[J]. Cell,2004,119(1):109-120.
[3]CUI H,LEVESQUE M P,VERNOUX T,et al. An evolutionarily conserved mechanism delimiting SHR movement defines a single layer of endodermis in plants[J].Science,2007,316(5823):421-425.
[4]BENNETT T,SCHERES B. Root development- two meristems for the price of one?[J]. Curr Top Dev Biol,2010,91:67-102.
[5]WEIGEL D,JURGENS G. Stem cells that make stems[J]. Nature,2002,415(6873):751-754.
[6]PERIS C I,RADEMACHER E H,WEIJERS D. Green beginnings- pattern formation in the early plant embryo[J]. Curr Top Dev Biol,2010,91:1-27.
[7]HAMANN T,BENKOVA E,BAURLE I,et al. The Arabidopsis BODENLOS gene encodes an auxin response protein inhibiting MONOPTEROS-mediated embryo patterning[J]. Genes Dev,2002,16(13):1610-1615.
[8]WEIJERS D,SCHLERETH A,EHRISMANN J S,et al.Auxin triggers transient local signaling for cell specification in Arabidopsis embryogenesis[J]. Dev Cell,2006,10(2):265-270.
[9]HAMANN T,MAYER U,JURGENS G. The auxin-insensitive bodenlos mutation affects primary root formation and apical- basal patterning in the Arabidopsis embryo[J]. Development,1999,126(7):1387-1395.
[10]PERILLI S,DI MAMBRO R,SABATINI S. Growth and development of the root apical meristem[J]. Curr Opin Plant Biol,2011,15(1):17-23.
[11]MULLER B,SHEEN J. Cytokinin and auxin interaction in root stem-cell specification during early embryogenesis[J]. Nature,2008,453(7198):1094-1097.
[12]GALINHA C, HOFHUIS H, LUIJTEN M, et al.PLETHORA proteins as dose-dependent master regulators of Arabidopsis root development[J]. Nature,2007,449(7165):1053-1057.
[13]SMITH Z R,LONG J A. Control of Arabidopsis apicalbasal embryo polarity by antagonistic transcription factors[J]. Nature,2010,464(7287):423-426.
[14]GRIGG S P,GALINHA C,KORNET N,et al. Repression of apical homeobox genes is required for embryonic root development in Arabidopsis[J]. Curr Biol,2009,19(17):1485-1490.
[15]FUKAKI H,WYSOCKA-DILLER J,KATO T,et al.Genetic evidence that the endodermis is essential for shoot gravitropism in Arabidopsis thaliana[J]. Plant J,1998,14(4):425-430.
[16]SABATINI S,HEIDSTRA R,WILDWATER M,et al.SCARECROW is involved in positioning the stem cell niche in the Arabidopsis root meristem[J]. Genes Dev,2003,17(3):354-358.
[17]ORKIN S H,HOCHEDLINGER K. Chromatin connections to pluripotency and cellular reprogramming[J].Cell,2011,145(6):835-850.
[18]DINNENY J R,BENFEY P N. Plant stem cell niches:Standing the test of time[J]. Cell,2008,132(4):553-557.
[19]BLILOU I,XU J,WILDWATER M,et al. The PIN auxin efflux facilitator network controls growth and patterning in Arabidopsis roots[J]. Nature,2005,433(7021):39-44.
[20]HELARIUTTA Y,FUKAKI H,WYSOCKA-DILLER J,et al. The SHORT-ROOT gene controls radial patterning of the Arabidopsis root through radial signaling[J]. Cell,2000,101(5):555-567.
[21]NAKAJIMA K,SENA G,NAWY T,et al. Intercellular movement of the putative transcription factor SHR in root patterning[J]. Nature,2001,413(6853):307-311.
[22]SARKAR A K,LUIJTEN M,MIYASHIMA S,et al. Conserved factors regulate signalling in Arabidopsis thaliana shoot and root stem cell organizers[J]. Nature,2007,446(7137):811-814.
[23]STAHL Y,WINK R H,INGRAM G C,et al. A signaling module controlling the stem cell niche in Arabidopsis root meristems[J]. Curr Biol,2009,19(11):909-914.
[24]PETERSSON S V,JOHANSSON A I,KOWALCZYK M,et al. An auxin gradient and maximum in the Arabidopsis root apex shown by high-resolution cell-specific analysis of IAA distribution and synthesis[J]. Plant Cell,2009,21(6):1659-1668.
[25]DING Z,FRIML J. Auxin regulates distal stem cell differentiation in Arabidopsis roots[J]. Proc Natl Acad Sci USA,2010,107(26):12046-12051.
[26]SENA G,WANG X,LIU H Y,et al. Organ regeneration does not require a functional stem cell niche in plants[J]. Nature,2009,457(7233):1150-1153.
[27]XU J,HOFHUIS H,HEIDSTRA R,et al. A molecular framework for plant regeneration[J]. Science,2006,311(5759):385-388.
[28]CHEN M,LIU H,KONG J,et al. RopGEF7 regulates PLETHORA- dependent maintenance of the root stem cell niche in Arabidopsis[J]. Plant Cell,2011,23(8):2880-2894.
[29]ZHOU W,WEI L,XU J,et al. Arabidopsis tyrosylprotein sulfotransferase acts in the auxin/PLETHORA pathway in regulating postembryonic maintenance of the root stem cell niche[J]. Plant Cell,2010,22(11):3692-3709.
[30]MATSUZAKI Y,OGAWA-OHNISHI M,MORI A,et al. Secreted peptide signals required for maintenance of root stem cell niche in Arabidopsis[J]. Science,2010,329(5995):1065-1067.
[31]SABATINI S,BEIS D,WOLKENFELT H,et al. An auxin-dependent distal organizer of pattern and polarity in the Arabidopsis root[J]. Cell,1999,99(5):463-472.
[32]ORTEGA-MARTINEZ O,PERNAS M,CAROL R J,et al. Ethylene modulates stem cell division in the Arabidopsis thaliana root[J]. Science,2007,317(5837):507-510.
[33]ZHANG H,HAN W,DE SMET I,et al. ABA promotes quiescence of the quiescent centre and suppresses stem cell differentiation in the Arabidopsis primary root meristem[J]. Plant J,2010,64(5):764-774.
[34]GONZALEZ- GARCIA M P,VILARRASA- BLASI J,ZHIPONOVA M,et al. Brassinosteroids control meristem size by promoting cell cycle progression in Arabidopsis roots[J]. Development,2011,138(5):849-859.
[35]CHEN Q,SUN J,ZHAI Q,et al. The basic helix-loop- helix transcription factor MYC2 directly represses PLETHORA expression during jasmonate-mediated modulation of the root stem cell niche in Arabidopsis[J].Plant Cell,2011,23(9):3335-3352.
[36]SUN J,CHEN Q,QI L,et al. Jasmonate modulates endocytosis and plasma membrane accumulation of the Arabidopsis PIN2 protein[J]. New Phytol,2011,191(2):360-375.
[37]ZEE B M,LEVIN R S,DIMAGGIO P A,et al. Global turnover of histone post- translational modifications and variants in human cells[J]. Epigenetics Chromatin,2010,3(1):22.
[38]KORNET N,SCHERES B. Stem cell factors in plants:Chromatin connections[J]. Cold Spring Harb Symp Quant Biol,2008,73:235-242.
[39]SHEN W H,XU L. Chromatin remodeling in stem cell maintenance in Arabidopsis thaliana[J]. Mol Plant,2009,2(4):600-609.
[40]KWON C S,CHEN C,WAGNER D. WUSCHEL is a primary target for transcriptional regulation by SPLAYED in dynamic control of stem cell fate in Arabidopsis[J].Genes Dev,2005,19(8):992-1003.
[41]AICHINGER E,VILLAR C B,DI MAMBRO R,et al.The CHD3 chromatin remodeler PICKLE and polycomb group proteins antagonistically regulate meristem activity in the Arabidopsis root[J]. Plant Cell,2011,23(3):1047-1060.
[42]KORNET N,SCHERES B. Members of the GCN5 histone acetyltransferase complex regulate PLETHORA-mediated root stem cell niche maintenance and transit amplifying cell proliferation in Arabidopsis[J]. Plant Cell,2009,21(4):1070-1079.
[43]UEDA M,MATSUI K,ISHIGURO S,et al. The HALTED ROOT gene encoding the 26S proteasome subunit RPT2a is essential for the maintenance of Arabidopsis meristems[J]. Development,2004,131(9):2101-2111.
[44]VANSTRAELEN M,BALOBAN M,DA INES O,et al.APC/C- CCS52A complexes control meristem maintenance in the Arabidopsis root[J]. Proc Natl Acad Sci USA,2009,106(28):11806-11811.
[45]DE KONING L,CORPET A,HABER J E,et al. Histone chaperones:An escort network regulating histone traffic[J]. Nature Structural & Molecular Biology,2007,14(12):997-1007.
[46]KAYA H,SHIBAHARA K I,TAOKA K I,et al. FASCIATA genes for chromatin assembly factor-1 in arabidopsis maintain the cellular organization of apical meristems[J]. Cell,2001,104(1):131-142.
[47]WILDWATER M,CAMPILHO A,PEREZ- PEREZ J M,et al. The RETINOBLASTOMA- RELATED gene regulates stem cell maintenance in Arabidopsis roots[J].Cell,2005,123(7):1337-1349.
[48]ZHU Y,DONG A,MEYER D,et al. Arabidopsis NRP1 and NRP2 encode histone chaperones and are required for maintaining postembryonic root growth[J]. Plant Cell,2006,18(11):2879-2892.
[49]SCHERES B. Stem-cell niches:Nursery rhymes across kingdoms[J]. Nat Rev Mol Cell Biol,2007,8(5):345-354.
[50]SABLOWSKI R. Plant stem cell niches:From signalling to execution[J]. Curr Opin Plant Biol,2011,14(1):4-9.
[51]KOTCHONI S O,GACHOMO E W. The reactive oxygen species network pathways:An essential prerequisite for perception of pathogen attack and the acquired disease resistance in plants[J]. J Biosci,2006,31(3):389-404.
[52]GECHEV T S,VAN BREUSEGEM F,STONE J M,et al. Reactive oxygen species as signals that modulate plant stress responses and programmed cell death[J]. Bioessays,2006,28(11):1091-1101.
[53]WATERWORTH W M,DRURY G E,BRAY C M,et al. Repairing breaks in the plant genome:the importance of keeping it together[J]. New Phytol,2011,192(4):805-822.
[54]NAWY T,LEE J Y,COLINAS J,et al. Transcriptional profile of the Arabidopsis root quiescent center[J]. Plant Cell,2005,17(7):1908-1925.
[55]JIANG K,ZHU T,DIAO Z,et al. The maize root stem cell niche:A partnership between two sister cell populations[J]. Planta,2010,231(2):411-424.
[56]ADACHI S,MINAMISAWA K,OKUSHIMA Y,et al.Programmed induction of endoreduplication by DNA double-strand breaks in Arabidopsis[J]. Proc Natl Acad Sci USA,2011,108(24):10004-10009.
[57]FURUKAWA T,CURTIS M J,TOMINEY C M,et al. A shared DNA-damage-response pathway for induction of stem-cell death by UVB and by gamma irradiation[J].DNA Repair (Amst),2010,9(9):940-948.
[58]FULCHER N,SABLOWSKI R. Hypersensitivity to DNA damage in plant stem cell niches[J]. Proc Natl Acad Sci USA,2009,106(49):20984-20988.
[59]AMIARD S,CHARBONNEL C,ALLAIN E,et al. Distinct roles of the ATR kinase and the Mre11-Rad50-Nbs1 complex in the maintenance of chromosomal stability in Arabidopsis[J]. Plant Cell,2010,22(9):3020-3033.
[60]HASHIMURA Y,UEGUCHI C. The Arabidopsis MERISTEM DISORGANIZATION 1 gene is required for the maintenance of stem cells through the reduction of DNA damage[J]. Plant J,2011,68(4):657-669.
