维甲酸诱导腭裂发生的过程中对TGF-β/Smad信号途径的抑制作用
2013-12-10刘小转潘新娟
刘小转,潘新娟,张 丽
腭裂是口腔颌面部最常见的先天性畸形之一。引起先天性腭裂发生的原因包括遗传因素和环境因素,约20%腭裂归因于遗传因素, 80%以上原因未知[1]。维甲酸是维生素A的生物活性形式,在生物体的胚胎发育、器官形成,细胞增殖及分化和维持正常生理功能中起重要作用。然而,维甲酸也是一种常见致畸物,过量的维甲酸能导致腭裂的发生[2]。在众多组织中维甲酸可以调控转化生长因子 (transforming growth factor-β, TGF-β)亚型的表达,其中就包括胚胎的组织和细胞[3]。在细胞增殖和分化过程中,维甲酸对TGF-β信号途径的调节作用至关重要[4]。TGF-β超家族是一类具有多种生物学活性的细胞因子, 是一种细胞生长的双向调节因子。有研究显示TGF-β亚型在腭发育过程中具有时空表达的特性[5]。在本次实验中,建立由维甲酸诱导的昆明小鼠腭裂动物模型,并在此基础上用免疫组化的方法检测P-Smad在腭突发育过程中的表达情况,以探讨维甲酸诱导腭裂发生的过程中对TGF-β/Smad信号途径的影响,并分析其可能的致畸机制。
1 材料与方法
1.1实验动物及标本制备选用昆明小鼠(由郑州大学实验动物中心提供),8周龄左右,雌鼠体质量30 g以上,雄鼠体质量35 g以上。雌雄比例为3∶1,前1天晚8时同笼,第2天上午8时检栓。将阴栓阳性的雌鼠记为妊娠0 d(gestation 0 day,GD0)。共得到孕鼠24只,隔离饲养,于GD10 d下午1时,24只孕鼠随机分两组:第1组为对照组,共12只;第2组为实验组,共12只。实验组管饲全反式维甲酸(购于Sigma公司) ,剂量为100 mg/kg,溶于0.2 mL玉米油中;对照组管饲等体积的玉米油。分别于妊娠12、13、14.5、15、15.5、16 d 6个时间点颈椎脱臼处死孕鼠,每组各2只,剖腹取胎鼠,截取胎鼠头部。4%多聚甲醛固定6 h,梯度酒精脱水,头喙部朝下, 常规石蜡包埋,5 μm 连续切片,60℃烤箱置8 h,用于HE染色和免疫组化研究。
1.2实验药品及试剂全反式维甲酸(美国Sigma公司),P-Smad多克隆抗体(美国Chemicon/Upstate公司),免疫组化试剂盒(北京中杉公司),DAB显色试剂盒(北京中杉公司)。
1.3HE染色实验组与对照组包埋的组织标本做HE染色,光镜下观察腭突发育的动态过程。
1.4免疫组化染色采用ABC法,切片脱蜡至水,0.3%H2O2室温下孵育10 min,正常羊血清孵育20 min,滴加兔抗鼠P-smad 2抗体(1∶800), 4℃湿盒过夜,37℃复温1 h,滴加生物素化二抗,37℃孵育30 min,滴加酶结合物,37℃孵育30 min,DAB显微镜下控制显色5~10 min。上述各步之后均用0.01 mol/L PBS振洗3次,每次5 min。用0.01 mol/LPBS缓冲液代替一抗染色的切片作阴性对照,苏木精复染,常规脱水,二甲苯透明,封片。
2 结果
2.1小鼠上腭大体标本的形态观察腭裂畸形在肉眼下较难观察,需借助放大镜或解剖显微镜。镜下可见对照组E16 d小鼠上腭融合完全, 有明显的腭
皱。实验组E16 d小鼠腭裂均为正中裂,全层裂开,两侧腭突及鼻中隔均未相连(见图1)。
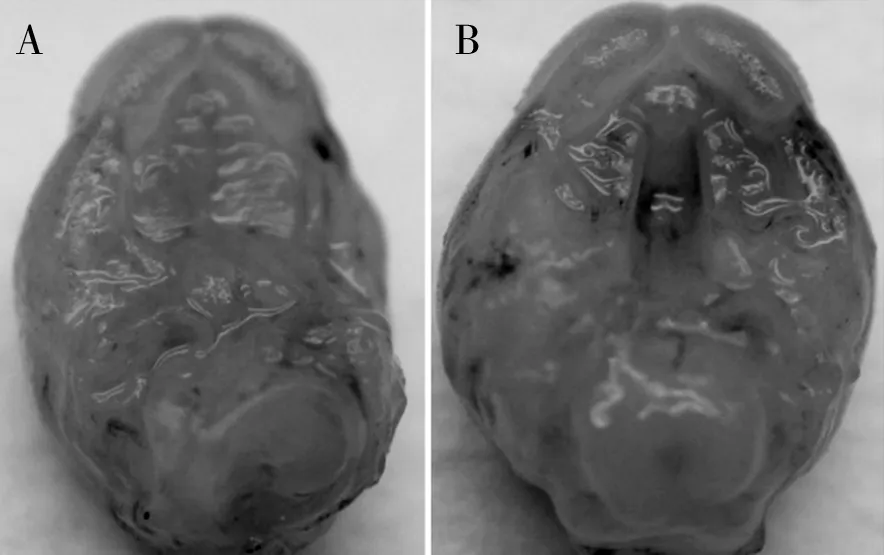
A:对照组,B:实验组
2.2光学显微镜观察小鼠腭部发育的动态变化对照组:E12 d 舌体位置很高,侧腭突刚刚从原始口腔内的上颌突中长出。E13 d舌体位置接近鼻中隔,腭突在舌侧垂直生长。E14.5 d舌体下降,腭突上抬,达到舌体之上,处于水平状态,双侧腭突逐渐接触,形成中缝。E15 d~E15.5 d两侧腭突接触后并融合,中缝逐渐消失。至E16 d所有标本两侧腭突完全融合,腭间质贯通(见图2)。实验组:E12 d~E13 d在腭突的刚长出到垂直生长期,舌体及腭突的位置、形态与对照组无明显差异。E14.5 d当腭突上抬时,出现腭突的上抬延迟。E15 d~E16 d两侧腭突未接触,形态较对照组小,形成腭裂(见图3)。
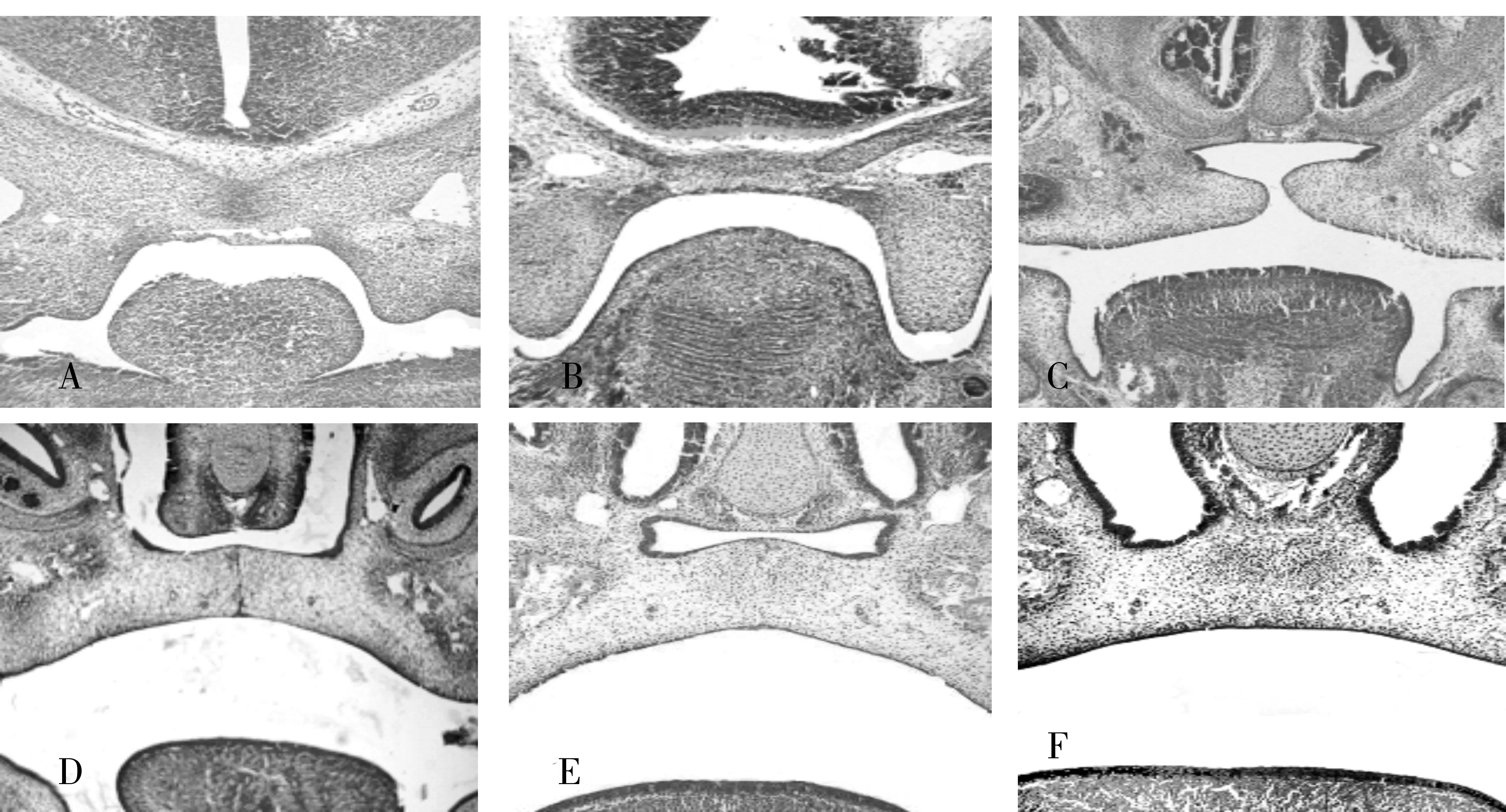
A:E12 d,B: E13 d,C:E14.5 d,D:E15 d,E:E15.5 d,F:E16 d
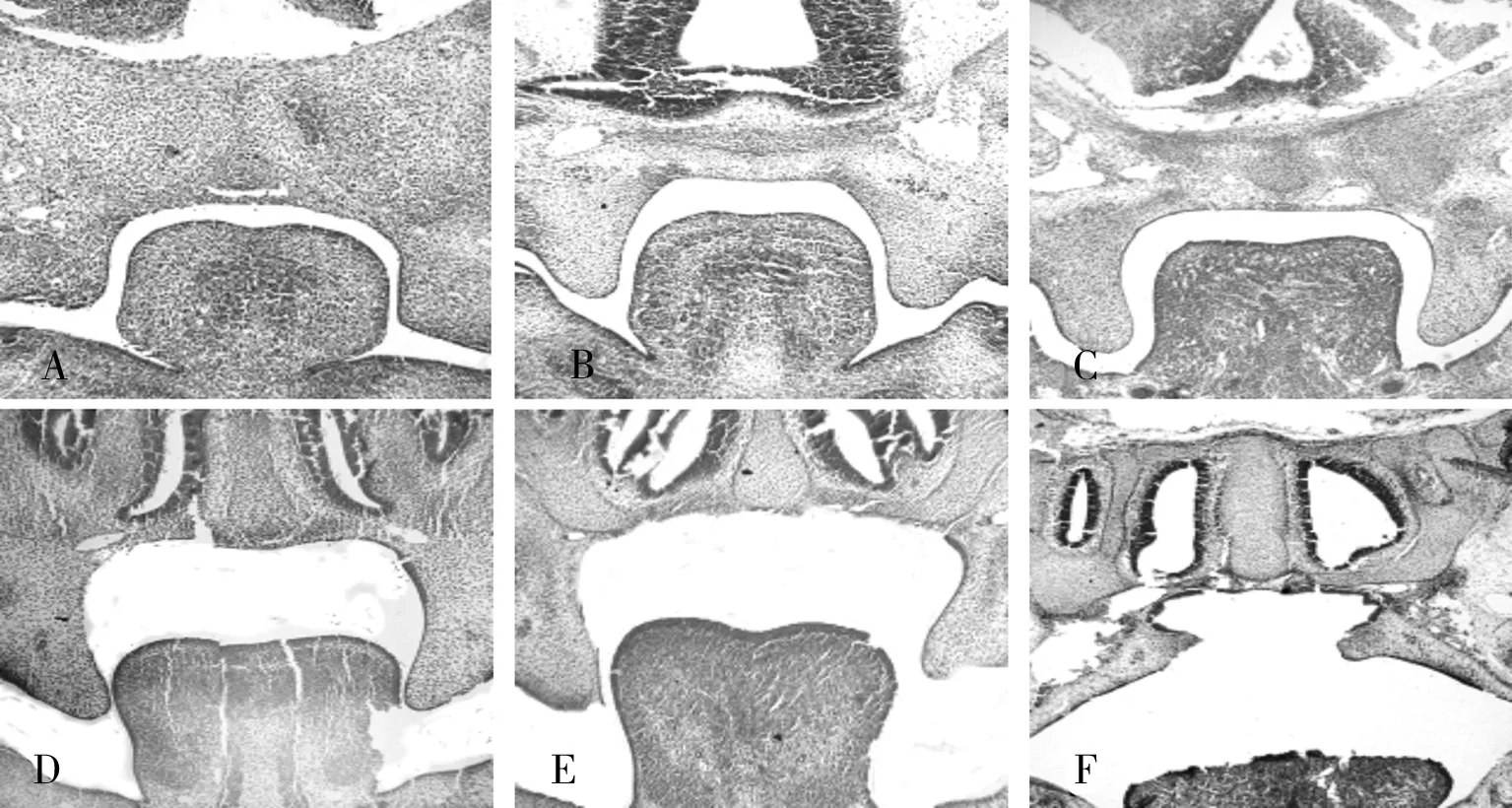
A:E12 d,B: E13 d,C:E14.5 d,D:E15 d,E:E15.5 d,F:E16 d
2.3维甲酸对TGF-β/Smad信号途径的抑制作用对照组:在E12 d~E13 d腭突的刚长出到垂直生长期,腭突上皮内无P-Smad2阳性表达。在E14 d~E14.5 d腭突上抬至水平位置阶段,腭突上皮中出现P-Smad2阳性表达,提示在正常腭发育过程中TGF-β/Smad信号被激活。在垂直生长期和融合后期,腭突上皮内无P-Smad2阳性表达。实验组:自始至终腭突的上皮中均检测不到P-Smad2阳性表达(见图4)。

DAB显色,苏木素复染,棕褐色为阳性
3 讨论
脊椎动物的腭的发育过程是非常相似的。左右腭突移向舌面上方,并逐渐接触,接触处的中嵴上皮组织变厚形成桥粒,把二者连在一起,并形成中嵴上皮缝,这些中缝上皮在组织的连接汇合处进行上皮—间质转化,最终完全融合[6]。腭突中嵴上皮细胞是一种在融合前位于腭突近中线边缘的外胚层细胞,与腭裂发生有着密切的关系。最初的MEE细胞分为两层,当腭突上抬并向水平方向生长后,表层MEE细胞开始脱落,至两侧腭突接触前完全脱去,MEE细胞变为单层细胞[7]。在两侧的上皮发生接触前,细胞的DNA已经停止合成24~36 h,当上皮层的基地细胞暴露时,上皮层内的细胞发生生理性死亡,表面的细胞开始脱落,细胞黏着形成仅含有两层基底细胞的上皮缝,最后发生融合,多数学者认为MEE细胞的最终转归形式包括两种:一是退化或死亡;二是上皮—间质转化。
腭突的融合与中嵴上皮细胞复杂变化紧密相关,由很多生长因子调控,其中包括TGF-β。哺乳动物TGF-β共有3种: TGF-β1、TGF-β2和TGF-β3,这3种亚型均参与腭发育的众多生物过程,例如细胞的迁移、上皮间质间的转化、细胞外基质的合成与沉积、基底膜的退化、细胞的增殖和凋亡[8]等。在腭突融合的过程中,TGF-β及其下游信号分子Smad2/ Smad3具有时空表达的特性。TGF-β家族成员通过激活一系列的丝氨酸酶和苏氨酸酶起作用。一个激活的TGF-β配体由细胞膜锚定的TβRIII递呈给跨膜信号的受体TβRI和TβRII、TβRI和TβRII随后又激活细胞内的Smad蛋白,受体调控的Smad蛋白具有高度的同源性,通过磷酸化激活的Smad2和Smad3与通路中的共调控蛋白Smad4形成一联合体,一起转入细胞核内,在细胞核内调控TGF-β效应基因的转录[9]。
10年前,TGF-β3-/-突变型小鼠腭裂的发生,使人们发现TGF-β3在腭裂发育过程中起着重要的作用[10]。在这些突变体中,腭裂的发生是由两侧腭突的上皮无法融合所导致。不久人们又发现外源性TGF-β3可以促使TGF-β3-/-突变型小鸡上腭的融合,这个过程主要是通过MEE细胞的上皮—间质转化完成的[11]。在腭突融合过程中,Smad2的磷酸化在空间上局限于腭突的中嵴上皮细胞,在时间上也与中嵴上皮的退化、消失密切相关。在TGF-β3-/-突变型胎鼠腭突中嵴上皮中间测不到磷酸化Smad2的表达,然而,如果加入外源性磷酸化Smad2,则可以挽救TGF-β3-/-突变型胎鼠腭裂的发生[12]。另外,Smad2基因敲除小鼠不能形成中胚层,胚胎在原肠胚形成过程中或者形成后就已经死亡[13],因此很难明确地研究Smad2在腭发育过程中的具体作用。然而,Smad3基因敲除小鼠,出生时无明显的缺陷,而且存活良好。由此可见,Smad3在腭发育过程中并不起作用,在功能上可以由Smad2补偿[14]。维甲酸是一种常见致畸物,过量的维甲酸能导致腭裂的发生。本研究结果显示:在腭突融合过程中,维甲酸可以抑制Smad2的磷酸化从而抑制TGFβ/Smad信号途径。由此可以推断,维甲酸诱导腭裂的发生,与中嵴上皮细胞中TGFβ/Smad信号途径的抑制密切相关。
参考文献:
[1] Young DL.Genetic and teratogenic approaches to cranio facial development[J].Crit Rev Oral Biol Med,2000, 11(3):304-317.
[2]Dmetrichuk JM,Spencer GE,Carlone RL.Retinoic acid-dependent attraction of adult spinal cord axons towards regenerating new limb blastemas in vitro[J].Dev Biol,2005,281(1): 112-120.
[3] Frenz DA,Liu W.Treatment with all-trans-retinoic acid decreases levels of endogenous TGF-beta(1) in the mesenchyme of the developing mouse inner ear[J].Teratology,2000,61(4):297-304.
[4]Kawaguchi J,Mee P,Smith AG.Osteogenic and chondrogenic differentiation of embryonic stem cells in response to specific growth factors[J].Bone, 2005, 36(5): 758-69.
[5]Lai L,Bohnsack BL,Niederreither K,Hirsch KK.Retinoic acid regulates endothelial cell proliferation during vasculogenesis [J].Develop, 2003,130(26): 6465-6474.
[6]Griffith CM,Hay ED.Epithelial-mesenchymal transformation during palatal fusion: carboxyfluorescein traces cells at light and electron microscopic levels[J].Development, 1992,116(4):1087-1099.
[7]Sun D,Mc Almon KR,Davies JA,et al.Simultaneous loss of expression of syndecan-1 and E-cadherin in the embryonic palate during epithelial-mesenchymal transformation[J].Dev Biol, 1998, 42(5): 733-736.
[8] Pelton RW, Hogan BL, Miller DA, Moses HL.Differential expression of genes encoding TGFs beta 1, beta 2, and beta3 during murine palate formation [J].Dev Biol, 1990, 141(2):456-460.
[9] Heldin CH, Miyazono K, Dijke P.TGF-beta signaling from cell membrane to nucleus through SMAD proteins[J].Nature,1997,390(6659):465-471.
[10] Koo SH,Cunningham MC,Arabshahi B,et al.The transforming growth factor-beta 3 knock-out mouse:an animal model for cleft palate[J].Plast Reconstr Surg, 2001,108 (4):938-948,949-951.
[11] Sun D,Vanderburg CR,Odierna GS,et al.TGF beta3 promotes transformation of chicken palate medial edge epithelium to mesenchyme in vitro[J].Development, 1998,125(1):95-105.
[12] Cui XM,Shiomi N,Chen J,et al.Overexpression of Smad2 in Tgf-beta3-null mutant mice rescues cleft palate[J].Dev Biol,2005,278(1):193-202.
[13] Nomura M, Li E.Smad2 role in mesoderm formation, left-right patterning and craniofacial development [J].Nature,1998,393(6687):786-790.
[14] Zhu Y,Richardson JA,Parada LF,Graff JM.Smad3 mutant mice develop metastatic colorectal cancer [J].Cell,1998,94(6):703-714.
