乳腺癌间质T细胞亚群与乳腺癌5年生存率相关性的研究
2013-12-10陈登庭邢鲁奇
姚 宇,陈登庭,邢鲁奇,邓 淼
乳腺癌是威胁人类健康的常见恶性肿瘤之一。恶性肿瘤的发生、发展与机体的细胞免疫功能,尤其是T细胞各亚群的数量及其功能状态密切相关[1],近年来很多研究表明调节性T细胞(regulatory T cells ,Tregs)在多种肿瘤的发生、发展、转移过程中发挥免疫抑制作用。本研究采用免疫组化方法检测肿瘤局部T淋巴细胞亚群的表达状况,及其与乳腺癌临床病理特征相关性,探讨其对乳腺癌患者5 a生存率的影响。
1 材料与方法
1.1检测对象选取河南科技大学第一附属医院病理科2001~2006年乳腺浸润性导管癌病例80例,常规术后甲醛固定石蜡包埋。均为女性,年龄29~73岁,平均45.0岁。按2003年美国肿瘤联合会(AJCC)乳腺癌TNM分期标准:Ⅰ期2例,Ⅱ期59例,Ⅲ期16例,Ⅳ期3例;组织学分级:高分化9例,中分化60例,低分化11例;手术病理证实淋巴结转移52例,无淋巴结转移28例;所有患者均进行了术后5 a随访,随访结果:死亡11例,存活69例,5 a生存率为86.3%。所有患者术前均未接受放、化疗,全部标本HE染色后均经两位有经验的病理医师诊断。
1.2检测方法所有标本均经4%甲醛固定,石蜡包埋,连续切片,厚度为4 μm,每例标本切4张,染色时用已知阳性切片作阳性对照,用PBS代替一抗作阴性对照。小鼠抗人CD4单克隆抗体和小鼠抗人CD8单克隆抗体为即用型试剂,(福州迈新生物技术有限公司);兔抗人FoxP3多克隆抗体(博奥森生物技术有限公司生产),染色结果用DAB显色。
1.3结果判定FoxP3:阳性细胞着色定位于胞浆,CD4+和CD8+细胞着色定位于细胞膜,表现为浅黄、棕黄或棕褐色。用双盲半定量法评估其染色,无阳性细胞数为(-),阳性细胞数占肿瘤间质淋巴细胞数<25%为(+),25%~50%为(++),>50%为(+++)。
1.3统计学分析所有数据均用SPSS 11.5 for Windows软件包处理,按不同临床病理指标进行分组,生存率用Kaplan-Meier方法计算;各组间率的比较采用χ2检验;相关分析采用Spearman相关系数检验。
2 结果
2.1乳腺癌间质T细胞亚群与患者5a生存率的相关性用Kaplan-Meier方法计算,Foxp3+Tregs阳性组和阴性组5 a生存率分别为92.5%和83.0%,两者比较无显著性差异(P>0.05);CD4+T细胞阳性组和阴性组5 a生存率分别为73.7%和64.3%,两者比较无显著性差异(P>0.05);CD8+T细胞阳性组和阴性组5 a生存率分别为25.0%和38.8%,两者比较无显著性差异(P>0.05),见表1。
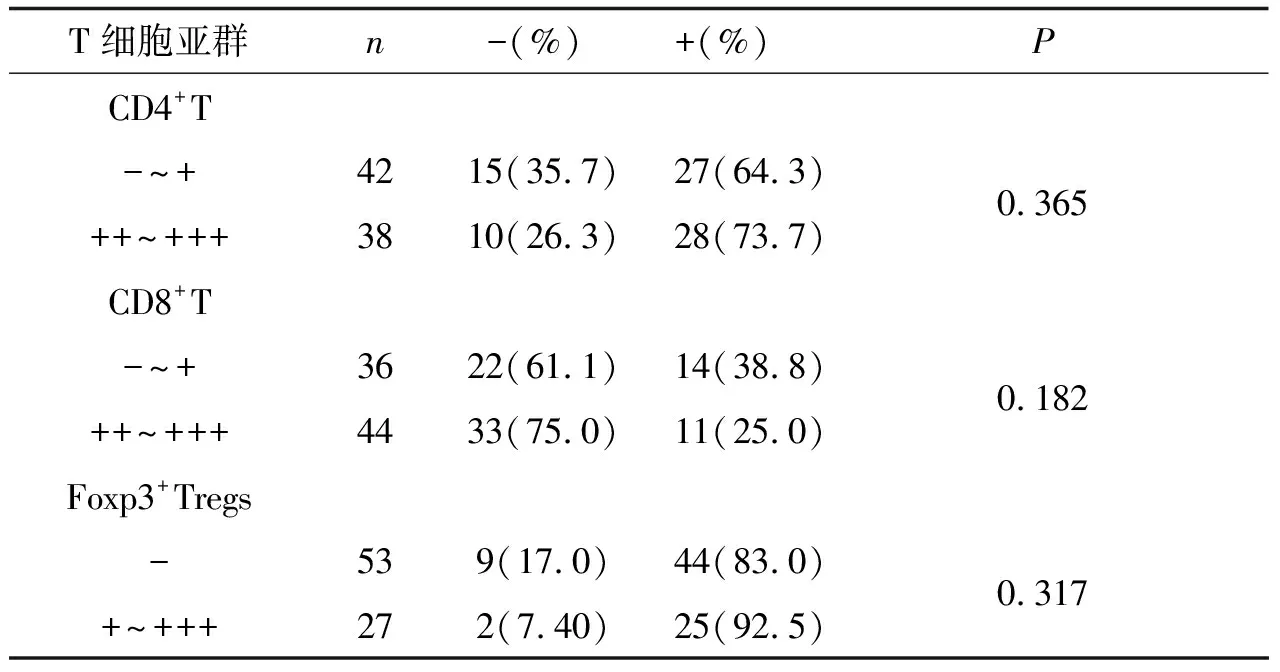
表1 乳腺癌间质T细胞亚群活性与5 a生存率的相关性
2.2乳腺癌间质Foxp3+Tregs浸润与患者临床病理特征的关系乳腺癌间质中Foxp3+Tregs浸润与pTNM分期、组织学分级、淋巴结转移均有显著性差异(P<0.05),与年龄、肿瘤大小无显著性差异(P>0.05),见表2。

表2 乳腺癌间质Foxp3+Tregs的浸润
2.3乳腺癌间质CD4+T细胞浸润与患者临床病理特征的关系乳腺癌间质中CD4+T细胞浸润与pTNM分期、组织学分级、淋巴结转移均有显著性差异(P<0.05),与年龄、肿瘤大小无显著性差异(P>0.05),见表3。
2.4乳腺癌间质CD8+T细胞浸润与患者临床病理特征的关系腺癌间质中CD8+T细胞浸润与pTNM分期、组织学分级均有显著性差异(P<0.05),与淋巴结转移、年龄、肿瘤大小无显著性差异(P>0.05),见表4。

表3 乳腺癌间质CD4+T细胞的浸润

表4 乳腺癌间质CD8+T细胞的浸润
3 讨论
在肿瘤局部微环境中,肿瘤细胞与T细胞相互诱导,相互抑制,若T细胞各亚群之间比例关系及功能出现异常,微环境内免疫功能会受到抑制,最终将导致机体对肿瘤的免疫无能和肿瘤细胞的免疫逃逸[2]。这其中涉及多种调控因素,近几年研究较多的是具有免疫负性调节作用的Tregs,表达在其胞核的叉头翼状螺旋转录因子(forkhead/winged helix transcription factor p3, Foxp3)在2001年由Brunkown等首次报道,目前被认为是Tregs最具特异性的标记物,且其在调节Tregs发育和功能方面起决定性的作用,是T淋巴细胞向免疫抑制功能定向分化的关键因素[3]。
T细胞是机体抵御肿瘤的主要力量,其中CD8+T细胞直接作为效应细胞特异性杀伤癌细胞, CD4+T细胞主要通过分泌细胞因子调节机体抗肿瘤免疫状态,二者皆处于免疫系统与肿瘤相互作用的前沿,若出现异常会直接影响机体抵御肿瘤的能力[4]。本研究发现乳腺癌间质中Foxp3+Tregs的浸润与组织学分化异常程度、pTNM分期及淋巴结转移的程度呈正相关,而CD4+及 CD8+T细胞在乳腺癌间质的浸润与这些临床病理特征呈负相关,但这些肿瘤间质T淋巴细胞的浸润与患者的年龄和肿瘤大小无相关性。可提示乳腺癌间质Foxp3+Tregs可促进淋巴结转移,在患者病情进展过程中发挥积极作用,它的增多可能抑制了在机体免疫系统中发挥重要功能的CD4+和CD8+T细胞,打破肿瘤间质免疫平衡状态,致使肿瘤细胞发生免疫逃逸,从而参与肿瘤的扩散和转移。Liyanage等对胰腺癌肿瘤浸润淋巴细胞和局部淋巴结中Treg细胞研究发现,Treg细胞数量在肿瘤局部显著增多[5]。有研究表明,在卵巢癌患者中发现Treg细胞可抑制CD4+T细胞、CD8+T细胞及NK细胞的抗瘤活性。有学者认为,Foxp3+Tregs可通过多种途径抑制间质T细胞亚群的免疫功能,通过抑制CD4+和CD8+T细胞IL-2基因的转录和表达来抑制T淋巴细胞的活化、增殖[6],亦能通过下调树突状细胞的CD80和CD86共同刺激分子表达、抑制树突状细胞成熟和上调穿孔素和颗粒酶的表达,有选择性地杀伤提呈抗原的B细胞,抑制B细胞的增殖,从而影响抗原的提呈,致使肿瘤局部免疫无能,肿瘤细胞发生免疫逃逸,患者病情加重出现肿瘤扩散甚至转移[7-8]。这些论断与本实验结果相似,提示Foxp3+Tregs在乳腺癌发生、发展的过程中发挥重要作用,可以作为评估患者病情程度的一个参考指标或者是治疗中的一个针对点。本研究还发现,5 a存活阴性组患者的肿瘤间质T淋巴细胞亚群与5 a存活阳性组患者的相比较,差异并无显著性,这提示了虽然乳腺癌间质T淋巴细胞亚群平衡状态的改变使得肿瘤间质出现免疫抑制,造成肿瘤细胞对机体免疫系统的耐受和免疫逃逸,促进肿瘤的浸润进展和淋巴结转移,但与乳腺癌患者5 a生存并无明显相关性。对于这一研究结果,我们可认为,对乳腺癌患者预后有影响的因素有多种,间质T细胞亚群只是对其有重要影响的因素之一,故还需进一步的实验和研究。
近年来,免疫治疗肿瘤已成为医学界关注的热点之一,一些肿瘤浸润淋巴细胞过继免疫治疗和肿瘤疫苗已通过大量实验,但效果并不理想,其中有很多需要解决的问题[9-10]。本研究提示,乳腺癌间质T细胞亚群与肿瘤细胞的相互影响、相互抑制直接关系着患者病情的发展,对间质T细胞亚群的研究,或许可以为对抗恶性肿瘤提供新的途径。
参考文献:
[1]Zltlne HD.Immunology[M].Philadelphia:WB Saunders Co,2001,35(7):129-135.
[2]奚桂林.CD4+CD25+调节性T细胞研究[J].国外医学免疫学分册,2004,27(3):141-145.
[3]Brunkow ME,Jeffery EW,Hjerrild KA,et al.Disruption of a new forkhead/winged-helix protein scurfin results in the lymphoproliferative disorder of the scurfy mouse [J].Nat Genet, 2001, 27(1):68-73.
[4]Beyer M.Regulatory T cells in cancer[J].Blood,2006,,108(3): 804-811.
[5]Nishikawa H,Kato T,Tawara I,et a1.IFN-gamma controls the generation/activation of CD4+CD25+regulatory T cells in antitumor immune response[J].Immune,2005,175(7):4433-4440.
[6]Liyanage Uk,Moore TT,Joo HG,et al.Prevalence of regulatory T cells is increased in peripheral blood and tumor microenviroment of patients with pancreas or breast adenocarcinomal [J].J Immunal,2002,169(5):2756-2761.
[7]Sakaguchi S,Yamaguchi T ,Nomura T,et al.Regulatory T cells and immune tolerance[J].Cell,2008,133:775-787.
[8]Cao X,Cai SF,Fehniger TA,et al .Granzyme B and Perforin Are Important for Regulatory T Cell-Mediated Suppression of Tumor Clearance [J].Immunity , 2007, 27 :635-646.
[9]何生,巴明臣,章崇杰,等.肿瘤浸润淋巴细胞及重组白细胞介素2治疗原发性肝细胞癌[J].中国普通外科杂志,1999,(2):85-88.
[10] Sutmuller RP,Van LM,Duivenvoorde A,et al.Synergism of cytotoxic T Lymphocyte-associated antigen 4 blockade and depletion of CD25+Regulatory T cells in antitumor therapy reveals alternative pathways for suppression of autoreactive cytotoxic T Lymphocyte response [J].J Exp Med,2001,194(6):823-829.
