血管性痴呆大鼠脑血流、行为学和形态学对比及磁共振灌注成像的应用价值
2013-12-10ZHANGLan
张 岚 ZHANG Lan
程敬亮2 CHENG Jingliang
2. 郑州大学第一附属医院磁共振科 河南郑州 450052
血管性痴呆(vascular dementia, VD)是指由各种脑血管疾病引起的智能损害和认知功能障碍的一种综合征,主要表现为学习、记忆、思维等障碍。VD是老年性痴呆的第二位最常见原因,其患病率每5.3年增加1倍,仅次于阿尔茨海默病[1]。在我国,VD的发病率高于阿尔茨海默病,且发病率逐渐增加,给家庭和社会带来沉重的负担[2]。VD的发病机制目前尚不十分明确,但近年研究认为慢性脑低灌注是其主要发生机制之一,脑血流量下降与痴呆的严重程度密切相关[3]。因此,脑血流灌注测定是诊治VD的有效指标,不仅能为VD的早期诊断及早期治疗提供依据,而且对探讨VD的发病机制和病理过程也有着重要作用。
随着MRI技术的发展,磁共振灌注成像(perfusion weighted imaging, PWI)利用快速扫描技术和团注顺磁性对比剂反映对比剂在脑微血管内的血流动力学变化,获取时间-信号强度曲线(TIC)和脑组织微循环参数,从而评价脑组织的血流灌注情况[4]。本研究旨在通过建立一种重复性和稳定性较好、最大程度地模拟人类VD发病机制的动物模型,通过观察其行为学、脑血流灌注及脑组织形态学变化,初步了解VD的病理生理过程,探讨PWI在VD脑血流测定方面的应用价值。
1 材料与方法
1.1 实验动物 36只雄性健康SPF级Wistar大鼠,体重240~280 g,由河南省实验动物中心提供(合格证号:0003703),在河南中医学院实验室动物房分笼喂养,每笼4只,每天给予标准饲料,清洁自来水自由饮用。动物房环境温度22~24℃,相对湿度70%左右,适应性饲养1周后进行实验。
1.2 实验分组 将36只大鼠按体重大小编号,根据随机数字表给每只大鼠一个随机数字,然后按随机数字区间进行分组,分为假手术组、VD模型术后15 d组、30 d组、45 d组,每组9只。术后死亡的大鼠被剔除本研究,并补足相应的大鼠数目。
1.3 实验试剂及仪器 10%水合氯醛(上海富蔗化工有限公司),钆喷替酸葡甲胺注射液(Gd-DTPA,北陆药业股份有限公司,15 ml/支);跳台实验装置(河南省中医药研究院)。
1.4 动物模型制作 参照Ni等[5]的方法,采用永久性结扎双侧颈总动脉的方法制作VD大鼠模型。大鼠术前12 h禁食,4 h禁水,用10%水合氯醛按350 mg/kg腹腔注射麻醉,仰卧固定。颈部剪毛备皮消毒后切开,分离出双侧颈总动脉,用0号丝线双重结扎,术中避免损伤交感神经和迷走神经。假手术组大鼠仅行颈部切开,不结扎双侧颈总动脉,术后正常饲养。在造模过程中保证大鼠自主呼吸,大鼠肛温37℃左右。
1.5 认知功能测试 采用跳台实验检测大鼠的学习和记忆能力。跳台装置为被动回避反应箱,四周用黑色塑料板分隔,箱底为可通电的铜栅,反应箱的右后角放置一个直径和高均为4.5 cm的绝缘橡皮垫,作为大鼠回避电击的安全台。由调压器调节电压提供交流电,电压为40 V。将大鼠放入跳台装置中自由活动3 min,然后接通电源持续5 min,大鼠受电击后其正常反应是跳到安全台躲避电击。记录通电后大鼠跳至安全台所需时间为潜伏期,大鼠跳下安全台的次数为错误次数,潜伏期和错误时间之和为受电击总时间作为学习成绩。24 h后重复上述实验作为记忆成绩。
1.6 脑血流测定 使用Philips Intera Achieva 1.5T超导型MRI仪,C3扁平表面线圈。将大鼠仰卧位固定在检查床上,热水袋保暖,大鼠头部置于表面线圈的中心。以1 ml/s经大鼠股静脉团注Gd-DTPA(0.1 mmol/kg),采用FFE-EPI序列,TR 1200 ms,TE 30 ms,翻转角40°,矩阵128×128,视野6 cm×5 cm,层厚2 mm,层间距0.2 mm,采集次数2次。选取4个层面,每个层面获取50幅连续图像,共得到200幅原始图像。
在Philips Perfusion Analysis Tool工作站进行图像后处理,描绘出TIC。局部脑血容量(regional cerebral blood volume, rCBV)值在rCBV图上通过划定感兴趣区(ROI)求其信号强度平均值获得,同样获得局部脑血流量(regional cerebral blood fl ow, rCBF)值。按照Kluytmans等[6]的方法,在rCBV、rCBF图上的额叶皮质、海马区、小脑半球划定相同大小的ROI,将额叶皮质、海马区与小脑半球的rCBV、rCBF值相比取其比值,代表相应区域的血流灌注程度。
1.7 病理检查 各组大鼠在跳台实验和脑血流测定完成后断头取脑组织,用10%中性甲醛固定24 h,50%~100%乙醇梯度脱水,二甲苯透明,石蜡包埋,制成5 μm切片,行HE染色及Nissl甲苯胺蓝染色,中性树胶封片,光学显微镜下观察。
1.8 统计学方法 采用SPSS 12.0软件,计量资料组间比较采用单因素方差分析,两两比较采用SNK-q检验,P<0.05表示差异有统计学意义。
2 结果
2.1 一般状况观察 术后大鼠出现运动减少,行动迟缓,反应迟钝,眼睑下垂,眼裂变小,饮食减少。持续3~5 d后大鼠进食、精神、反应逐渐恢复正常。
2.2 行为学观测结果 与假手术组相比,VD模型各组大鼠的学习和记忆能力明显降低,学习成绩中,VD模型30 d组、45 d组大鼠潜伏期及受电击总时间延长,错误次数增多,与假手术组比较,差异有统计学意义(F=28.968、16.773、15.184, P<0.05);记忆成绩中,VD模型15 d组、30 d组、45 d组大鼠潜伏期、错误次数及受电击总时间显著增加,与假手术组比较,差异有统计学意义(F=39.884、24.957、31.216,P<0.05)。学习和记忆成绩中,VD模型30 d组、45 d组大鼠潜伏期、错误次数及受电击总时间与VD模型15 d组比较,差异有统计学意义(P<0.05),且45 d组大鼠学习期的潜伏期较30 d组增加,记忆期的潜伏期和受电击总时间较30 d组明显延长,差异有统计学意义(P<0.05),提示各VD模型各组大鼠的学习和记忆能力随着术后时间的延长,损害加重。各组大鼠跳台实验学习成绩和记忆成绩见表1。
2.3 血流灌注测定结果 VD模型15 d组、30 d组、45 d组大鼠额叶皮质与海马区rCBV比值和rCBF比值较假手术组降低,差异有统计学意义(F=4.533、4.476,F=4.714、6.790, P<0.05),见表 2 和图 1、2。
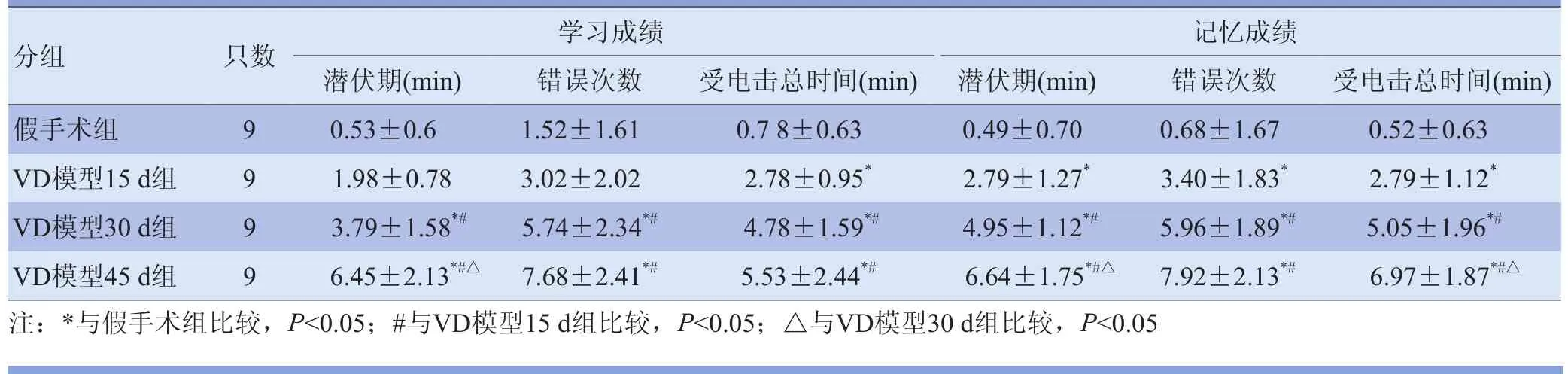
表1 各组大鼠跳台实验学习成绩和记忆成绩比较
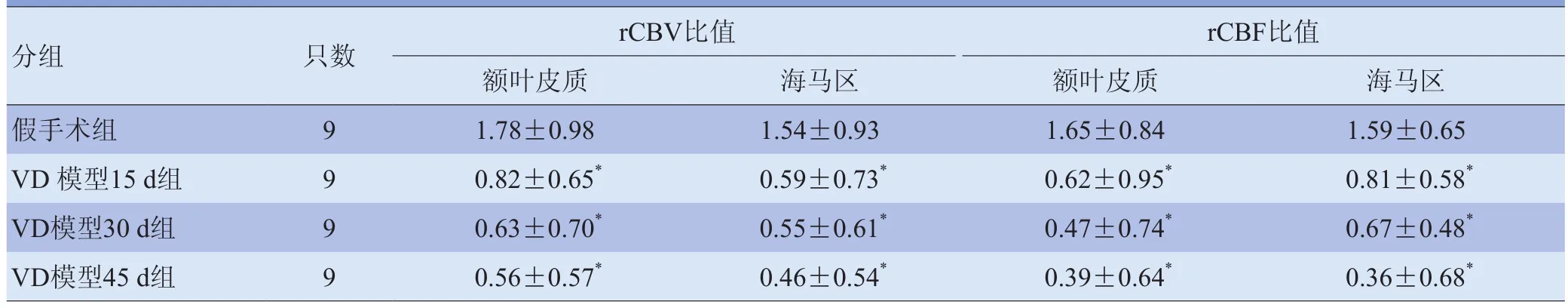
表2 各组大鼠额叶皮质和海马区rCBV比值和rCBF比值比较
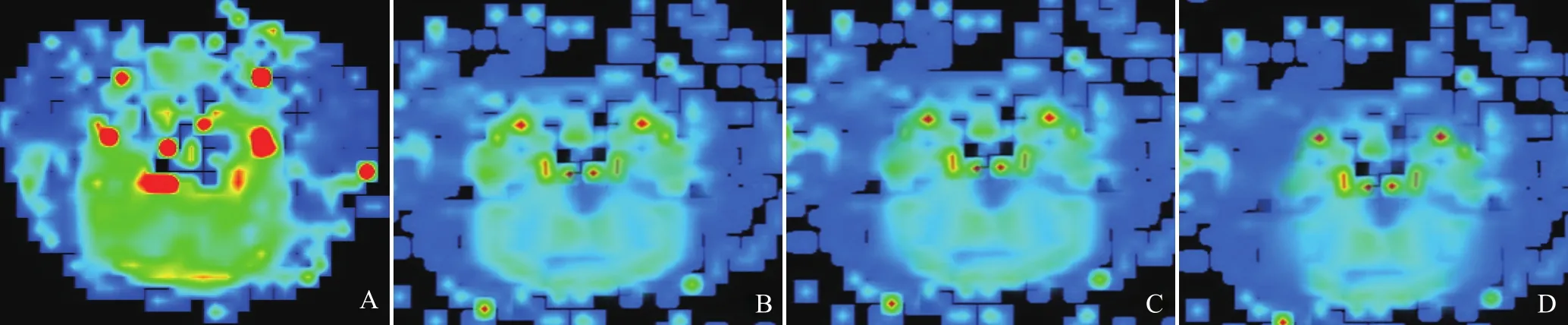
图1 各组大鼠脑rCBV图。A~D依次为假手术组、VD模型15 d组、30 d组、45 d组。rCBV图上黄色代表高血流灌注区域,黄色越浅说明血供越差,蓝色代表低血流灌注区。VD模型15 d组、30 d组、45 d组与假手术组相比额叶、颞叶黄色区越来越浅淡,蓝色区越来越明显
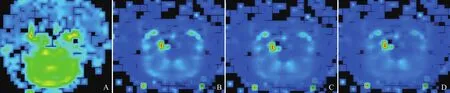
图2 各组大鼠脑rCBF图。A~D依次为假手术组、VD模型15 d组、30 d组、45 d组。rCBF图上黄色代表高血流灌注区域,黄色越浅说明血供越差,蓝色代表低血流灌注区。VD模型15 d组、30 d组、45 d组与假手术组相比额叶、颞叶黄色区越来越浅淡,蓝色区越来越明显
2.4 TIC 由图3可见,各VD模型组与假手术组比较,主波峰所对应的时间段基本一致,随着术后时间的延长,曲线主波峰的幅度越来越低平、短小,且基线恢复缓慢。
2.5 病理组织学观察 假手术组大鼠脑组织镜下见皮层锥体细胞形态、结构正常;海马锥体细胞排列整齐密集,核仁清晰,Nissl染色见胞质内尼氏小体丰富。VD模型15 d组镜下见皮层变薄,部分锥体细胞变性;海马CA1区锥体细胞层次减少,排列稀疏,胞质内尼氏小体减少,有核固缩改变。VD模型30 d组镜下见皮层锥体细胞变性,脱失;海马CA1区锥体细胞变性,胞质内尼氏小体进一步减少,细胞核固缩为三角形或多角形。VD模型45 d组镜下见皮层锥体细胞变性、脱失现象显著。海马CA1区锥体细胞大部分变性、脱失,胞质内尼氏小体大部分消失。见图4~6。
3 讨论
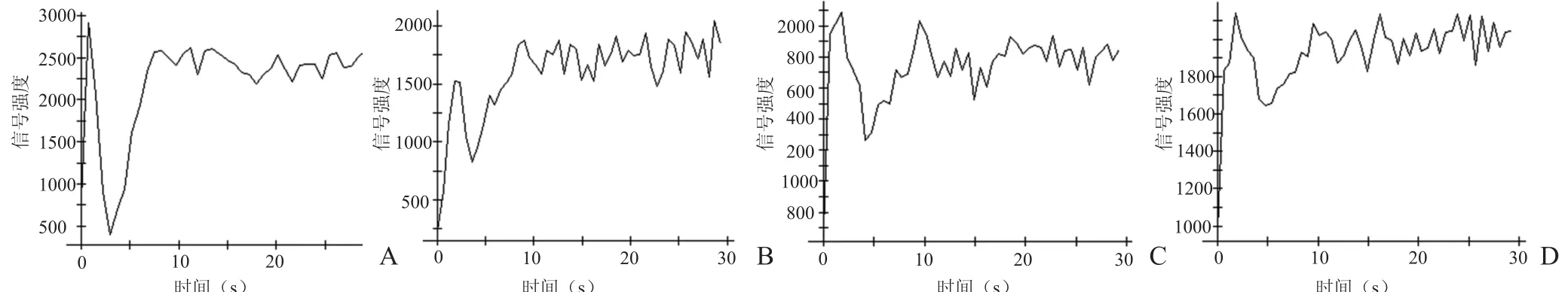
图3 假手术组及各VD模型组TIC。A~D依次为假手术组、VD模型15 d组、30 d组、45 d组
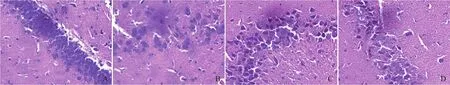
图4 各组大鼠海马病理组织学改变(HE, ×400)。A.假手术组大鼠海马锥体细胞排列整齐密集,层次丰富,核仁清晰,胞质丰富;B.VD模型15 d组海马CA1区锥体细胞层次减少,排列稀疏,有核固缩改变;C. VD模型30 d组海马CA1区锥体细胞排列稀疏,细胞核固缩明显;D. VD模型45 d组海马CA1区锥体细胞大部分变性、脱失

图5 各组大鼠海马病理组织学改变(Nissl, ×400)。A.假手术组大鼠海马锥体细胞胞质内尼氏小体丰富,排列整齐;B. VD模型15 d组胞质内尼氏小体减少,细胞核缩小,结构不清;C. VD模型30 d组胞质内尼氏小体进一步减少、消失;D. VD模型45 d组胞质内尼氏小体大部分消失
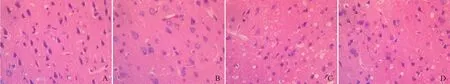
图6 各组大鼠额叶皮层病理组织学改变(HE, ×400)。A.假手术组大鼠额叶皮层锥体细胞形态、结构正常;B. VD模型15 d组皮层变薄,部分锥体细胞出现核固缩;C. VD模型30 d组皮层锥体细胞变性,出现细胞脱失现象;D. VD模型45 d组皮层锥体细胞固缩,脱失现象明显
VD是指各种脑血管疾病引起的获得性智能损害综合征。迄今为止对VD的发病机制尚不明确。既往研究认为大多数VD是由脑梗死所致。近年来,脑血流慢性持续性下降在VD发病机制中的作用逐渐受到关注,脑血流灌注及代谢测定是诊治VD的有效指标。许多VD患者在出现痴呆症状之前,局灶性的低灌注和低代谢已经存在,主要表现为以额叶、颞叶为中心的脑血流量下降,而且VD的痴呆程度与脑血流量和代谢率下降呈正相关,脑血流灌注下降越低,认知功能障碍越明显,提示脑血流量储备功能降低是VD发生的主要原因[7]。因此,建立一种接近于临床上VD患者发病过程的动物模型对于研究VD的发病机制、病理生理学特点以及VD临床的早期防治均有重要价值。双侧颈总动脉永久性结扎方法制备VD动物模型逐渐得到广泛应用。经DSA证实,此方法制作的VD模型,大鼠具有完整的Willis环,通过侧支循环代偿,造成稳定的不完全性前脑缺血,脑的幕上部分血流优先减少,而脑干灌注良好,维持生命中枢的基本功能,更接近慢性脑灌注不足时脑组织的病理生理演变过程[8]。
本实验选取跳台实验评价大鼠的学习和记忆能力。跳台实验所检测的是大鼠在多次训练中学会寻找安全台躲避,形成稳定的空间位置认知,所形成的记忆是空间参考记忆。空间参考记忆是学习记忆的重要方面,也是判断神经系统功能的重要依据[9]。从信息的加工和提取方式来看,这种空间参考记忆属于陈述性记忆,其储存的机制主要涉及边缘系统和额叶、颞叶等大脑皮层。而临床VD患者正是陈述性记忆首先受损而且比较突出。研究报道,双侧颈总动脉结扎后,大鼠出现额叶、海马等脑血流下降,伴随大鼠的认知功能障碍,且进行性加重[10]。本实验结果发现,双侧颈总动脉结扎后15 d大鼠出现学习记忆障碍,且随着缺血时间的延长逐渐加重,大鼠的学习和记忆能力持续降低,45 d时学习和记忆能力下降最为显著,提示此模型诱导的慢性持续性脑血流灌注不足可以导致进行性和长期的学习和记忆功能障碍。
Tanaka等[11]研究发现,大鼠双侧颈总动脉结扎术后6周额叶皮层rCBF较对照组减少49%。本实验结果发现,造模术后15 d时大鼠额叶皮质、海马区rCBF比值即减少,随着缺血时间的延长,rCBF持续降低,术后45 d时大鼠海马区的rCBF下降最为显著。因此,痴呆的程度与额叶、颞叶皮质的rCBF灌注有关。rCBV减少反映单位质量的脑组织内血容量的减少,rCBV下降反映了血流灌注减低,是最直观的指标[12]。本实验中,VD模型30 d组、45 d组大鼠额叶皮质与海马rCBV持续下降,提示rCBV降低也与认知功能障碍密切相关。TIC显示,随着缺血时间的延长,曲线波幅越来越低平、短小,且基线恢复缓慢,提示VD模型各组的局部组织信号下降程度越来越小,即局部组织的血流灌注程度越来越低,血流灌注下降越来越显著。
韩彦青等[13]采用简易智能状态量表(MMSE)评分与脑血流对比研究发现,血流灌注减低与MMSE评分呈正相关,提示VD脑血流的降低与智能活动关系密切。慢性低灌注状态的持续存在损伤与智能有关的神经纤维和神经核团,导致VD的发生和发展,说明脑血流量减少和降低在痴呆的发生及发展中起到重要作用。PWI作为一种简便易行的脑血流灌注的测定方法,对VD患者的脑血流进行动态观察和监测,以额叶、颞叶的血流灌注降低作为敏感指标,预测及早期发现VD,为VD病情的评估提供客观依据,对于预防VD的发生、延缓其进展具有重要意义。
学习和记忆能力与大脑皮层和海马密切相关,而大脑皮层与海马CA1区最易受到缺血缺氧损伤[14]。因此,本实验中同步观察额叶、海马区的病理组织学变化,随着缺血时间的延长,锥体细胞变性、坏死、脱失的病理改变逐渐加重,海马锥体细胞层变薄,细胞核固缩更加明显,胞质内尼氏小体逐渐消失。通过跳台实验证实大鼠出现进行性认知功能障碍,且与额叶皮质及海马区的神经元细胞慢性进行性变性、脱失有关,且这种改变与慢性持续性脑血流量下降密切相关。
总之,慢性持续性脑血流下降是引起VD的重要原因之一,额叶皮质和海马神经元细胞慢性进行性变性是VD的病理基础。PWI能较好地反映VD的脑血流变化。
[1] Gorelick PB, Scuteri A, Black SE, et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke, 2011, 42(9): 2672-2713.
[2] Philip MW, Bath PR. Hemostasis and vascular dementia.Arterioscler Thromb Vasc Biol, 2010, 30: 461-463.
[3] Román GC. Brain hypoperfusion: a critical factor in vascular dementia. Neurol Res, 2004, 26(5): 454-458.
[4] Dai JP, Shen HC, Li SW. MR pulse sequences in the central nervous system: part II. Clin J Magn Reson Imaging, 2010,1(4): 305-310.
[5] Ni J, Ohta H, Matsumoto K, et al. Progressive cognitive impairment following chronic cerebral hypoperfusion induced by permanent occlusion of bilateral carotid arteries in rats.Brain Res, 1994, 653(1-2): 231-236.
[6] Kluytmans M, van der Grond J, van Everdingen KJ, et al.Cerebral hemodynamics in relation to patterns of collateral fl ow. Stroke, 1999, 30(7): 1432-1439.
[7] Cao X, Guo Q, Zhao Q, et al. The neuropsychological characteristics and regional cerebral blood flow of vascular cognitive impairment-no dementia. Int J Geriatr Psychiatry,2010, 25(11): 1168-1176.
[8] Farkas E, Luiten PG, Bari F. Permanent, bilateral common carotid artery occlusion in the rat: a model for chronic cerebral hypoperfusion-related neurodegenerative diseases. Brain Res Rev, 2007, 54(1): 162-180.
[9] McNab F, Klingberg T. Prefrontal cortex and basal ganglia control access to working memory. Nat Neurosci, 2008, 11(1):103-107.
[10] Cada A, de la Torre JC, Gonzalez-Lima F. Chronic cerebrovascular ischemia in aged rats: effects on brain metabolic capacity and behavior. Neurobiol Aging, 2000,21(2): 225-233.
[11] Tanaka K, Ogawa N, Asanuma M, et al. Relationship between cholinergic dysfunction and discrimination learning disabilities in Wistar rats following chronic cerebral hypoperfusion. Brain Res, 1996, 729(1): 55-65.
[12] Yang DW, Kim BS, Park JK, et al. Analysis of cerebral blood flow of subcortical vascular dementia with single photon emission computed tomography: adaptation of statistical parametric mapping. J Neurol Sci, 2002, 203-204: 199-205.
[13] 韩彦青, 梅元武, 李光来. 血管性轻度认知障碍及非痴呆性血管性认知障碍患者局部脑血流量的临床研究. 山西医科大学学报, 2009, 40(3): 271-274.
[14] Wais PE, Wixted JT, Hopkins RO, et al. The hippocampus supports both the recollection and the familiarity components of recognition memory. Neuron, 2006, 49(3): 459-466.
