胃间质瘤与原发性胃淋巴瘤的CT征象及鉴别诊断
2013-12-10LIUTao
刘 涛 LIU Tao
杨存保1 YANG Cunbao
李景雷2 LI Jinglei
2. 广东省人民医院放射科,广东省医学科学院 广东广州 510080
胃间质瘤(gastric stromal tumor, GST)和原发性胃淋巴瘤(primary gastric lymphoma, PGL)是胃部常见肿瘤,发病率仅次于胃癌。GST属于间叶源性肿瘤,独立起源于胃壁、具有非定向分化特征[1];而PGL是原发于胃黏膜固有层和黏膜下层的淋巴组织[2]。GST与PGL的组织起源、病理改变、治疗方式、预后均不相同;术前明确诊断对于患者治疗方案的选择及预后有重要意义。随着多层螺旋CT的广泛应用,CT已经成为胃部肿瘤术前诊断及分期必不可少的检查手段之一,对GST和PGL的诊断及鉴别诊断具有极高的价值[3,4]。本研究对比分析GST与PGL的CT影像表现,以提高对两者的诊断及鉴别诊断。
1 资料与方法
1.1 研究对象 收集2009-12~2012-06广东省人民医院和深圳市龙岗区人民医院经病理证实的26例GST患者和21例PGL患者,GST患者中男14例,女12例;年龄25~82岁,平均(57±16)岁;临床表现:腹痛、腹胀、腹部不适16例,恶心、呕吐呕血、反酸、嗳气3例,纳差、消瘦、黑便7例,上腹部包块4例。PGL患者中,男15例,女6例;年龄27~76岁,平均(58±12)岁;临床表现:腹痛、腹胀、腹部不适10例,恶心、呕吐、反酸、嗳气7例,纳差、消瘦、黑便4例,上腹部包块2例。
1.2 仪器与方法 采用GE 64层或8层螺旋CT机(广东省人民医院)或Siemens Somatom 4层螺旋CT机(深圳市龙岗区人民医院)行上腹部(自膈顶至肾门水平)或全腹(自膈顶至髋臼水平)CT平扫和三期增强扫描。扫描参数:管电压125 kV,管电流100~500 mA(噪声指数为8,电流自动调节),重组层厚及间隔1.25 mm,准直器宽 4×0.625 mm、8×0.625 mm 或 64×0.625 mm,视野33 cm。用高压注射器经手背静脉注射非离子型对比剂碘帕醇注射液(300 mgI/ml,上海博莱科信谊药业有限责任公司)90 ml,生理盐水30 ml,流速3.5 ml/s,分别于注射对比剂后25 s、70 s、180 s行肝动脉期、门静脉期和延迟期扫描。检查前患者常规禁食12 h,扫描前 30 min 饮水 500~800 ml。
1.3 图像分析 图像传至GE ADW 4.3工作站或Somatom螺旋CT配备软件进行分析,观察病变部位、数目、范围、与邻近胃壁的关系、密度、强化特征、黏膜及浆膜情况、胃周淋巴结及是否伴有肝脏、脾脏受侵犯。
1.4 统计学方法 采用SPSS 13.0软件,GST与PGL发病部位比较采用Mann-Whitney U检验,两组CT值比较采用成组t检验,胃周淋巴结肿大情况比较采用χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 病变部位及数目 本组26例GST及21例PGL均为单发;GST全部病变局限,仅累及1个部位,位于胃底和胃体部(图1、2);PGL病变范围广,胃体和胃窦部多见,累及2个或3个部位19例(图3);GST与PGL发病部位间差异有统计学意义(Z=4.090,P<0.05),见表 1。
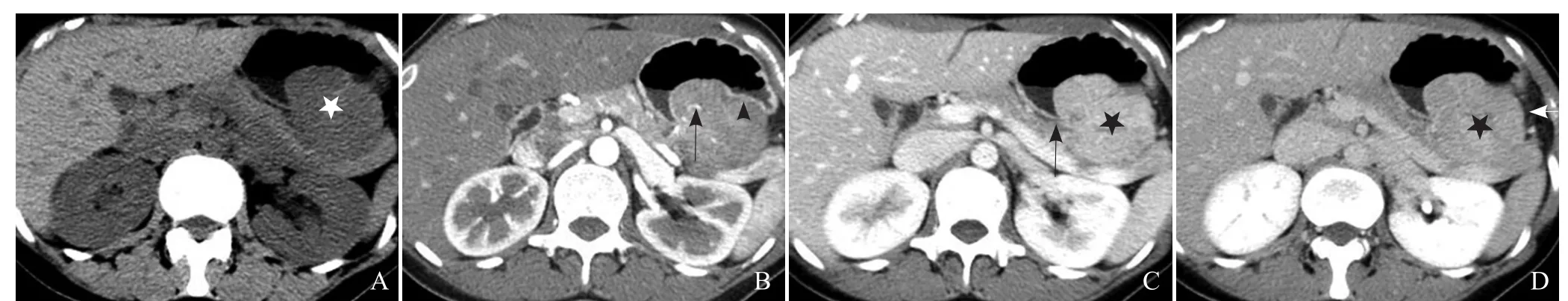
图1 患者女,58岁,胃间质瘤。A.平扫示胃体部后壁稍低密度软组织肿块(星号)、向腔外生长,大小约44 mm×51 mm;B.动脉期示肿块不均匀明显强化,并见粗大的肿瘤血管(箭),黏膜线连续完整(箭头);C.门静脉期示肿块明显强化(星号),与正常胃壁界限清(箭);D.延迟期示肿块明显延迟强化(星号),浆膜层光滑(箭),胃周无肿大淋巴结
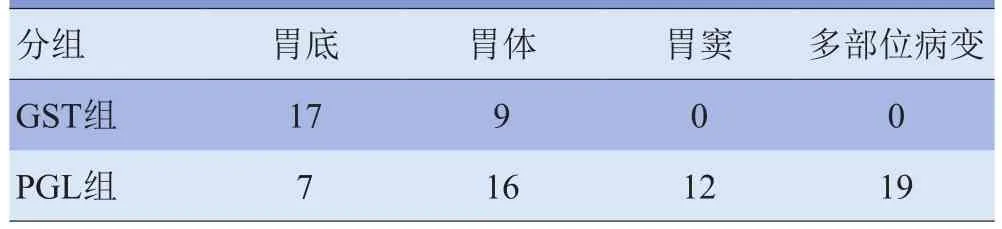
表1 GST与PGL发病部位比较
2.2 病变形态、大小及与邻近胃壁的关系 6例GST患者均为胃壁局限性肿块,11例呈圆形或类圆形,11例呈椭圆形,4例呈不规则形;病变突入胃腔内11例(图2),向胃腔外生长10例(图1),同时向胃腔内外生长5例;病灶大小约16~141 mm,其中小病灶呈圆形、类圆形或椭圆形,大病灶多为不规则形;病变与邻近胃壁界限清。21例PGL患者均为胃壁不同程度的弥漫性匍匐样增厚(图3),最厚处胃壁厚约8~62 mm;病变最大层面相当于同层胃壁的20%~100%,平均(48±17)%;其中弥漫胃壁增厚(胃壁全周的50%以上受侵)10例(47.6%),节段性胃壁增厚(胃壁受侵范围为胃壁全周的25%~50%)9例(42.9%),局限性胃壁增厚(胃壁受侵范围小于胃壁全周的25%)2例(9.5%);病变与邻近胃壁界限不清或相延续。
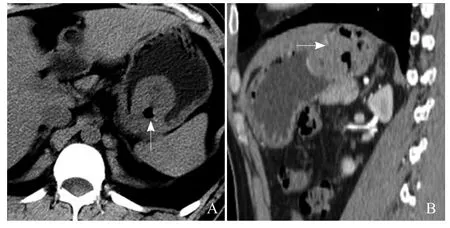
图2 患者男,39岁,胃间质瘤。A.平扫示胃底部向胃腔内突入大小约45 mm×35 mm稍低密度软组织肿块,见溃疡形成(箭);B.增强扫描动脉期矢状位重组示不均匀强化,并见粗大的肿瘤血管(箭),与邻近胃壁界限清晰
2.3 CT平扫密度 CT平扫示26例GST病灶为均匀等或稍低密度,或不均匀等低混杂密度,其中伴坏死4例,伴斑点状、条片状钙化5例;实性部分CT值为16~ 50 Hu,平均(32±11)Hu。PGL病变均呈均匀等密度(图3A),CT值为43~65 Hu,平均(52±9)Hu。两组平扫CT值比较,差异有统计学意义(t=12.37, P<0.05)。
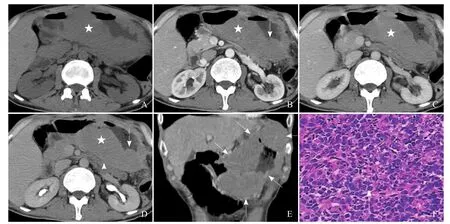
图3 患者男,52岁,弥漫性大B细胞性淋巴瘤。A.平扫示胃底、胃体、胃窦部胃壁广泛的、不同程度的增厚,呈均匀等密度(星号);B.动脉期示增厚胃壁轻度均匀强化(星号),黏膜线连续(箭);C.门静脉期示增厚胃壁中度均匀强化(星号),胃周无肿大淋巴结;D.延迟期示增厚胃壁中度均匀强化(星号),黏膜线连续(箭),浆膜层尚光滑(箭头);E.冠状位重组示胃底、胃体、胃窦部胃壁广泛的不同程度的增厚(箭);F.病理镜下示弥漫成片排列的肿瘤细胞(箭),瘤细胞核呈卵圆形或略不规整,可见核分裂(HE, ×400)
2.4 病变强化特征 26例GST中,动脉期、门静脉期、延迟期病灶均呈均匀强化16例,不均匀明显强化10例,其中动脉期见粗大的肿瘤血管7例;动脉期、门静脉期、延迟期大部分或全部实性病变呈延迟强化(图1B~D),动脉期平均CT值约为(69±23)Hu,门静脉期平均CT值约为(88±32)Hu,延迟期平均CT值约为(93±27)Hu。21例PGL病灶动脉期、门静脉期、延迟期均呈轻度均匀强化,强化程度类似于周围肌肉组织[CT值为(62±15)Hu](图3B~D)。GST与PGL门静脉期病变CT值比较,差异有统计学意义(t=5.35, P<0.05)。
2.5 胃黏膜层及浆膜层情况 GST病变处胃黏膜层完整15例(图1B),黏膜中断、溃疡形成11例(图2);26例病变处浆膜层光滑清晰。PGL病变处胃黏膜层完整连续12例(图3B),黏膜破坏9例;病变处浆膜层模糊2例,浆膜层光滑清晰19例。
2.6 胃周淋巴结及其他器官侵犯 26例GST患者均未见胃周淋巴结肿大,PGL患者中6例(28.6%)见胃周淋巴结肿大,差异有统计学意义(χ2=6.14, P<0.05)。本组GST及PGL患者中无一例发现肝脏、脾脏转移或侵犯。
3 讨论
3.1 概述 GST与PGL的起源、治疗方案及预后完全不同。GST是发生在胃的间叶源性肿瘤,其特征是CD117免疫表型阳性[5],Bümming等[6]认为起源于胃肠道间质干细胞-Cajal细胞;GST的良恶性程度是一个渐进性的过程,早期以外科完整切除为主、辅助以放化疗,预后较好。PGL是原发于胃黏膜固有层和黏膜下层的淋巴组织的肿瘤,恶性程度较高,多采用化疗和放疗,仅少数局限性病变采取手术治疗[7]。因此,GST和PGL的准确诊断及鉴别诊断对于治疗方案的选择及预后具有重要的临床意义。
3.2 CT表现及鉴别诊断 随着多层螺旋CT空间分辨率和密度分辨力的不断提高,可以清楚地显示胃壁的厚度、黏膜下及胃腔内外情况,直接显示胃壁各层的厚度、病变范围、胃周淋巴结和肝脏等其他脏器的情况,CT已经成为胃部肿瘤的常规检查方法之一。GST及PGL均为胃非上皮来源,常规胃气钡造影及胃镜检查诊断有一定的困难,尤其是早期病变,而CT可以克服胃气钡造影及胃镜检查只能观察胃腔内病变而不能观察胃外情况的局限性,对GST及PGL的诊断及鉴别诊断具有独特的优越性,并且可以指导胃镜深部活检而做出正确诊断[8]。
GST及PGL的CT征象及鉴别诊断主要为:①病变部位及范围:GST以胃体、胃底多见[9],胃窦极少见,且几乎全部为单发局限性病变,本组病例全部局限性地位于胃底及胃体;而PGL以累及胃体、胃窦多见[10],病变范围广,多数侵犯2个或2个以上部位[3],本组病例大部分累及胃体和胃窦,且19例(90.5%)同时累及多个部位。此特点有助于鉴别GST及PGL;而胃癌常发生于胃窦部,较少发生于胃体及胃底[11]。②病变形态及与邻近胃壁的关系:GST的典型影像表现是边界清楚的圆形或分叶状肿块,与胃壁关系密切,相邻的胃肠壁无明显增厚、与邻近胃壁界限清[9]。PGL表现为胃壁不同程度的匍匐样增厚,与邻近胃壁界限不清或相延续[3]。此特点亦有助于GST与PGL的鉴别。另外,CT多平面重组有助于观察GST病变的形态、解剖位置及范围,可以显示肿块向腔内、腔外或腔内外生长[12,13],而PGL沿胃壁生长,亦可作为鉴别点。③密度及强化特征:GST病灶多为均匀稍低密度,或不均匀等低混杂密度,可伴坏死、钙化;而PGL病变绝大多数为均匀等密度,少见坏死、囊变及钙化,且PGL平扫密度明显高于GST实性密度,此点亦有助于两者的鉴别。GST多数病变呈明显均匀或不均匀延迟强化,可见粗大的肿瘤血管;而PGL几乎均呈轻度均匀延迟强化,亦不同于GST,可以作为一个鉴别点。④胃黏膜层情况:GST及PGL均为黏膜下病变,相应病变处胃黏膜层可完整、尤其早期病变者[14],晚期病变者胃黏膜层可中断、甚至溃疡形成;本组病例中GST病变处胃黏膜层完整15例,PGL病变处胃黏膜层完整连续12例。此点对于GST与PGL的鉴别帮助不大;胃癌起源于胃黏膜,病变处胃黏膜层中断、溃疡形成,有助于鉴别诊断。⑤胃浆膜情况及胃周淋巴结转移:GST极少发生胃周淋巴结转移,且病变处胃浆膜层清晰;而部分PGL可有胃周淋巴结转移,少数病例病变处浆膜层模糊[14],此特点有助于GST与PGL、胃癌的鉴别,但对PGL与胃癌的鉴别诊断帮助不大。
总之,GST与PGL的CT表现均有一定的特征性。GST病变局限、呈不均匀低密度并不均匀明显强化;PGL病变相对弥漫、呈均匀等密度并轻度均匀强化,有助于两者的诊断及鉴别诊断,同时可以指导临床选择治疗方法及判断预后。
[1] 马军, 张志远, 王宁菊, 等. 胃肠道间质瘤的影像学表现.实用放射学杂志, 2005, 21(8): 833-836.
[2] Mendelson RM, Fermoyle S. Primary gastrointestinal lymphomas: a radiological-pathological review. Part 1:stomach, oesophagus and colon. Australas Radiol, 2005, 49(5):353-364.
[3] 潘金万, 梁长虹, 阙松林, 等. 原发性胃淋巴瘤多排螺旋CT表现. 中国医学影像技术, 2010, 26(2): 294-296.
[4] 叶泳松, 尚晓静. 胃间质瘤的多层螺旋CT表现. 广东医学,2011, 32(15): 2003-2005.
[5] Patel SR, Benjamin RS. Management of peritoneal and hepatic metastases from gastrointestinal stromal tumors. Surg Oncol,2000, 9(2): 67-70.
[6] Bümming P, Andersson J, Meis-Kindblom JM, et al.Neoadjuvant, adjuvant and palliative treatment of gastrointestinal stromal tumours (GIST) with imatinib: a centre-based study of 17 patients. Br J Cancer, 2003, 89(3):460-464.
[7] 黎昕, 黄柏锋, 蓝博文, 等. 浸润型胃淋巴瘤和浸润型胃癌的多层螺旋CT表现. 中国医学影像学杂志, 2012, 20(3):195-198.
[8] 王锡明, 纪洪升, 武乐斌, 等. 多层螺旋CT动态强化扫描诊断原发性胃恶性淋巴瘤. 中国医学影像技术, 2005, 21(3):389-391.
[9] Ulusan S, Koc Z, Kayaselcuk F. Gastrointestinal stromal tumors: CT fi ndings. Br J Radiol, 2008, 81(968): 618-623.
[10] Hoshida Y, Kusakabe H, Furukawa H, et al. Reassessment of gastric lymphoma light of the concept of mucosa-associated lymphoid tissue lymphoma: analysis of 53 patients. Cancer,1997, 80(6): 1151-1159.
[11] Ba-Ssalamah A, Prokop M, Uffmann M, et al. Dedicated multidetector CT of the stomach: spectrum of diseases.Radiographics, 2003, 23(3): 625-644.
[12] 赵艳萍, 王新华, 文智, 等. 胃肠道间质瘤的MSCT诊断及误、漏诊分析. 临床放射学杂志, 2010, 29(6): 779-782.
[13] 蔡玉建, 谭政帅, 李澄. 128层螺旋CT对胃间质瘤的诊断及其良恶性分析. 医学影像学杂志, 2013, 23(1): 74-77.
[14] 朱力平, 殷云娟. 多层螺旋CT三期增强扫描诊断胃原发性淋巴瘤的价值. 中国医学影像学杂志, 2011, 19(10): 729-732.
