超声造影时间-强度曲线在肝肿瘤定性及评价射频消融效果中的作用
2013-12-10HEYan
何 雁 HE Yan
李小晶 LI Xiaojing
张 玲 ZHANG Ling
原发性肝癌是我国常见的恶性肿瘤之一,病死率高,在恶性肿瘤中居第3位[1],早期发现、早期诊断、早期治疗对患者的预后尤为重要。由于原发性肝癌手术切除受患者年龄、肿瘤大小及其他恶病质等因素的影响,术后复发率升高,甚至失去手术机会。近年超声引导下肝脏肿瘤射频消融术成为治疗肿瘤的重要方法,但在拟行局部射频消融治疗前,正确的定性诊断可以避免误诊、误治或延误治疗,是获得有效治疗的第一步[2]。目前,随着超声造影剂的不断研制及超声造影技术的不断发展,其诊断病灶逐渐由定性研究过渡到定量研究。超声造影技术与SonoLiver CAP软件相结合,不仅有效地显示了肝脏肿瘤血管和血流灌注情况,而且通过设置参数精确地定量分析超声造影过程中的时间-强度变化,避免了主观因素的干扰,在探测肝脏肿瘤、发现微小病灶及定性方面有明显的优势,且超声造影较常规二维超声可以较好地反映射频消融凝固坏死灶的大小,并较好地评估肝脏肿瘤射频消融的疗效。本研究通过超声造影结合时间-强度曲线量化分析肝脏肿瘤血管的灌注情况,以判断肿瘤的性质及射频消融效果。
1 资料与方法
1.1 研究对象 2010-07~2012-07武汉科技大学附属天佑医院感染科拟诊为肝癌或肝硬化的42例患者,拟接受超声引导下射频消融治疗,纳入标准:①临床确诊为肝癌或肝硬化患者;②年龄>18岁;③二维超声高度怀疑肝内恶性病灶。排除标准:①已知对六氟化硫或SonoVue中的任何成分过敏;②已知或怀疑心脏疾病;③全身高血压未得到有效控制;④严重心律失常。其中男30例,女12例;年龄32~71岁,穿刺65个病灶,消融44个病灶。参照欧洲医学和生物学超声协会联盟(EFSUMB)[3]关于肝脏局灶性病变的超声造影诊断标准判断病灶的良、恶性:动脉期出现增强,门静脉期及延迟期增强消退、回声低于肝组织的病灶为恶性;动脉期增强,门静脉期及延迟期增强持续、回声仍高于或等于肝组织的病灶,或在3个时相均无增强表现的病灶为良性。
1.2 仪器与方法
1.2.1 仪器 采用百胜公司Mylab 90彩色多普勒超声诊断仪,配有对比脉冲序列(contrast pulse sequences,CPS)造影成像技术,探头频率2~5 MHz,彩色增益50%~70%,机械指数(mechanical index, MI)0.06~0.11;超声造影剂采用SonoVue(意大利Bracco公司);射频仪采用RITA MODEL 1500型RFA系统(美国RITA公司);15G星形XL射频电极针(美国RITA公司);巴德穿刺活检枪(型号MC1816)。
1.2.2 方法 二维超声观察肝脏肿瘤的大小、形态、边界、位置、周边有无声晕、内部血流及阻力指数(resistance index, RI)后行超声造影检查。将59 mg SonoVue冻干粉剂用生理盐水5 ml配制成8 μl/ml的六氟化硫微泡悬浮液,振荡30 s。谐波状态下抽取SonoVue造影剂2.5 ml经肘部浅静脉快速推注,然后推注5 ml生理盐水。注射造影剂的同时开启超声仪内置计时器,用超声图像工作站和内置光盘记录扫查。超声造影前患者均签署知情同意书,造影过程中嘱患者平静呼吸。造影结束后将造影动态图像导入SonoLiver CAP软件,在造影图像上勾画出最大感兴趣区,其内选择病灶区及参考区(正常肝组织,范围及深度尽量与病灶相同),优化图像,运动补偿后进行时间-强度曲线分析,得到动态血管模式(DVP)曲线和时间-强度曲线,拟合度均大于70%;导出数据,记录各时间-强度曲线的峰值强度(maximum of intensity, IMAX)、上升时间(rise time, RT)及达峰时间(time to peak, TTP)。
1.2.3 射频消融及穿刺活检 探头放置到肝表面进行引导,超声造影发现65个病灶先行穿刺活检,然后对SonoLiver时间-强度曲线高度怀疑恶性的44个病灶行射频消融治疗,在预定的肝表面进针点进针,在超声引导下边进针边调整方向到达瘤体,连接RITA射频消融系统。逐步打开星形XL电极针进行消融。超声全程监控消融过程,直到每个瘤体完全固化。射频消融后2周行超声造影,评价射频消融效果。
1.3 图像分析 由2位主任医师及副主任医师进行超声造影及图像分析,观察病灶的大小、形态、边界、强化方式、内部有无新生血管,图像导入超声造影时间-强度曲线进行量化分析。
1.4 统计学方法 采用SPSS 13.0软件,超声造影与增强MRI检出增生结节及恶性结节个数比较采用四格表χ2检验,IMAX、RT、TTP比较采用成组t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 二维超声、超声造影、超声造影时间-强度曲线及增强MRI结果 二维及彩色多普勒超声发现瘤结节52个,超声造影发现瘤结节65个,超声造影时间-强度曲线发现瘤结节65个,增强MRI发现瘤结节61个(表1),超声造影时间-强度曲线与单纯超声造影评估肿瘤性质差异有统计学意义(χ2=4.561, P<0.05);超声造影时间-强度曲线与增强MRI评估肿瘤性质方面差异无统计学意义(χ2=0.003, P>0.05),增强MRI与超声造影时间-强度曲线发现的可疑病灶位置吻合,大小有差异。以穿刺活检病理结果为标准,超声造影时间-强度曲线与单纯超声造影评估肿瘤良、恶性方面差异有统计学意义(χ2=5.298, P<0.05),见表 2~4。
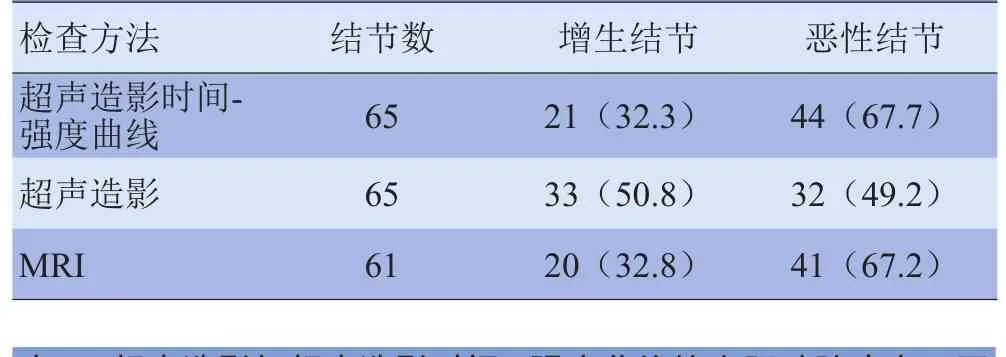
表1 超声造影时间-强度曲线、超声造影与MRI检出增生结节及恶性结节个数[n(%)]
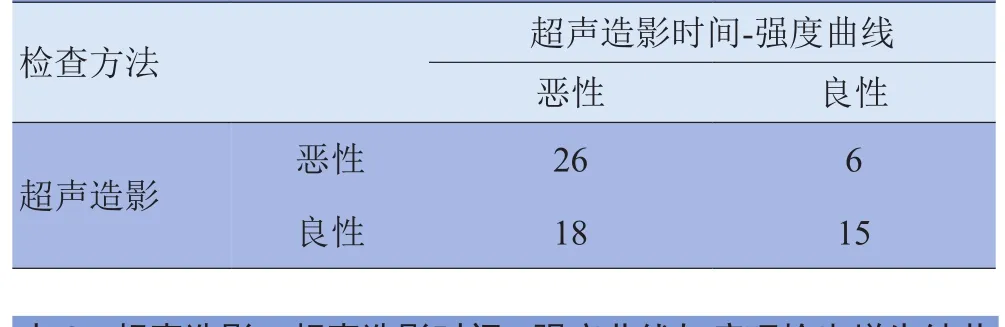
表2 超声造影与超声造影时间-强度曲线检出肝脏肿瘤良、恶性情况比较(个)

表3 超声造影、超声造影时间-强度曲线与病理检出增生结节及恶性结节个数比较(个)
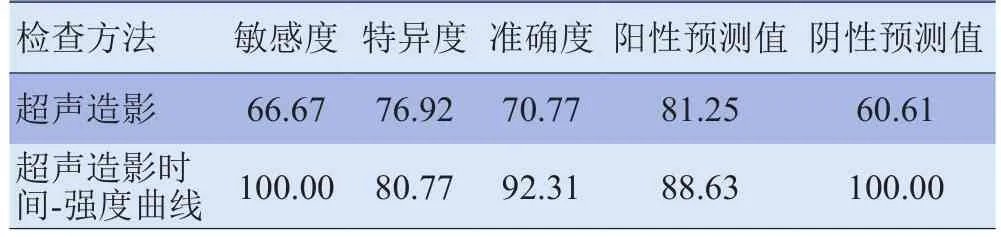
表4 超声造影与超声造影时间-强度曲线对肝脏肿瘤良、恶性的诊断效能(%)
2.2 超声造影时间-强度曲线结果 增生结节超声造影时间-强度曲线示:IMAX稍高于或等于正常肝组织,RT、TTP稍大于或等于正常肝组织。恶性结节超声造影时间-强度曲线示:IMAX明显高于正常肝组织,RT、TTP小于正常肝组织,与超声造影直观结果一致,即“快进快出”。
2.3 射频消融结果 对超声造影时间-强度曲线高度怀疑恶性的44个病灶行射频消融治疗,治疗前超声造影可以全部显示肝脏肿瘤的血流灌注及肿瘤的供血动脉,结合超声造影时间-强度曲线可以直观地判断肿瘤的强化方式,进而判断肿瘤的良、恶性。射频消融治疗后血流灌注消失;射频消融后2周,44个消融病灶中,有38个病灶完全消融,超声造影时间-强度曲线三期表现为无增强,IMAX、RT、TTP接近0,与增强MRI相符,能够较好地反映凝固灶的大小。3个病灶较大,消融不完全,周边残余肿瘤呈恶性肿瘤超声造影时间-强度曲线表现,即IMAX明显高于正常肝组织,RT、TTP小于正常肝组织,与增强MRI相符。3个病灶消融区虽然周边可见恶性肿瘤样“快进快出”血流灌注模式,但增强MRI未见异常增强信号。
2.4 SonoLiver软件在肝内增生结节及恶性结节的DVP表现 增生结节呈黑色等增强或蓝色负性增强(图1A);恶性结节:动脉期均呈快速灌注的红色到黄色的正性增强,门静脉期快速消退,延迟期呈蓝色深浅不一的负性增强(图2A)。
2.5 SonoLiver软件在肝内增生结节及恶性结节的时间-强度曲线特点及参数分析 ①时间-强度曲线特点:增生结节曲线平滑,与周围正常肝组织相似,呈“慢进慢出”(图1B、C);②恶性结节曲线较陡直,与正常肝组织相比差别明显,呈“快进快出”(图2B、C);时间-强度曲线分析:增生结节的IMAX明显小于恶性结节,RT、TTP明显长于恶性结节,差异有统计学意义(t=10.89、-8.49、-5.16, P<0.001),见表5。

表5 肝脏增生结节及恶性结节时间-强度曲线指标比较

图1 患者男,56岁,肝脏局灶性结节样增生。A.增生结节动脉期的动态血管灌注示病灶内可见蓝色负性增强及黑色等增强,DVP分布图上黄/红色表示增强水平高于周围正常肝组织,蓝/绿色表示增强水平低于周围正常肝组织,黑色表示增强水平等于周围正常肝组织;B.增生结节时间-强度曲线呈“慢进慢出”;C.增生结节DVP曲线,造影全程IMAX较肝组织低。黄色曲线为正常肝组织,绿色曲线为病灶
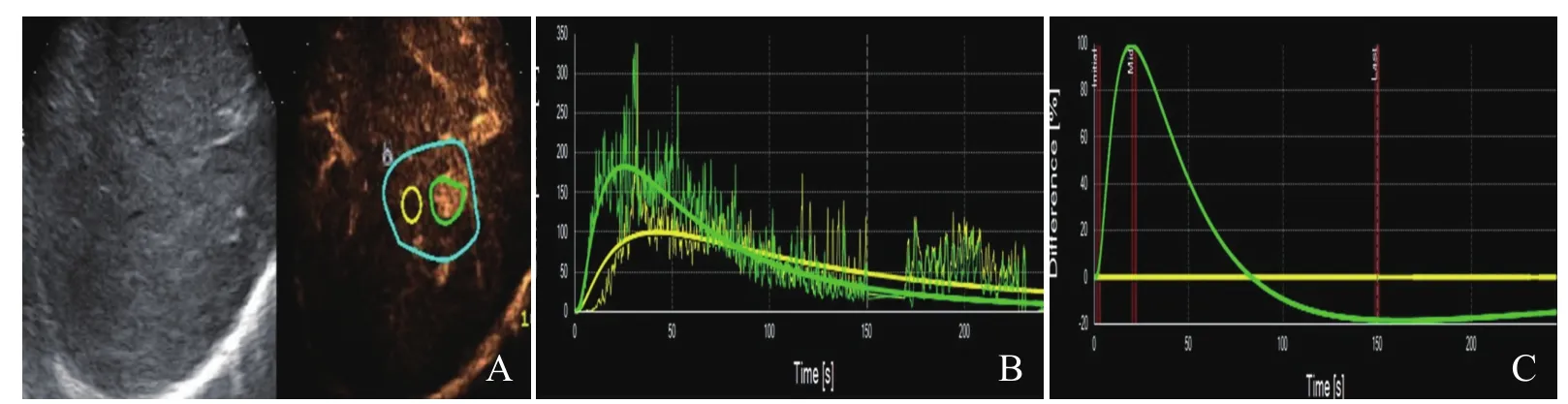
图2 患者男,63岁,肝细胞肝癌。A.恶性结节动脉期的动态血管灌注示病灶内可见黄色正性增强,DVP分布图上黄/红色表示增强水平高于周围正常肝组织,蓝/绿色表示增强水平低于周围正常肝组织,黑色表示增强水平等于周围正常肝组织;B.恶性结节时间-强度曲线呈“快进快出”,黄色曲线为正常肝组织,绿色曲线为病灶;C.恶性结节DVP曲线,79 s之前病灶内(绿色)的IMAX比肝组织(黄色)高,之后低于肝组织,直至造影
3 讨论
肝细胞肝癌在肝硬化患者中发病率非常高,约为6%~11%,恶性肿瘤血供丰富,其内的新生血管排列紊乱。常规彩色多普勒超声对低速血流及位置较深的肿瘤血流检测不敏感,不能充分地显示肿瘤内的血流灌注情况,其对肝细胞肝癌的敏感度为50%~85%,特异度仅为70%~90%[4,5]。声学造影是近年发展起来的超声新技术,肿瘤的超声造影表现与肿块的血流动力学密切相关[6,7],利用造影剂对比成像能动态地观察肿瘤内血管的丰富程度及灌注模式,对血流的检测更敏感,弥补了二维及彩色多普勒超声的不足。超声造影时间-强度曲线在超声造影的基础上实时匹配相关成像技术,更为直观地显示肿瘤内血管的造影剂流速及流量随时间的变化,避免了肉眼观察的主观性,量化评价肿瘤内血管的丰富程度及灌注模式,可以较好地诊断肉眼无法鉴别的良、恶性占位病灶[8]。
本研究结果发现,增生结节超声造影时间-强度曲线示:IMAX稍高于或等于正常肝组织,RT、TTP稍大于或等于正常肝组织,而恶性结节则表现为IMAX明显高于正常肝组织,RT、TTP小于正常肝组织,与超声造影直观结果一致,为“快进快出”。增生结节与恶性结节的IMAX、RT、TTP有显著差异,与刘艳等[8]的研究结果一致。IMAX可以反映病灶内的整体血供状况,即造影剂进入感兴趣区内达到最高浓度时与参照区的强度比;由于恶性病灶大多为富血供肿瘤,以肝动脉供血为主,在动脉期早中期造影剂即充填完全,达峰时间短,表现为“快进”。此外,恶性病灶内可以形成很多新生血管,导致IMAX明显高于正常肝组织,而再生结节内部的血供尤其是动脉血供与正常肝实质基本一致[9],因此峰值较恶性病灶低,整体表现为“等进”,即与正常肝组织同步强化。
对于肝肿瘤射频消融治疗的患者,术前正确诊断能使肝癌患者得到及时有效的治疗,同时可以减少良性病灶不必要的消融。肝癌在实时灰阶超声造影上多表现为动脉期快速、整体增强或环状增强,门静脉期或延迟期消退呈低回声改变[10,11]。本组39个恶性病灶中,5个良性病灶超声造影和超声造影时间-强度曲线均诊断为恶性病灶,其超声造影表现为早期动脉期轻度增强或快速强化,门静脉期进一步充填,延迟期消退稍早于肝组织,经活检穿刺证实为非典型增生结节。文献[12,13]报道始增时间与肝内局灶性病变的动脉血供丰富程度密切相关,动脉血供越丰富 ,造影剂始增时间越短。判断肿瘤良、恶性的关键并不在于动脉期的增强程度,而在于门静脉期及延迟期的消退速度和程度,即是否呈低增强或更低增强[14]。因此,在判断肿瘤良、恶性上,除典型“快进快出”考虑为恶性病灶外,对于延迟期消退早于肝组织的超声造影也判定为恶性病灶。影像学检查不能替代病理检查,超声造影可疑阳性病灶虽经病理证实为非典型增生,但其病理性质亦属于癌前病变,行射频消融后对其远期预后有很大影响。
超声引导下经皮消融介入治疗肝脏恶性肿瘤是一种微创治疗方法,对判断肿瘤是否完全消融坏死尤为重要。超声造影检测肝细胞肝癌凝固区残余瘤的敏感度、特异度和准确度分别为90%、100%、98.2%[15],且在微波凝固后的不同时间段内其超声造影表现有所不同[16]。凝固后30~60 min时造影,声像图上可见凝固灶内仍有未能散尽的水蒸气表现为高回声,易误认为造影增强,7 d内凝固灶周边可见造影剂浓染的环状高回声带,此区为炎性充血纤维包裹带。15 d后超声造影无此现象,故本研究中射频消融后2周进行追踪观察,44个消融病灶中,38个病灶完全消融,消融后超声造影时间-强度曲线三期均表现为无增强,IMAX、RT、TTP接近0,与增强MRI相符。3个病灶较大,消融不完全,周边残余肿瘤呈恶性肿瘤超声造影时间-强度曲线表现,即IMAX明显高于正常肝组织,RT、TTP小于正常肝组织,与增强MRI相符,行再次消融2周后,超声造影三期未见异常强化带。3个病灶消融区周边虽然可见恶性肿瘤样血流灌注,但增强MRI未见异常增强信号,考虑为患者的呼吸和扫描厚度等因素所致,对小的病灶MRI未见明显的活性病灶。半年后增强MRI随访,此处肝癌复发。
超声造影可以实时、动态地显示肝脏肿瘤血管和肿瘤微血管的血流灌注情况,不同的病灶有不同的增强模式,通过观察增强模式可以基本判断病灶的性质,但由于增强模式是依靠操作医师的主观判断,缺乏客观性,应用SonoLiver CAP软件可以较好地量化分析病变特征,在肝脏肿瘤的探测、发现微小病灶及定性方面有明显优势。此外,超声造影可以清晰地显示介入治疗后病灶内有无局部或整体强化,在残余肿瘤及较小的复发灶上比增强MRI存在一定的优势,而且可以实时引导残余肿瘤的再次消融。因此,超声造影在肝脏肿瘤消融治疗和治疗后早期疗效评估上有较大的应用前景。
[1] 陈晓宇. 超声造影及超声组织定征在肝癌射频或微波消融治疗前后的对比研究. 上海: 第二军医大学博士学位论文,2005: 1-98.
[2] 季正标. 实时超声造影在肝癌微波消融治疗中的应用评价.上海: 复旦大学硕士学位论文, 2008: 11-12.
[3] 丁红, 范培丽, 林希元, 等. 超声造影定量分析技术评价肝癌肿瘤血管生成的临床研究. 中华超声影像学杂志, 2008,17(5): 405-408.
[4] De Masi S, Tosti ME, Mele A. Screening for hepatocellular carcinoma. Dig Liver Dis, 2005, 37(4): 260-268.
[5] 季正标, 王文平, 俞清, 等. 肝癌微波消融术前超声造影对肝脏肿瘤再定性的应用价值. 中国介入影像与治疗学,2010, 7(1): 19-22.
[6] 严昆, 陈敏华, 戴莹, 等. 造影增强超声在射频治疗肝肿瘤中的应用. 中华肿瘤杂志, 2005, 27(1): 41-44.
[7] 王文平, 魏瑞雪, 丁红, 等. 肝肿瘤实时超声造影的血流动力学分析. 中华超声影像学杂志, 2004, 13(5): 359-362.
[8] 刘艳, 陈文卫, 李珏颖, 等. SonoLiver时间强度曲线在肝脏局灶性占位病变超声造影中的应用价值. 中华医学超声杂志(电子版), 2011, 8(5): 1023-1032.
[9] 王文平. 超声造影在肝脏良性局灶性病变诊断中的应用.中华医学超声杂志(电子版), 2008, 5(1): 6-9.
[10] Burns PN, Wilson SR. Focal liver masses: enhancement patterns on contrast-enhanced images--concordance of US scans with CT scans and MR images. Radiology, 2007, 242(1):162-174.
[11] Trillaud H, Bruel JM, Valette PJ, et al. Characterization of focal liver lesions with SonoVue-enhanced sonography: international multicenter-study in comparison to CT and MRI. World J Gastroenterol, 2009, 15(30): 3748-3756.
[12] 王知力, 唐杰, 鲁通, 等. 肝局灶性病变的超声造影定量分析及其在定性诊断中的意义. 中华超声影像学杂志, 2006,15(8): 576-579.
[13] Jaspers N, Pfister R, Kinkel H, et al. Contrast-enhanced ultrasound. Dtsch Med Wochenschr, 2012, 137(45): 2336-2339.
[14] 肖雪初, 徐斌, 钱桂荣, 等. 超声造影对肝脏肿瘤良恶性鉴别诊断的临床应用. 上海医学影像, 2009, 18(4): 317-319.
[15] 付文生, 孔学军, 戴启宇, 等. SonoVue谐波超声造影判定经皮微波凝固治疗肝细胞癌残余瘤的效用. 中国医学影像学杂志, 2010, 18(4): 322-324.
[16] 何年安, 王文平, 季正标, 等. 实时超声造影评价狗肝微波凝固坏死效果的实验研究. 实用肝脏病杂志, 2008, 11(5):300-302.
