全麦粉水不溶性戊聚糖碱法提取工艺的研究
2013-12-08马福敏徐美玲郭小瑞郭乃菲单舒筠鲍士宝
马福敏,徐美玲,郭小瑞,郭乃菲,单舒筠,鲍士宝
(1.辽宁中医药大学药学院,辽宁大连116600;2.安徽科技学院食品药品学院,安徽凤阳233100)
小麦是一种特殊的加工主食面包的原料,其特殊性一方面归因于面筋蛋白。因为和面时,面筋蛋白形成弹性网络结构,具有较强的持气能力[1]。然而,面粉中的另一种成分——戊聚糖(其中主要是水不溶性戊聚糖,water unetractable pentosan,WUP)含量虽然较面筋蛋白低,但可吸收相当于自身重量3.5~10倍的水[2]。另外,Izydorczyck 等证明 WUP 可稳定蛋白质泡沫,减少蛋白质膜的热损伤[3]。Wang等认为WUP与面筋蛋白存在直接或间接的相互作用[4-6]。所以WUP对面团及面包的性质产生重要的影响。随着人们对WUP应用领域的不断扩大,人们对其组成及结构有了不断深入的了解。通常认为WUP是由吡喃木糖单元通过β-(1→4)糖酐键连接的主链,C(O)2和(或)C(O)3位上连接阿拉伯呋喃糖侧链构成[7-8]。有些阿拉伯糖侧链还通过酯键与阿魏酸等酚酸相连。WUP与水溶性戊聚糖的差别在于其具有相对大的分子量及高的A/X值[9]。WUP的这种线性结构使其呈棒状,可水化形成粘稠的水溶液[10]。由于WUP与纤维素等细胞壁物质紧密连接,因此较水溶性戊聚糖难以与细胞壁其他成分分离。目前主要采用碱法提取水不溶性戊聚糖。常用的碱有 NaOH、Ca(OH)2、Ba(OH)2等。郑学玲等[11]对前两者提取麸皮中WUP进行了工艺优化。结果表明,以NaOH为溶剂时,在最佳条件下,提取率较低(<11%)。为了研究WUP结构与功能之间的关系,应首先建立一种高效的提取方法。全麦粉中WUP含量较普通面粉高,因此WUP与面筋蛋白之间的相互作用对面团的流变性质及全麦面包等产品有较大的影响。在全麦粉这样复杂的体系中要研究其中的某种成分,通常是将这种成分提取出来,先进行单一成分功能性质的研究,然后在实际体系(即全麦面团或全麦面包)中,研究其它成分对它的影响。从全麦粉中提取WUP与其他原料(麦麸)相比,应首先将淀粉、脂肪及面筋蛋白等去除,而后从得到的粗提物中提取WUP。本研究选择以上三种碱进行提取效果的比较,选择最合适的碱,并优化提取工艺,以确定水不溶性戊聚糖的最佳提取条件。
1 材料与方法
1.1 材料与仪器
全麦粉 中粮鹏泰面粉有限公司;间苯三酚、D-木糖 美国Sigma公司;葡萄糖 中国医药上海化学试剂站;3,5-二硝基水杨酸(DNS) 上海化学试剂公司;其他试剂均为分析纯;耐高温α-淀粉酶(2×104IU/mL)及高转化率糖化酶(1×105IU/mL)
无锡杰能科生物有限公司;碱性蛋白酶(Alcalase2 4L)(1×104IU/mL) 丹麦诺维信(Novo)公司。
DGG-9070A电热鼓风干燥箱 上海森信实验仪器有限公司;722分光光度计、DDS-11C电导率仪
上海精密科学仪器有限公司;TG328A电光分析天平 上海天平仪器厂;DELTA320精密p H计 上海雷磁仪器厂;超级恒温器 上海市实验仪器厂;Sigma4K 15高速冷冻离心机 德国;ZX98-1旋转蒸发仪 中国科学院上海有机化学研究所;酶反应器自制;195LABCONO冷冻干燥设备 英国。
1.2 实验方法
1.2.1 全麦粉中水不溶性戊聚糖粗提物制备工艺流程 工艺流程参考文献[8-11]并加以调整。
200g小麦粉(灭酶)+1000mL水→室温搅拌1h→离心(3600r/min,15min)→残渣+600mL水→调节pH至6.0,加热沸腾至完全糊化→耐高温α-淀粉酶搅拌→冷却到60℃,pH调到4.2→加入高转化率糖化酶→100℃下灭酶10min→离心(8000r/min,20min)→残渣+600mL水→60℃恒温,pH调至9.0→加入碱性蛋白酶→100℃灭酶10min→反复离心至上清液清澈为止→冷冻干燥→水不溶性戊聚糖粗提物(crude water unextractable pentosan,CWUP)
1.2.2 CWUP中WUP的提取方法 工艺流程参考文献[12-13]并加以调整。
在酶反应器中加入CWUP 2.0g,加入碱溶液,当超级恒温水浴锅中水的温度升高到设定的温度时,搅拌反应,调节p H至7.0,离心后取上清液,真空浓缩,透析直至透析液的导电率小于2.5×102μs/cm(与去离子水的导电率相当),冷冻干燥,得到WUP。
1.2.3 分析方法
1.2.3.1 总糖含量的测定 采用苯酚-硫酸法[14]。标准曲线方程:y=0.0039x-0.0032(R2=0.999)。按公式(1)计算总糖含量:
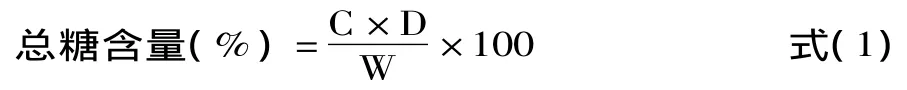
式中:C-标准曲线中查得葡萄糖的含量(mg);D-样液的稀释倍数;W-样品的质量(mg)。
1.2.3.2 戊聚糖含量的测定 地衣酚-盐酸法[15]。标准曲线方程如下:y=0.003x-0.0182(R2=0.9955)。根据公式(2)计算戊聚糖含量:

式中:μ-标准曲线中查得的木糖含量(mg);0.88-木糖换算为阿拉伯木聚糖的系数;m-样品的质量(mg)。
1.2.3.3 糖醛酸含量的测定 硫酸-咔唑试剂法[16]。标准曲线方程为y=0.0007x-0.0048(R2=0.9996)。按式(3)计算糖醛酸的质量分数:

式中:AUA含量-从标准曲线上查的数据(μg);N-稀释倍数;m-样品质量(g)。
1.2.3.4 水分含量的测定 105℃烘箱法,参照GB/T 5009.3-2003。
1.2.3.5 蛋白质含量的测定 微量凯氏定氮法,参照GB/T 5009.5-2003。
1.2.3.6 灰分的测定 马弗炉灰化法,参照GB/T 5009.4-2003。
1.2.4 实验方案的设计 全麦粉过110μm筛后,经耐高温α-淀粉酶及高转化率糖化酶水解除去淀粉,Alcalase2 4L碱性蛋白酶水解除去蛋白质,水洗得到WUS中主要为小麦麸皮,其中含有大量的WUP。将WUS加入碱液提取。对三种碱液、提取时间、提取温度及料液比进行单因素实验。在料水比为1∶50(g/mL),提取时间是 3h,分别在 40、50、60、70、80℃下考察温度对WUP提取率的影响;在温度为60℃,提取时间为 3h,分别在料水比(g/mL)为 1∶50、1∶75、1∶100、1∶150、1∶200 及 1∶250 条件下考察料液比对 WUP 提取率的影响;在温度为60℃,料水比为1∶150(g/mL)时,提取时间分别为 1、2、3、4、5h 时考察提取时间对WUP提取率的影响,以确定最佳的提取工艺条件范围。
根据单因素实验,对碱法提取WUP条件,采用响应面方法进行优化。以料液比(A)、碱提温度(B)和提取时间(C)3个因素作为自变量,以WUP提取率(Y)为响应值,根据Box-Behnken中心组合设计原理,设计3因素3水平的响应面分析实验(Response Surface Methodology,RSM),因素水平见表 1。

表1 RSM实验因素及水平表Table 1 Independent variables and levels of RSM
1.2.5 提取率的计算 提取率计算公式如式4:

式中:mWUP为水不溶性戊聚糖的质量(g);mCWUP为水不溶性戊聚糖粗提物的质量(g)。
2 结果与分析
2.1 水不溶性戊聚糖提取的单因素实验
2.1.1 碱对水不溶性戊聚糖提取效果的影响 小麦中WUAX与细胞壁物质如木质素及纤维素等通过氢键及共价键紧密结合形成微晶区,OH-可使纤维素溶涨,使氢键断裂,并可水解纤维素与WUP之间以FA基团连接的酯键,使WUP游离出来,进而与不溶性的纤维素及木质素等分离[17]。
本研究使用不同的碱对全麦粉中WUP进行提取,并对提取率进行比较,结果见表2。

表2 不同的碱对WUP提取的影响Table 2 Effect of alkali on WUP extracting
从表2中可以看出,以NaOH为提取溶剂时,0.5mol/L浓度下提取率即可达到33.0%,但提取物中WUP含量只有58.09%左右。当以饱和Ca(OH)2和Ba(OH)2(含 0.26mol/L NaBH4)作溶剂时,与0.5mol/L NaOH相比,提取率下降,但WUP含量大幅度提高。这是由于NaOH不仅可提取WUP,也将细胞壁的主要成分纤维素及少量的葡聚糖一同提取出来。研究表明二价阳离子的存在对于WUP的选择性提取非常重要[18-19]。室温下(26℃)Ca(OH)2饱和溶液溶解度很低,并且溶解度随温度的升高而下降,其浓度不足以溶出大量细胞壁中的 WUP。但Ba(OH)2作溶剂能克服上述缺点,Cyran等[20]研究表明Ba2+可与细胞壁中的β-葡聚糖作用形成不溶于Ba(OH)2饱和溶液的物质,可通过离心除去。大大提高了 WUAX的提取效率。此外,溶液中加入NaBH4一方面可提高Ba(OH)2对WUP的选择性,另一方面可防止溶解在碱溶液中的WUP发生降解。
因此本实验选用饱和Ba(OH)2(含0.26mol/L NaBH4)作溶剂提取,并对此提取工艺作进一步的优化。
2.1.2 温度对提取率的影响 料水比为1∶50(g/mL),提取时间是 3h,分别在 40、50、60、70、80℃下提取WUP,结果见图1。
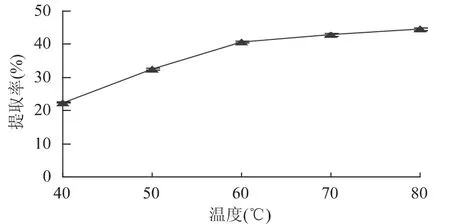
图1 温度对提取率的影响Fig.1 Influence of temperature on extraction yield
由图1可以看出,随温度的升高,提取率随之增大,当温度为60℃时,提取率增加最为明显,继续提高温度,提取率增加幅度减小。
2.1.3 料水比对提取率的影响 温度为60℃,提取时间为 3h,分别在料水比为 1∶50、1∶75、1∶100、1∶150、1∶200、1∶250(g/mL)条件下提取戊聚糖,结果见图 2。
从图2可以看出,随着水的增加,提取率得到很大提高。当料水比达到1∶150(g/mL)时,继续增加水含量对提取率的影响减小。这是因为随溶剂量增大,粗提物与溶剂接触界面处的浓度差增大,从而传质速率提高,提取率增大。当料水比为 1∶150(g/mL)时,再增加溶剂用量,提取率基本保持不变。另外,从节省资源,减少污染的角度考虑,应尽量降低饱和Ba(OH)2的用量。

图2 料水比对提取率的影响Fig.2 Influence of the ratio of liquid to solid on extraction yield
2.1.4 提取时间对提取率的影响 温度为60℃,料水比为1∶150(g/mL)时,提取时间分别为 1、2、3、4、5h时提取戊聚糖,以确定最佳的提取工艺条件。结果见图3。

图3 提取时间对提取率的影响Fig.3 Influence of time on extraction yield
根据液固萃取基本理论,延长提取时间将有利于溶质的提取,从图3可以看出当提取时间小于3h时,随着提取时间的延长提取率随之增加,且增加幅度较大,这是因为提取时间过短,溶剂与粗提物还没有充分的接触,所以增加提取时间有利于提取率的提高。提取时间到达3h时,提取率增幅减小,可见在3h内提取过程基本完成,时间对提取率的影响减小。
2.2 工艺优化
2.2.1 实验设计 综上分析选取如下水平值进行工艺优化,用Design Expert软件进行工艺优化实验设计,实验结果如表3所示。
由软件拟合得到回归方程如下:Y=31.12+2.03A+2.52B+0.65C+1.51AB-0.40AC-0.87BC-3.81A2-10.47B2-6.25C2,从回归方程可以看出,温度对戊聚糖的提取率影响最大,料水比次之,而提取时间影响最小。由交互项的系数可以看出提取温度和料水比的影响较大。这一结果与方差分析结果一致。
2.2.2 各因素的交互作用对WUP提取率的影响通过多元回归方程所做的响应曲面图及其等高线图(图4~图6),所拟和的响应曲面和等高线图能比较直观的反映各因素和各因素间的交互作用,由图图4~图6可以看出,3个响应曲面均为开口向下的凸形曲面,A(料水比)、B(提取温度)和C(提取时间)3个因素与WUP的提取率呈抛物线关系,且在考察范围内存在响应值(WUP的提取率)的极高值。

表3 实验方案及实验结果Table 3 Experiment design and results
图4为提取时间为3h时,料水比与提取温度的交互影响。从图中可以很直观的看出温度在60℃时,提取率在最高的范围内,当料水比达到1∶150(g/mL)时,提取率达到最大值32.74%,料水比继续增加对提取率影响不大。当提取率为26.68%时,料水比需要提高一倍才能达到32.74%,而达到同样的提取率温度只需上升10℃,所以可以得出温度对提取率的影响更显著,从而可以通过控制温度来有效地减少料水比,节约原料。
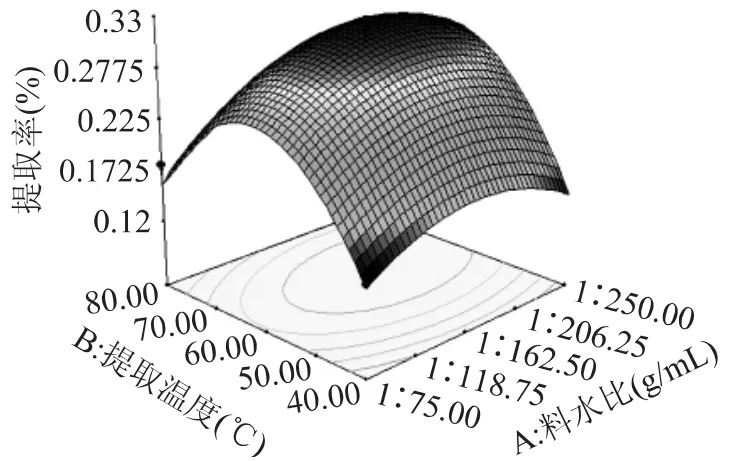
图4 料水比与提取温度对戊聚糖提取率的影响Fig.4 Influence of the ratio of liquid and solid and temperature on extraction yield
图5 为提取温度为60℃时,料水比与提取时间之间的交互关系。从图中可以看出,这两个因素的交互影响不是很显著,提取时间对提取率的影响大于料水比,在一定范围内,可以适当的提高提取时间,减少料水比,从而可以有效的节约原料。在料水比为1∶150(g/mL),提取时间为3h时提取率最大。
图6为提取时间与提取温度对戊聚糖提取率的影响。适当增加料水比与提取时间有利于提高戊聚糖的提取率。这两个因素的交互影响也不显著,但是可以得出提取温度对提取率的影响大于提取时间,可以适当的控制提取的温度来减少提取时间,从而提高单位时间戊聚糖的产量。在提取时间为3h,提取温度为62℃时得到最佳提取率32.74%。
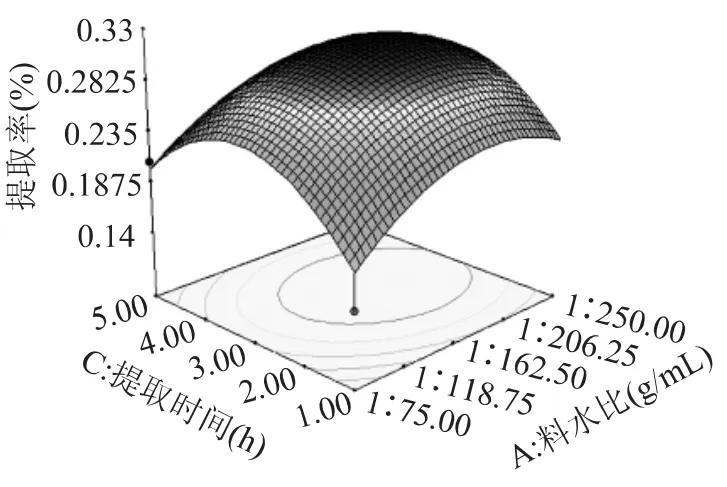
图5 料水比和提取时间对戊聚糖提取率的影响Fig.5 Influence of the ratio of liquid and time on extracton yield
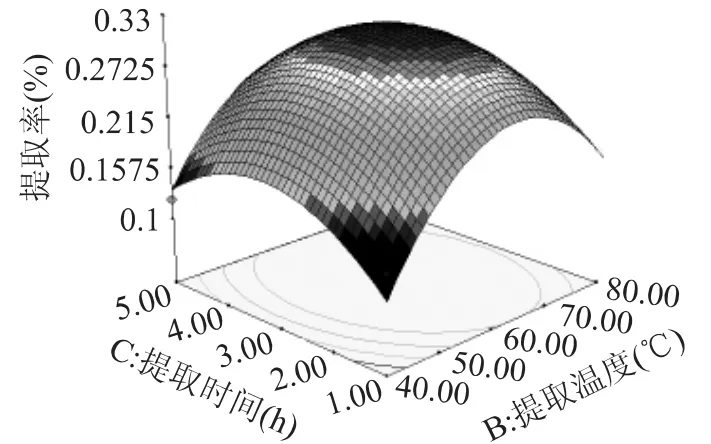
图6 提取温度与提取时间对戊聚糖提率的影响Fig.6 Influence of temperature and time on extraction yield
2.2.3 方差分析及提取率与过程参数回归方程的拟合 方差分析结果如表4。从表4可以看出,回归模型显著,失拟项不显著,说明模型拟合较好。各因素对提取率的影响依次为B>A>C,即提取温度对提取率的影响最大,其次为料水比,提取时间对提取率的影响最小。模型的一次项不显著,而二次项显著,说明单个因素对提取率的影响不是简单的线性关系,二次项中提取温度高度显著,对提取率影响尤其大,这与拟合方程得到的结果一致。R2=0.9191,说明该模型与实验数据拟合较好,可以用于提取戊聚糖的理论预示。

表4 方差分析Table 4 Variance analysis
综上所述,用响应面分析得到最佳提取工艺条件为料水比1∶188.07(g/mL),温度63℃,提取时间3h,提取率为31.60%。考虑到实际操作的局限性,同时达到节省时间、节约试剂、提取效果好的目的,提取工艺条件调整为:料水比1∶188(g/mL),浸提温度65℃,浸提时间3h。结果显示WUP的实际提取率为31.87%,与理论预测值基本一致。
2.3 提取物的主要成分
在最佳工艺条件下提取得到的提取物中戊聚糖含量的多少决定能否进行后续的纯化及戊聚糖功能性质的研究,因此,本研究对提取物中主要成分进行分析,结果见表5。
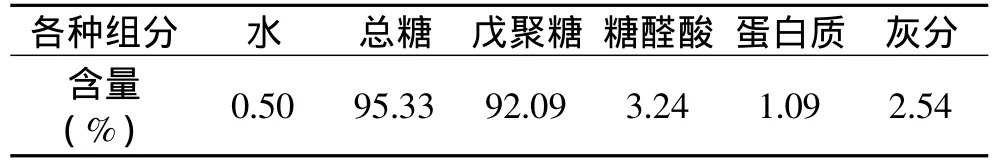
表5 最佳工艺条件下提取物中主要成分的含量Table 5 Components of the extractant extracted at the optimum condition
由表5可以看出,最佳工艺条件下得到的产品戊聚糖含量很高。在此条件得到的产物,与用NaOH及Ca(OH)2最佳工艺条件下得到的产物相比,戊聚糖含量提高了12%~16%[12],大大提高了提取效率。
3 结论
通过不同的碱对WUAX的提取率以及产品戊聚糖含量比较,发现Ba(OH)2的提取效果最好;单因素实验结果表明,温度为60℃左右,料水比为1∶150左右,时间为3h左右时,小麦粉中戊聚糖提取率较大;响应面分析得到Ba(OH)2提取戊聚糖的最佳工艺条件为:料水比1∶188.07(g/mL),提取温度63℃,提取时间3h,提取率为31.60%;通过验证实验确定为料水比1∶188(g/mL),温度65℃,提取时间3h时,提取率达31.87%,与理论预测值基本吻合。方差分析结果显示各因素对提取率影响的模型显著(p<0.05),提取温度的平方项对提取率的影响高度显著(p<0.001);最佳工艺条件下得到的提取物中总糖,戊聚糖及糖醛酸含量分别为95.33%、92.09%及3.24%。
[1]Courtin C M,Delcour J A.Arabinoxlans and endoxylanase in wheat flour bread-making[J].Journal of Cereal Science,2002,35:225-243.
[2]李利民,侯业茂,朱永义,等.谷物戊聚糖国内外研究进展[J].粮油加工与食品机械,2002(5):36-38.
[3]Sarker D K,Wilde P J.Enhancement of protein foam stability by formation of wheat arabinoxylan-protein crosslinks[J].Cereal Chemistry,1998,75:493-499.
[4]Wang M,Hamer R J.Effect of water unextractable solids on gluten formation and properties:mechanistic considerations[J].Journal of Cereal Science,2003,37:55-64.
[5]Wang M,Oudgenoeg G.Interaction of water unextractable solids with gluten protein:effect on dough properties and gluten quality[J].Journal of Cereal Science,2003,38:95-104.
[6]Wang M,Vliet T V.Interaction of water unextractable solids and xylanase with gluten protein:effect of wheat cultivar[J].Journal of Cereal Science,2005,41:251-258.
[4]Bergmans M E F,Beldman G H,Gruppen,et al.Optimisation of the selective extraction of(Glucurono)arabinoxylans from wheat bran:use of barium and calcium hydroxide solution at elevated temperatures[J].Journal of Cereal Science,1996,23:235-245.
[5]Barron C,Robert P,Fabienne G,et al.Structural heterogeneity of wheat arabinoxylans revealed by Raman spectroscopy[J].Carbohydrate Research,2006,341:1186-1191.
[6]Gruppen H,Komelink F J M,Voragen A G J.Waterunextractable cell wall material from wheat flour.III.A structural model for arabinoxylans[J].Journal of Cereal Science,1993,19:111-128.
[7]Izydorczyk M S,Biliaderis CG.Cereal arabinoxylans:advances in structure and physicochemical properties[J].Carbohydrate Polymers,1995,28:33-48.
[8]Faurot A-L,Saulnier L,Brot S,et al.Large scale isolation of water-soluble and water-insoluble pentosans from wheat flour[J].Lebensm-Wiss u-Technol,1995,28:436-441.
[9]周素梅.阿拉伯木聚糖在焙烤制品中的功能性质的研究[D].无锡:无锡轻工大学食品学院,2000.
[10]Maes C,Delcour J A.Structural characterisation of waterextractable and water-unextractable arabinoxylans in wheat bran[J].Journal of Cereal Science,2002,35:315-326.
[11]郑学玲.小麦麸皮戊聚糖的分离制备、理化性质及功能特性研究[D].无锡:江南大学食品学院,2002.
[12]Verbruggen M A,Beldman G,Voragen A G J.The selective extraction of glucuronoarabinoxylans from sorghum endosperm cell walls using barium and potassium hydroxide solutions[J].Journal of Cereal Science,1995,21:271-282.
[13]Hollmann J,Lindhauer M G.Pilot-scale isolation of glucuronoarabinoxylans from wheat bran[J].Carbohydrate Polymers,2005,59:225-230.
[14]李建武.生物化学实验原理与方法[M].北京:北京大学出版社,1997:25-29.
[15]周素梅,王璋,许时婴.面粉中戊聚糖含量测定方法的探讨[J].食品工业科技,2000,21(6):70-72.
[16]王璋,许时婴.食品化学[M].北京:中国轻工业出版社,2006:33-52.
[17]Izydorczyka M S,MacGregor A W.Evidence of intermolecular interactions of β-glucans and arabinoxylans[J].Carbohydrate Polymers,2000,41:417-420.
[18]Mandalari G,Faulds CB,Sancho A I,et al.Fractionation and characterisation of arabinoxylans from brewers’spent grain and wheat bran[J].Journal of Cereal Science,2005,42:205-212.
[19]Huisman M M H,Schols H A,Voragen A G J.Glucuronoarabinoxylans from maize kernel cell walls are more complex than those from sorghum kernel cell walls[J].Carbohydrate Polymers,2000,43:269-279.
[20]Cyran M,Courtin CM,Delcour JA.Heterogeneity in the fine structure of alkali-extractable arabinoxylans isolated from two rye flours with high and low breadmaking quality and their coexistence with other cell wall components[J].Journal of Agricultulure and Food Chemistry,2004,52(9):2671-2680.
