紫玉米苞叶花色苷的纯化鉴定及热稳定性分析
2013-12-08陈姗姗赵晓燕
王 丹,马 越,张 超,陈姗姗,赵晓燕
(北京市农林科学院蔬菜研究中心,农业部华北地区园艺作物生物学与种质创制重点实验室,农业部都市农业(北方)重点实验室,北京100097)
花色苷是一类主要存在于植物中的水溶性色素,属类黄酮化合物,是植物的主要呈色物质之一[1-3],具有多种生物活性功能。能够清除体内的自由基[4],降低氧化酶的活性[5],降低高血脂大鼠的甘油脂水平,改善高甘油脂脂蛋白的分解代谢,抑制胆固醇吸收,降低低密度脂蛋白胆固醇含量,减轻肝功能障碍和预防心血管疾病[5-6],抗氧化、抗突变、抗肿瘤和抗过敏[7-8],抑制金黄色葡萄球菌生长等功效[9-11],因此被广泛应用于糖果、果酱、饮料、果汁、保健品等食品工业及医药和化妆品领域。然而花色苷结构不稳定,对光、热、pH敏感,尤其是热处理会引起花色苷的降解[12],结构不同的花青素除了颜色上的差异外,功能性质也不同,使其在应用过程中受很大限制[13]。紫玉米花色苷的含量高,无论籽粒还是苞叶均含有大量的花色苷,由于紫玉米栽培适应性强,成本低廉,将是我国未来花青素产业的生力军,特别是紫玉米苞叶,花色苷的提取与分析有利于紫玉米苞叶的废物利用,然而苞叶中不同种类的花色苷的热稳定性如何,目前没有报道。本文拟通过紫玉米苞叶花色苷结构的鉴定明确花色苷组成,并通过柱层析方法制备单体组分,采用热重仪器分析总花色苷及不同单体的热稳定性,揭示其热处理中的失重特点,为其在加工应用方面提供理论依据。
1 材料与方法
1.1 材料与设备
紫玉米苞叶(涿紫一号) 由北京市农林科学院蔬菜研究中心农产品加工实验室提供;乙腈、甲醇色谱纯,Dima技术公司;甲酸、三氟乙酸 分析纯,汕头市西陇化工厂有限公司。
UV-3802紫外可见分光光度计 上海尤尼柯公司;HPLC 1200 series,IonTrap 6310液质联用仪 安捷伦公司;BüCHI R-215旋转蒸发仪 瑞士布奇公司;,ALPHR Z-4 LD PLUS CHRIST真空冷冻干燥机北京博励行仪器有限公司;AKTA explorer层析仪美国通用电气;热重仪 瑞士梅特勒-托利多。
1.2 实验方法
1.2.1 紫玉米苞叶花色苷的提取 取紫玉米苞叶10g,用刀切成片状,置于搅拌机中粉碎1min。使用提取溶剂为体积分数60%的乙醇水溶液,并用1mol/L的盐酸将提取溶剂的pH调为3,料液比为1∶50,提取温度50℃,提取时间1h,提取次数1次。提取结束后,将提取物进行过滤,其中上清液再放入旋转蒸发仪中60℃旋蒸得到花色苷的粗提取物。
1.2.2 大孔树脂纯化 Amberlite XAD-7大孔树脂预处理后,填装在1.6cm×60cm的填装柱中,将上述粗提物上样,检测波长为520nm,流速为7mL/min,0.5%三氟乙酸的水冲洗后,采用0.5%三氟乙酸的甲醇洗脱,收集520nm处的吸收峰,45℃条件下旋转蒸发得到浓缩液,冷冻干燥成干粉备用。
1.2.3 凝胶树脂纯化 LH-20凝胶树脂预处理后,填装在1.6cm×60cm的填装柱中,将上述干粉溶于超纯水,上样量为0.5mL,流速2mL/min,检测波长为520nm,0.5%三氟乙酸的水∶甲醇=7∶3的溶液为洗脱液。
1.2.4 液质联机鉴定花色苷成分 HPLC设定的参数如下:柱子型号:安捷伦 Zorbax SB-AQ 600bar(1.8μm,100 ×3.0mm);柱温:25℃;流速:0.3mL/min;进样量:3μL;流动相A:0.5%的甲酸水溶液;流动相B:0.5%甲酸乙腈;洗脱梯度:0~30min,10%~60%B;30~40min,60% ~100%B;40~50min,100% ~10%B;DAD检测器:花色苷的定量计算使用检测波长520nm。
MS设定的参数如下:干燥气温度为350℃;N2流速为11L/min;喷雾器压力为30psig;离子扫描范围为100到2200(m/z)。整个过程都是采用的正离子模式。数据使用Agilent Chemstation Rev.A.09.01 software(Agilent,Palo Alto,CA)统计分析。
1.2.5 不同组分花色苷的热重分析 将大孔树脂纯化后的花色苷提取物和凝胶树脂纯化后得到的三个组分,取样 1.5mg,升温速率 10℃/min,温度范围30~200℃。
1.2.6 结果分析 采用Origin7.5软件作图;实验重复3次。
2 结果与讨论
2.1 紫玉米苞叶的花色苷组成
大孔树脂纯化后的紫玉米苞叶花色苷提取物干粉溶于超纯水,经液质联机检测后,其520nm处的图谱如图1所示。

图1 紫玉米苞叶中花色苷的液相图谱Fig.1 HPLCchromatograms of anthocyanidin from purple corn bract
由图1可知紫玉米苞叶花色苷提取物含有6个峰,进一步质谱鉴定各个峰的结构,结果见表1。

表1 紫玉米苞叶花色苷的质谱分析Table 1 Ms data of anthocyanidin from purple corn bract
由表1可知,峰1的母离子质核比为449,二级质谱碎片离子峰在m/z 287处,是由于失去一分子葡萄糖[M-162]+得到的,m/z 287为矢车菊素,此外根据液相色谱出峰顺序等信息及参考其它文献[14-15],推测其结构为矢车菊-3-O-葡萄糖苷。以此类推,峰2到峰6分别鉴定为天竺葵-3-O-葡萄糖苷,芍药-3-O-葡萄糖苷,矢车菊-3-(6′-丙二酰-葡萄糖苷),天竺葵-3-(6′-丙二酰-葡萄糖苷),芍药-3-(6′-丙二酰-葡萄糖苷)。与前人研究结果相似,紫玉米中主要含有矢车菊、天竺葵、芍药素类的花青素[13-15],但是研究表明除了上述六种花青素外,还鉴定出矢车菊-3-(6′-乙基丙二酰-葡萄糖苷),天竺葵-3-(6′-乙基丙二酰-葡萄糖苷),芍药-3-(6′-乙基丙二酰-葡萄糖苷)等[14],可能是紫玉米品种不同所致。
2.2 层析纯化制备紫玉米苞叶花色苷单体
紫玉米苞叶花色苷粗提物进Amberlite XAD-7大孔树脂柱纯化,因为糖、蛋白、有机酸等物质与大孔树脂没有吸附性,因此上样后,先通过0.5%三氟乙酸的水冲洗掉不结合的杂质,而吸附在大孔树脂上的花色苷经0.5%三氟乙酸的甲醇进行洗脱,收集520nm处的吸收峰,60℃条件下旋转蒸发得到浓缩液,进一步过凝胶树脂LH-20,结果如图2所示。
由图2可见,经凝胶树脂纯化后,分别得到三个花色苷组分,进一步通过液质联机检测鉴定三个组分的结构。三个组分的液相图谱如图3所示。
由图3可以看出,第一个组分是两个物质的混合物,第二个组分与第三个组分均只含有一种物质。其中,第二组分液相保留时间与图1的峰1同,进一步进行质谱分析(图4)。由图4可知,此物质的母离子质核比为449,二级质谱碎片离子峰在m/z 287,可见其质谱信息也与图1的峰1同,因此,鉴定其结构为矢车菊-3-O-葡萄糖苷。
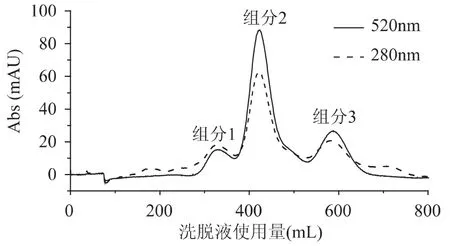
图2 LH-20纯化后图谱Fig.2 UV-vis abs of anthocyanin from purple corn bract purified by LH-20
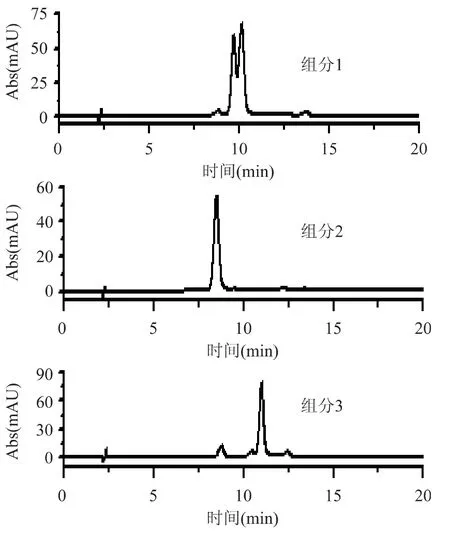
图3 LH-20纯化后的三组分的液相图谱Fig.3 HPLC chromatograph of anthocyanin from purple corn bract purified by LH-20
同样的方法鉴定其他组分的结构,第三个组分的液相保留时间及质谱信息与图1的峰4同,因此组分3主要为矢车菊-3-(6′-丙二酰-葡萄糖苷)。第一个组分的两个峰的液相保留时间及质谱信息与图1的峰2和峰3同,鉴定其是芍药-3-O-葡萄糖苷和天竺葵-3-O-葡萄糖苷的混合物。而经LH-20纯化后未能收集到天竺葵-3-(6′-丙二酰-葡萄糖苷),芍药-3-(6′-丙二酰-葡萄糖苷)。
2.3 不同组分的紫玉米苞叶花色苷热稳定性分析
花色苷的稳定性易受温度的影响,产生热降解,而食品加工过程中热处理是常见工艺环节,花色苷的稳定性是影响花色苷类产品色泽品质的关键。不同结构的花色苷稳定性及功能性不同[16]。以上分离出三个花色苷组分,与总花色苷提取物相比热稳定性结果见图5。
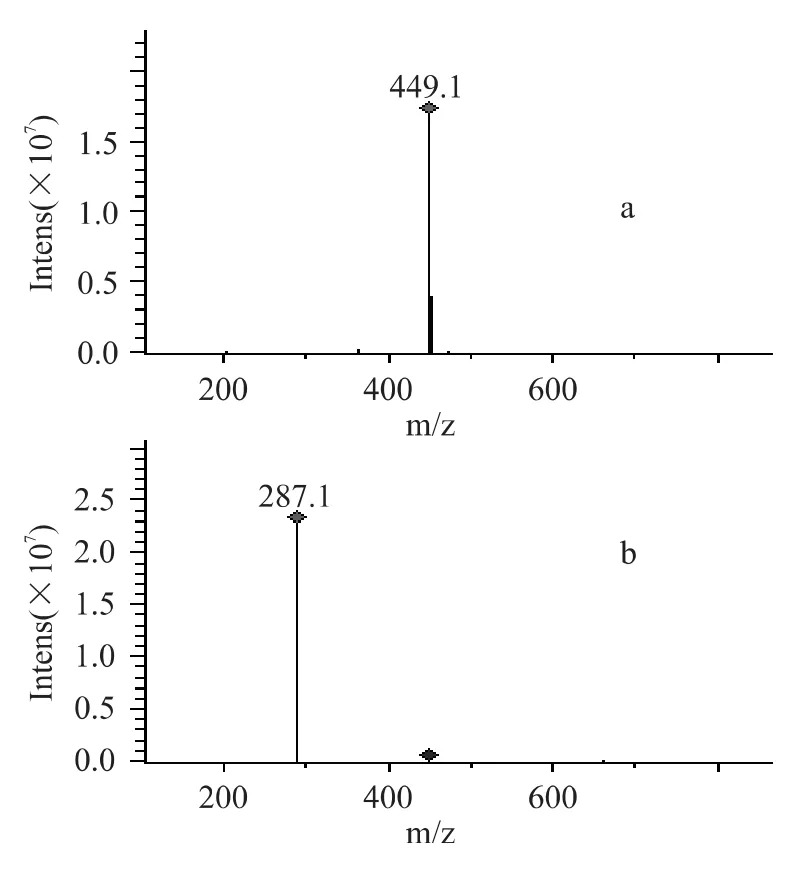
图4 (a)组分2的MS图(b)组分2的MS/MS图Fig.4 (a)MSprofile of portion 1(b)MS/MSprofile of portion 1
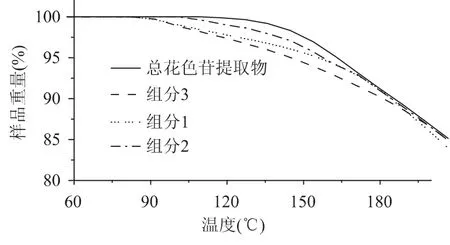
图5 不同组分花色苷的热重分析Fig.5 TG curves of anthocyanins purified by Amberlite XAD-7 and LH-20
由图5可知,组分1和2热稳定性最差,在升温至83℃时,发生降解失重现象;其次是组分3,110℃降解失重;总花色苷最稳定,温度升至118℃时才热解失重。观察其结构发现,组分1和2为芍药-3-O-葡萄糖苷、天竺葵-3-O-葡萄糖苷及矢车菊-3-O-葡萄糖苷,所有花色苷没有酰基化结构;组分3为矢车菊-3-(6′-丙二酰-葡萄糖苷),含有一个酰基化结构。总花色苷提取物除了含有上述花色苷外,还含有天竺葵-3-(6′-丙二酰-葡萄糖苷),芍药-3-(6′-丙二酰-葡萄糖苷),存在三种含有一个酰基化结构的花色苷。可见酰基化结构越多,热失重温度越高,酰基化对花色苷热降解失重具有保护作用。这与前人的研究结果相似,Shimizu等[17]研究表明,酰化基团与发色基团间有较强的作用,使花色苷色素稳定性高。此外本课题组研究表明酰基化花色苷不仅稳定性强,其结合DNA、保护DNA的能力也越强[18],这些结果均为花色苷的加工工艺的选择及功能性的开发提供了理论基础。
3 结论
采用HPLC-MS联用技术,鉴定紫玉米苞叶中存在六种花色苷,经大孔树脂、凝胶树脂分离纯化后得到三个组分,第一个组分为芍药-3-O-葡萄糖苷和天竺葵-3-O-葡萄糖苷的混合物,第二个组分为矢车菊-3-O-葡萄糖苷,第三个组分为矢车菊-3-(6′-丙二酰-葡萄糖苷)。其中含有酰基化花色苷的组分三热稳定性强于没有酰基化结构的组分一和组分二。
[1]孙建霞,张燕,孙志健,等.花色苷的资源分布以及定性定量分析方法研究进展[J].食品科学,2009,30(5):263-268.
[2]赵云荣,王世雷.植物花青素研究进展[J].安徽农业科学,2008,36(8):3095-3097.
[3]Williams C,Grayer R.Anthocyanins and other flavonoids[J].Natural Product Reports.2004,21(4):539-573.
[4]Lu J,Wu DM,Zheng YL,et al.Purple sweet potato color attenuates domoic acid-induced cognitive deficits by promoting estrogen receptor-α-mediated mitochondrial biogenesis signaling in mice[J].Free Radical Biology and Medicine,2012,52(3):646-659.
[5]Hwang YP,Choi JH,Yun HJ,et al.Anthocyanins from purple sweet potato attenuate dimethylnitrosamine-induced liver injury in rats by inducing Nrf2-mediated antioxidant enzymes and reducing COX-2 and iNOSexpression[J].Food and Chemical Toxicology,2011,49(1):93-99.
[6]Malone PE,Hernandez MR.4-Hydroxynonenal,a product of oxidative stress,leads to an antioxidant response in optic nerve head astrocytes[J].Experimental Eye Research,2007,84(3):444-454.
[7]Zhang ZF,Fan SH,Zheng YL,et al.Purple sweet potato color attenuates oxidative stress and inflammatory response induced by d-galactose in mouse liver[J].Food and Chemical Toxicology,2009,47(2):496-501.
[8]Adelia CB,Steve LT.Sweet potato:A review of its past,present,and future role in human nutrition[J].Advances in Food and Nutrition Research,2007,52:51-59.
[9]岳静,方宏筠.紫甘薯红色素体外抑菌性初探[J].辽宁农业科学,2005(2):47.
[10]胡林子,马永全,于新.紫甘薯色素抗菌与抗氧化作用研究进展[J].食品工业科技,2011,32(2):389-392.
[11]韩永斌,朱洪梅,顾振新,等.紫甘薯花色苷色素抑制金黄色葡萄球菌作用初探[J].食品科学,2008,29(10):59-62.
[12]Reyes L,Cruberis-zevakkis L.Degradation kinetics and colour of anthocyanins in aqueous extracts of purple-and redflesh potatoes(Solanum Tuberosum L.)[J].Food Chemistry,2007,100:885-894.
[13]Castañeda-Ovando A,Pacheco-Hernández M,Páez-Hernández M,et al.Chemical studies of anthocyanins:A review[J].Food Chemistry,2009,113:859-871.
[14]Pascual-Teresa SD,Santos-Buelga C,Rivas-Gonzalo J C.LC-MS analysis of anthocyanins from purple corn cob[J].Journal of the Science of Food and Agriculture,2002,82:1003-1006.
[15]赵晓燕.紫玉米花色苷组分鉴定及功能性质的研究[D].北京:中国农业大学,2009.
[16]卢钰.花色苷研究进展[J].山东农业大学学报,2004,35(2):315-320.
[17]Shimizu T,Ichi T,Iwabuchi H,et al.Structure of diacylated anthocyanins from red radish(Raphanus sativus L.)[J].Food Chem,1996,90(3):5-9.
[18]Wang Dan,Wang Xirui,Zhang Chao,et al.Calf thymus dnabinding ability study of anthocyanins from purple sweet potatoes(Ipomoea batatas L.)[J].J Agric Food Chem,2011,59:7405-7409.
