慢性吗啡处理对大鼠交感神经节pCREB和CREB mRNA表达的影响
2013-12-07陈家欢黄晓亮于洪波
何 萍,陈家欢,黄晓亮,于洪波,莫 宁
(广西医科大学药学院1.药理学教研室2.中心实验室,广西南宁 530021)
阿片类依赖可造成明显的自主神经系统特别是交感神经系统功能的改变或损害,阿片类依赖的戒断症状中交感神经亢进症状亦为其重要表现之一[1]。交感神经节是联系交感神经中枢和效应器的神经核团,阿片类依赖对交感神经节的影响的研究很少。本研究组以往研究结果发现,慢性吗啡处理后,交感神经节——颈上神经节(SCG)的快兴奋性突触传递[2]及突触界面结构[3]发生了适应性改变;环腺苷酸(cAMP)水平也存在适应性上调[4]。本研究在以剂量递增法建立慢性吗啡依赖及戒断模型的基础上,运用免疫组织化学方法和RT-PCR法分别检测磷酸化的环腺苷酸反应元件结合蛋白(phosphorylated cAMP response element binding protein,pCREB)和 CREB mRNA在SCG中的表达,进一步研究慢性吗啡处理后交感神经节适应性改变的受体后信号转导机制。
1 材料
1.1 动物 清洁级♂Wistar大鼠共40只,质量190 g~210 g,由广西医科大学实验动物中心提供,合格证号:SCXK桂2003-0003。
1.2 主要药品与试剂 盐酸吗啡注射液,批号:080306,沈阳第一制药厂生产。盐酸纳洛酮,Aldrich公司产品。兔抗pCREB多克隆抗体,工作浓度1∶200,北京市首都医科大学宣武医院多肽室制备;S-P免疫组织化学染色试剂盒(即用型)及DAB显色剂:北京中杉金桥生物技术有限公司产品。Trizol试剂,美国Invitrogen公司;cDNA逆转录试剂盒,立陶宛MBI公司;引物由上海生工生物工程技术服务有限公司合成。
1.3 仪器 日本OPATICAL公司OLYMPUS VANOX显微镜照相系统;德国leica公司 DMR+550型病理图像分析仪;美国Thermo公司高性能PCR扩增仪;美国Bio-Rad公司Gel Doc2000型凝胶电泳成像分析系统。
2 方法
2.1 动物分组及处理 动物随机分为4组(n=10):正常对照组、吗啡急性给药组、吗啡依赖组和吗啡戒断组。各组处理如前文献所述[4],即吗啡依赖组和吗啡戒断组大鼠连续皮下注射吗啡5 d建立慢性吗啡依赖大鼠模型,d 1~5每次剂量分别为10、20、30、40、50 mg·kg-1,每日 2 次;正常对照组和吗啡急性给药组大鼠皮下注射等体积生理盐水共5 d。正常对照组、吗啡急性给药组和吗啡依赖组大鼠分别在d 6晨注射生理盐水、吗啡20 mg·kg-1、吗啡50 mg·kg-14 h后取材;吗啡戒断组大鼠在末次注射吗啡50 mg·kg-14 h后,腹腔注射纳洛酮4 mg·kg-1催促戒断症状,并在注射纳洛酮1 h后进行取材。取材时,腹腔注射戊巴比妥钠60 mg·kg-1深度麻醉大鼠后,镜下迅速摘取双侧 SCG,备用。
2.2 pCREB蛋白免疫组织化学检测 采用S-P法,按说明进行操作。显微镜下选入细胞均为细胞核呈棕褐色、与本底相比为中等到高度染色的阳性细胞。计算整个SCG内的阳性免疫产物面积百分率反映蛋白表达水平。
阳性免疫产物面积百分率%=阳性免疫产物面积/SCG总测量面积×100%
2.3 CREB mRNA的RT-PCR法检测 引物序列按文献[5],由上海生工生物工程技术服务有限公司合成,序列如下:GADPH sense primer 5’-TCA TTG ACC TCA ACT ACA TG-3’,antisense primer 5’-GCA GTG ATG GCA TGG ACT GT-3’(439 bp);CREB sense primer 5’-TCA GCC GGG TAC TAC CAT TC-3’,antisense primer 5’-TCT CTT GCT GCT TCC CTG TT-3’(252 bp)。PCR 循环参数为:94℃45 s,50℃ 45 s,72℃ 1 min,共 30 个循环。扩增产物琼脂糖凝胶电泳,检测各扩增带的光密度值,以GADPH校正作相对定量分析,结果以两者的光密度比值表示。
3 结果
3.1 SCG中pCREB蛋白含量变化 pCREB免疫活性阳性产物主要在细胞核,胞质相对淡染。以核阳性免疫产物面积百分率反映蛋白表达水平。结果显示:与正常对照组相比,吗啡急性给药组大鼠SCG中pCREB蛋白含量明显降低(P<0.05);吗啡依赖组大鼠SCG的pCREB蛋白含量回到正常对照组水平,并有增高趋势(与正常对照组比较,P>0.05;与吗啡急性给药组比较,P<0.01);吗啡戒断组大鼠SCG中pCREB蛋白含量明显高于正常对照组(P<0.01)。结果见Tab 1和Fig 1。
Tab 1 Expression of pCREB and CREB mRNA in rat SCG(±s,n=10)

Tab 1 Expression of pCREB and CREB mRNA in rat SCG(±s,n=10)
*P<0.05,**P<0.01 vs control;△△P<0.01 vs morphine acute group
Group pCREB positive area percentage/%CREB/GADPH mRNA ratio Control 1.58 ±0.41 0.65 ±0.18 Mor acute 0.91 ±0.25* 0.58 ±0.21 Mor dependent 1.92 ±0.55ΔΔ 0.72 ±0.26 Mor withdrawal 2.82 ±0.94**ΔΔ0.61 ±0.19
3.2 SCG中 CREB mRNA表达变化 各组间CREB mRNA表达水平无差异(P>0.05)。结果见Tab 1和 Fig 2。
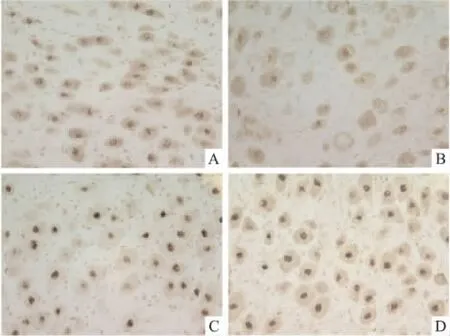
Fig 1 Expression of pCREB in SCG(immunochemistry×400)
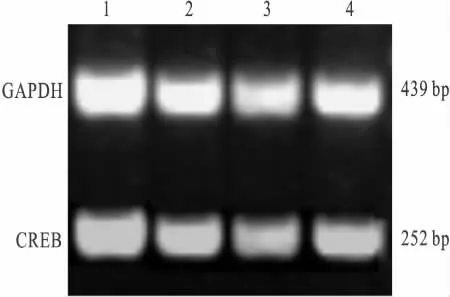
Fig 2 The expression of CREB mRNA in SCG
4 讨论
反复应用阿片类药物,机体启动适应机制,神经元及突触功能发生适应性改变,导致神经元及神经网络功能发生长期改变,是机体形成药物依赖和耐受的机制之一[6]。我们以往的研究结果发现[2-4],吗啡急性给药能抑制交感神经节SCG的快兴奋性突触传递并降低SCG中cAMP含量;吗啡慢性处理后交感神经节SCG的突触传递、突触界面结构及cAMP含量均发生了适应性改变,表现为吗啡抑制快兴奋性突触传递的作用明显减弱,突触界面结构中突触后致密物厚度(PSD)增厚、突触间隙变窄,cAMP含量较吗啡急性给药组明显增加;纳洛酮处理却可增加SCG快兴奋性突触传递并进一步提高cAMP含量。因此推测cAMP的适应性上调可能是吗啡慢性处理后交感神经节突触适应性改变的受体后信号转导机制之一。
CREB是一种核蛋白,是刺激诱导转录因子的主要成员,CREB的活化必须由磷酸化介导,多种通路已被证实可磷酸化CREB,其中研究最为透彻的为cAMP-cAMP依赖蛋白激酶A(PKA)通路对CREB的磷酸化。CREB分子N端的激酶诱导结构域(kinase inducible domain,KID)区包含有许多种蛋白激酶对CREB分子进行磷酸化的部位,其中第133位的丝氨酸残基(Ser-133)是PKA的磷酸化位点。阿片类药物与其受体结合后,通过升高胞浆内cAMP水平激活PKA,使转录因子CREB的Ser133磷酸化而激活CREB,使其与DNA调控区的cAMP反应元件(CRE)相结合,激活靶基因的转录,诱发迟发而持久的基因表达,使短时程的生物学效应转变为长时程的生物学效应,可造成神经电活动的持久的改变,并导致神经元胞体、突起或突触结构发生结构上的改变,参与慢性应用吗啡引起的神经元和突触的可塑性和适应性改变[7]。阿片类药物依赖的形成过程中,伴随细胞内cAMP信号转导过程的变化,蓝斑区域也相应发生CREB磷酸化[8],而敲除CREB基因的小鼠吗啡戒断反应的行为改变明显减轻[9],因此,推测cAMP-CREB通路的功能改变是形成和维持阿片依赖的重要机制。
在本研究中,吗啡急性用药,降低了大鼠SCG的pCREB蛋白含量;吗啡慢性使用后,pCREB蛋白有所上调,并在纳洛酮催促戒断后进一步增高;但各组大鼠的CREB mRNA表达水平均无明显改变。CREB磷酸化适应性上调的改变与cAMP、快兴奋性突触传递及突触界面结构适应性改变结果相一致,因此我们推测,通过cAMP和pCREB的适应性上调,cAMP-CREB通路将可能通过调节相关神经元蛋白基因的转录,导致慢性吗啡处理后交感神经节突触传递及突触界面结构的适应性改变,从而参与吗啡耐受、依赖和戒断的发生和发展。
[1]邓跃林,周利平.海洛因中毒研究新进展[J].中国处方药,2003,11:68 -72.
[1]Deng Y L,Zhou L P.New progress of heroin intoxication[J].Chin Prescription Drug,2003,11:68 -72.
[2]何 萍,莫 宁,于洪波.吗啡耐受与依赖对大鼠交感神经节快兴奋性突触传递的影响[J].中国药理学通报,2006,22(10):1206-11.
[2]He P,Mo N,Yu H B.Effects of morphine tolerance and dependence on the fast excitatory synaptic transmission in sympathetic ganglia of rats[J].Chin Pharmacol Bull,2006,22(10):1206 -11.
[3]何 萍,韦 力,莫 宁,于洪波.慢性吗啡处理对大鼠交感神经节形态学的影响[J].广西医科大学学报,2000,26(2):216-8.
[3]He P,Wei L,Mo N,Yu H B.Effects of chronic morphine treatment on morphological changes in sympathetic ganglia of rats[J].J Guangxi Med Univ,2009,26(2):216 -8.
[4]何 萍,莫 宁,于洪波.慢性吗啡处理对大鼠交感神经节cAMP和cGMP水平的影响[J].中国药理学通报,2009,25(1):109-12.
[4]He P,Wei L,Mo N,Yu H B.Effects of chronic morphine treatment on contents of cAMP and cGMP in sympathetic ganglia of rats[J].Chin Pharmacol Bull,2009,25(1):109 - 12.
[5]李国海,黄明生,姜厚壁,俞俊洪.吗啡依赖大鼠脑内相关脑区CREBmRNA的表达[J].中国神经精神疾病杂志,2002,28(5):333-5.
[5]Li G H,Huang M S,Jiang H B,Yu J H.The expression of CREB mRNA in some brain regions of morphine-dependence rats[J].Chin J Nervous Mental Dis,2002,28(5):333 -5.
[6]陈晓岚,刘景根,池志强.阿片成瘾的细胞分子机制[J].中国药理学通报,2005,21(8):901 -4.
[6]Chen X L,Liu J G,Chi Z Q.Molecular and cellular mechanisms of opiate addiction [J].Chin Pharmacol Bull,2005,21(8):901-4.
[7]李 华,王 丽.CREB参与慢性应用吗啡引起的神经元和突触的可塑性和适应性[J].河北医药,2011,33(11):2024 -6.
[7]Li H,Wang L.CREB involves in neuron and synapsis plasticity and adaptability caused by morphine[J].Hebei Med J,2011,33(11):2024-6.
[8]Guitart X,Thompson M A,Mirante C K,et al.Regulation of cyclic AMP response element-binding protein(CREB)phosphorylation by acute and chronic morphine in the rat locus coeruleus[J].J Neurochem,1992,58(3):1168-71.
[9]Maldonado R,Blendy J A,Tzavara E,et al.Reduction of morphine abstinence in mice with a mutation in the gene eucoding CREB[J].Science,1996,273(5275):657 - 9.