三七皂苷R1对LPS诱导的小鼠心肌损伤的保护作用
2013-12-07孙桂波吕圭源陈素红孙晓波
吴 颖,孙 冰,肖 静,孙桂波,吕圭源,李 明,陈素红,孙晓波
(1.温州医学院药学院浙江温州 325035;2.中国医学科学院药用植物研究所北京 100193;3.浙江中医药大学中药研究所浙江杭州 310053)
由内毒素引起的炎症性疾病是由局部病原菌感染,而最终导致机体发生全身系统性反应。可引起心肌收缩力减弱,心肌受损,严重影响心脏功能。内毒素可激活单核巨噬细胞系统,释放出肿瘤坏死因子(TNF-α)、白细胞介素(IL-1β)等许多细胞因子和炎症介质,导致细胞、组织、器官的损伤[1]。
中药三七是我国的传统珍贵药材,具有止血、散瘀、消肿、止痛等功效,其以三七或总皂苷制成的制剂在临床上广泛用于心、脑血管疾病的治疗[2]。三七皂苷R1属于原人参三醇型,是三七中最具有代表的特征性化合物,具有广泛的药理作用,已作为冠心丹参滴丸的主要成分用于治疗心肌缺血性疾病[3]。抗炎是三七皂苷R1的重要药理作用之一,以往研究已证实三七皂苷R1对防治血管内皮细胞损伤有较好疗效[4-5],但关于 R1保护心肌损伤的药理机制研究较少。本研究采用内毒素脂多糖LPS(lipopolysaccharide,LPS)诱导小鼠心肌损伤,建立急性内毒素心肌损伤模型[6]。现已证实,LPS能刺激NF-κB的活化,进而启动VCAM-1和 ICAM-1的表达而参与心肌损伤的发生。本实验通过检测相关炎症因子表达水平及在心肌组织中的浸润情况,从而阐明中药三七有效防治心肌损伤的药理基础和物质基础,为三七有效防治心肌损伤疾病提供重要的实验依据。
1 材料
1.1 实验动物 C57BL/6J小鼠,♂,8~12周龄,质量(23±2)g,由中国医学科学院医学实验动物研究所动物中心提供。随机分为6组,每组5~8只:正常对照组(CTRL组)、模型组(LPS组)、预处理低剂量组(L+R1低组)、预处理中剂量组(L+R1中组)、预处理高剂量组(L+R1高组)和阳性药组(3-去氮腺苷,3-deazaadenosine,c3Ado组)或单给药组(R1组)。分别预防性给与三七皂苷R1(5、12.5或25 mg·kg-1;ip)3 日后,注射 LPS(10 mg·kg-1,ip),作用8 h。
1.2 药品与试剂 三七皂苷R1,购自上海融禾医药科技发展有限公司;3-去氮腺苷、LPS,均购自Sigma公司;ED-1、CD-11b抗体,均购自 Abcam公司;IκBα、NF-κB 抗体,均购自 Santa Cruz 公司;ELISA试剂盒,购自达科为公司和逸峰生物公司。其他试剂均为国产分析纯,水为去离子水。
2 方法
2.1 超声心动 C57BL/6J小鼠30只,每组5只,共6组。正常对照组腹腔注射等量生理盐水,连续处理4 d。LPS组腹腔注射生理盐水,连续处理3 d后注射LPS(10 mg·kg-1,ip),作用8 h,建立内毒素心肌损伤模型。预处理组分别预防性给予三七皂苷 R1(5、12.5 或25 mg·kg-1,ip),连续处理3 d 后注射LPS(10 mg·kg-1,ip),作用8 h。阳性药组预防性给予c3Ado(10 mg·kg-1,ip),连续处理3 d后注射 LPS(10 mg·kg-1,ip),作用 8 h。用 50 mg·kg-1的三溴乙醇进行麻醉,备皮,超声心动测射血分数(EF)、缩短分数(FS)、左心室舒张末期内径(LVDd)、左心室收缩期内径(LVDs)、左心室舒张末期容积(LVVd)和左心室收缩末期容积(LVVs)[7-8]。
2.2 免疫组化分析 麻醉后灌流取心脏,经过固定、脱水、透明、浸蜡、包埋后,切片(厚4~5 μm),石蜡切片常规脱蜡至水,3%H2O2室温孵育10 min,蒸馏水洗3次,抗原修复,以正常山羊血清室温孵育20 min封闭,滴加稀释一抗ED-1抗体(1∶400),CD11b抗体(1 ∶400)。37℃孵育2 h,PBS液冲洗,HRP室温孵育30 min,PBS液冲洗,DAB显色,蒸馏水洗涤后以苏木素复染,脱水,透明,封片[9]。显微镜下观察,染色明显的组织切片胞质内出现棕色定位明确的颗粒物质为阳性细胞表达。250倍放大,图像分析时每个切片取5个视野,剔除染色不均,皱褶图像。
2.3 Western blot 低温下将心脏组织剪碎,加入RIPA蛋白裂解液(含蛋白裂解液、蛋白酶抑制剂和磷酸酶抑制剂)快速匀浆、裂解、离心提取组织块中总蛋白,用BCA法定量,95℃变性5 min。取等量样本上样于10%SDS-聚丙烯酰胺凝胶电泳分离,将蛋白质转移至PVDF膜上[10]。免疫反应:摇床上摇动封闭1 h,然后加入 β-actin、IκBα 和 NF-κB 的一抗(均为1∶1 000稀释),4℃过夜。次日,室温下TBST洗膜,二抗反应1 h后洗膜、曝光显影。以βactin作内标参考,灰度分析。
2.4 ELISA试剂盒 小鼠麻醉灌流取心脏,加入生理盐水,用手术剪将组织剪碎,匀浆器匀浆。10 000 r·min-1,5 min离心取组织液上清。根据试剂盒说明书操作[11],酶标仪450 nm波长处测定吸光度(A)值。
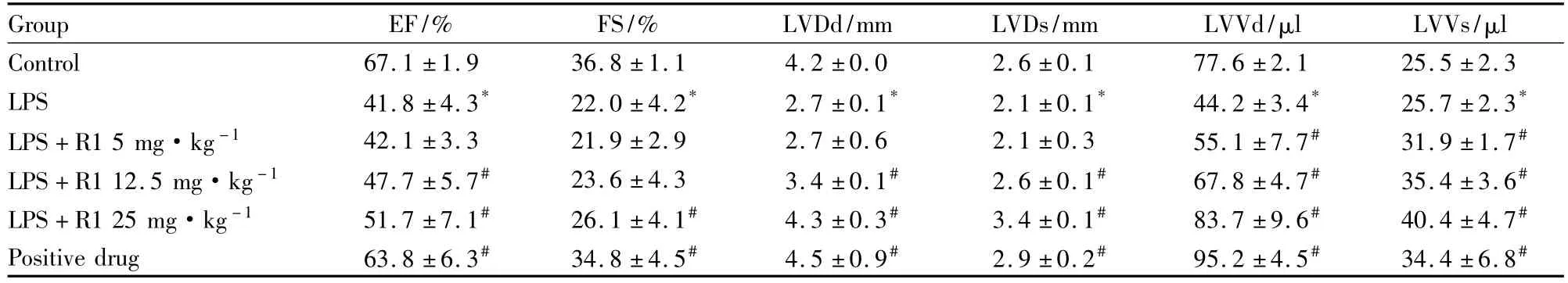
Tab 1 Cardiac function measured by echocardiography
3 结果
3.1 超声心动测小鼠心功能 超声心动结果显示不同浓度的三七皂苷R1能有效地防止LPS引起的心肌功能的衰退,且其作用存在剂量依赖性。从射血分数(EF)和缩短分数(FS)结果可以看出,与正常组相比,模型组的EF和FS都明显降低,模型组心肌收缩功能明显改变(P<0.05);与模型组相比,三七皂苷R1高剂量组(25 mg·kg-1)处理后EF和FS明显恢复(P<0.05),见Tab 1。
3.2 免疫组化分析ED-1+炎性细胞的浸润 巨噬细胞作为心肌组织的主要炎症浸润细胞存在于许多原发和继发性心脏疾病中。LPS刺激后,使巨噬细胞同血管内皮细胞间粘附性加强,进而透过血管内皮,进入心肌组织中,导致局部炎症反应。对小鼠进行ED-1(单核巨噬细胞特异性抗原)染色可以看出,与正常组相比,模型组心肌组织中单核巨噬细胞的量增加了2倍;与模型组相比,高剂量三七皂苷R1(25 mg·kg-1)预处理组中单核巨噬细胞的量明显减少(P<0.05)。R1明显抑制了炎症反应中单核巨噬细胞在心肌细胞间的聚集。单给药组与正常组相比无明显差别,见Fig 1。
3.3 免疫组化分析CD11b+炎性细胞的浸润 白细胞和中性粒细胞明显增高是炎症反应的特征之一。正常情况下,CD11b(一种白细胞黏附因子)仅在单核细胞和中性粒细胞膜上呈低特异性表达,LPS刺激后,这些细胞被激活,通过与内皮细胞表达的细胞间黏附因子-1(ICAM-1)相互作用而介导白细胞和内皮细胞黏附,继而损伤组织。通过量化心肌组织中白细胞和中性粒细胞可反映小鼠炎症情况。CD11b染色结果显示,与正常组相比,中性粒细胞和巨噬细胞的量在LPS诱导后增加了14倍;与模型组相比,高剂量三七皂苷R1(25 mg·kg-1)预处理后,中性粒细胞和巨噬细胞的量降低到模型组的1/7,抑制了中性粒细胞和巨噬细胞的大量增加,见Fig 2。
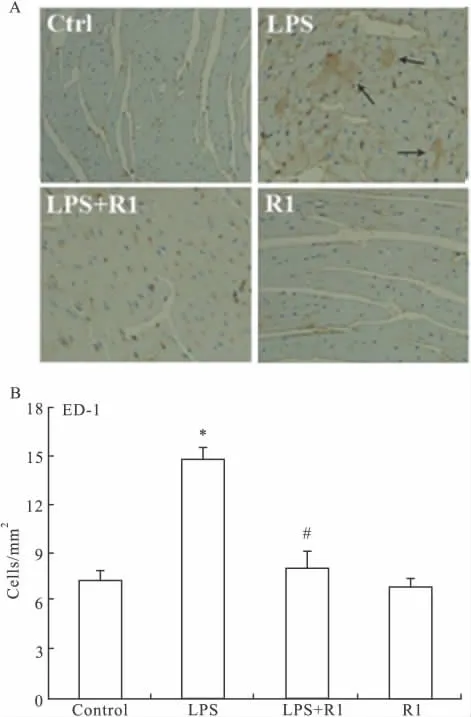
Fig 1 Immunohistochemical scoring of LPS-induced leukocyte accumulation within postcapillary venules of the heart after Notoginsenoside R1 treatment
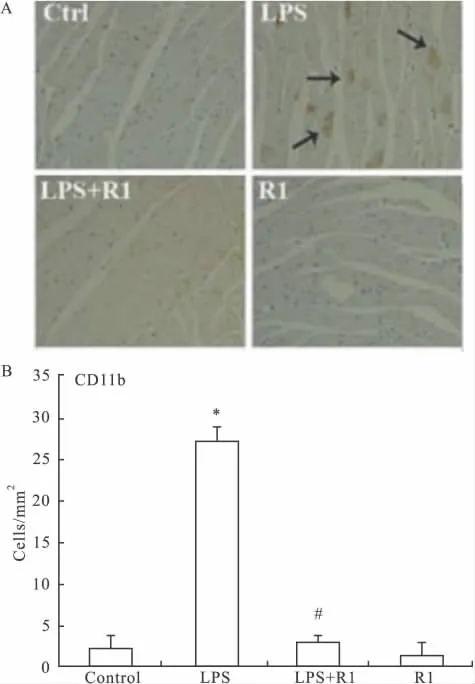
Fig 2 Immunohistochemical scoring of LPS-induced leukocyte accumulation within postcapillary venules of the heart after Notoginsenoside R1 treatment
3.4 心肌中 IκBα 和 NF-κB活性的变化 通过Western blot法检测心脏组织蛋白中IκBα和NF-κB的表达。如Fig 3A所示,LPS处理后2 h内IκBα的表达随时间降低。应用三七皂苷R1后,可明显抑制IκBα降解。与0时相比,在2 h内IκBα的表达没有明显变化。由此可知,三七皂苷R1对LPS诱导的IκBα的降解有抑制作用。
如Fig 3B所示,LPS作用下,NF-κB p-65亚基的磷酸化明显增多,应用三七皂苷R1后抑制了NF-κB的活化。NF-κB是一种细胞内重要的核转录因子,通常以无活化形式存在于细胞质中,活化后广泛参与炎症反应[12]。VCAM-1、ICAM-1基因的诱发依赖于转录因子NF-κB的激活。实验结果表明,高剂量三七皂苷R1(25 mg·kg-1)能阻断NF-κB信号通路,抑制NF-κB活化入核,避免心肌细胞受到过量炎症因子的影响,见Fig 3。
3.5 ELISA 测 TNF-α、IL-1β、VCAM-1 和 ICAM-1 肿瘤坏死因子(TNF-α)和白细胞介素(IL-1β)是引起心肌损伤最重要的细胞因子。我们通过ELISA试剂盒的方法检测TNF-α水平,发现在LPS刺激2 h后有明显的提升,8 h后回归到正常水平。中剂量(12.5 mg·kg-1)、高剂量(25 mg·kg-1)的三七皂苷R1能有效抑制LPS刺激后TNF-α和IL-1β水平的升高,且其作用呈剂量依赖性(P<0.05)。血管细胞黏附因子(VCAM-1)和细胞间黏附因子(ICAM-1)参与中性粒细胞黏附心肌细胞释放细胞毒过程,在心肌损伤过程中起关键作用。实验结果发现三七皂苷R1也能抑制LPS处理后心肌组织中VCAM-1、ICAM-1的增长(P<0.05)。单给药组与正常组差异无显著性。见Tab 2。
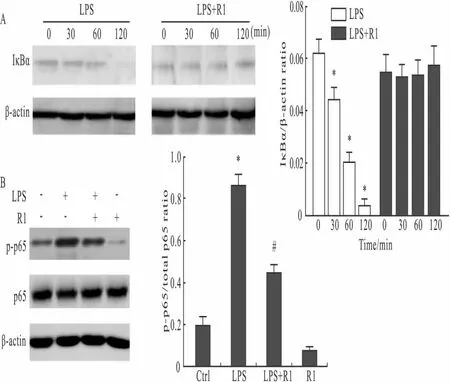
Fig 3 Effect of Notoginsenoside R1 on LPS-induced myocardial IκBα (A)and NF-κB(B)activation
Tab 2 TNF-α,IL-1β,VCAM-1 and ICAM-1 levels in cardiac tissue by ELISA(±s,n=8)
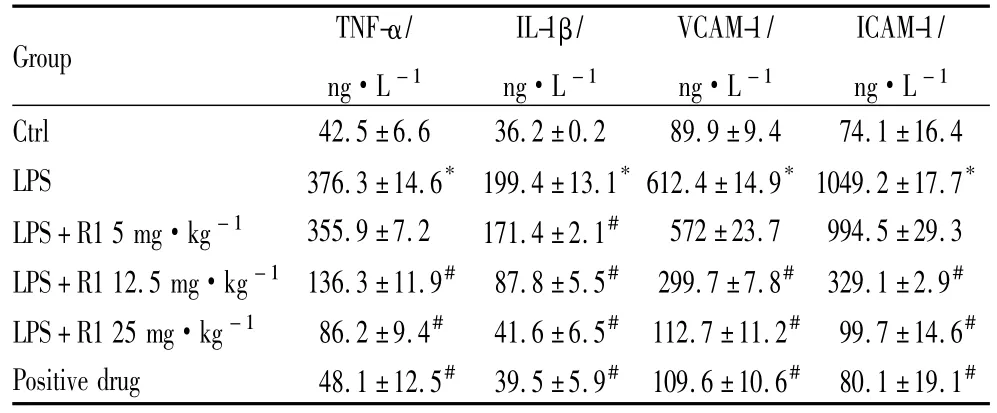
Tab 2 TNF-α,IL-1β,VCAM-1 and ICAM-1 levels in cardiac tissue by ELISA(±s,n=8)
*P<0.05 vs control;#P<0.05 vs model.
Group TNF-α/ng·L-1 IL-1β/ng·L-1 VCAM-1/ng·L-1 ICAM-1/ng·L -1 Ctrl 42.5±6.6 36.2±0.2 89.9±9.4 74.1±16.4 LPS 376.3±14.6* 199.4±13.1*612.4±14.9*1049.2±17.7*LPS+R1 5 mg·kg-1 355.9±7.2 171.4±2.1# 572±23.7 994.5±29.3 LPS+R1 12.5 mg·kg-1 136.3±11.9# 87.8±5.5# 299.7±7.8# 329.1±2.9#LPS+R1 25 mg·kg-1 86.2±9.4# 41.6±6.5# 112.7±11.2# 99.7±14.6#Positive drug 48.1±12.5# 39.5±5.9# 109.6±10.6# 80.1±19.1#
4 讨论
实验结果显示:LPS组小鼠心肌组织中TNF-α等炎症因子以及CD11b等炎性细胞水平均升高,心肌收缩功能发生改变,提示内毒素LPS可导致心肌细胞释放炎症因子,诱导炎性细胞浸润,最终导致心功能的下降。三七皂苷R1对心肌组织中TNF-α等炎症因子的水平具有降低作用,能明显抑制心肌组织中中性粒细胞及单核巨噬细胞等炎性细胞的大量浸润,并明显改善心功能,产生心脏保护作用。
近年研究表明,心脏移植、体外循环感染等因素可诱发机体内内毒素水平升高,引发心肌炎症[13]。抑制炎症因子的激活对于心肌损伤的防治有重要价值。过量炎性细胞因子之间相互作用产生网络效应,导致炎症反应,是心肌组织损伤的病理基础之一。大量的中性粒细胞能释放过量的炎症因子和细胞因子,加重炎症反应,并吸引更多的中性粒细胞进入组织,形成恶性循环,导致组织完全被破坏。文献显示,LPS刺激会使细胞因子VCAM-1和ICAM-1表达上调[14]。本实验结果显示,三七皂苷R1作用后能抑制以上细胞因子的表达,阻止局部中性粒细胞和巨噬细胞的大量侵入。
三七皂苷R1能够降低LPS处理之后心肌组织中升高的细胞因子TNF-α水平。TNF-α是一种自分泌的作用因子,在炎症反应中参与了心肌损伤的形成和发展,其表达水平在LPS刺激后增高,促进了白细胞和内皮细胞的黏附和相互作用,使粒细胞向炎症区域的浸润大大增加,从而导致心肌损伤[15]。巨噬细胞的激活使得心肌细胞中产生TNF-α,实验结果可以看出三七皂苷R1可以抑制LPS诱导产生TNF-α和IL-1β,防止心肌受损。因此推断,TNF-α可能是一个直接可对心肌产生抑制作用的细胞因子。
本实验发现,三七皂苷R1的作用是通过抑制转录因子NF-κB的活化来预防炎症发生的。现已证实,心肌梗死的过程中,NF-κB是调节细胞因子、趋化因子和黏附因子表达的关键分子。梗死发生后,NF-κB激活转移入核,与DNA链上的特异性部位结合,进而启动炎症因子等相关基因转录,从而调控 ICAM-1、VCAM-1、TNF-α 和 IL-1β 等炎症因子的表达[16]。由此可预见,三七皂苷R1有可能用于治疗因NF-κB的转录引起的病症,如缺血/再灌注损伤、心肌细胞凋亡等。已有报道,NF-κB的抑制剂能够有效治疗内毒素引起的炎症反应。抑制NF-κB的活化,将对心肌组织起到一定的保护作用。
综上所述,我们发现三七皂苷R1能够阻止由内毒素LPS引起的心肌收缩功能减弱,抑制炎症反应的发生,防止心肌损伤。我们可以尝试将三七皂苷R1的抗炎特性开发作为组织受损、器官衰竭的抑制剂。因此,我们可以把三七皂苷R1应用于预防由炎症引起的心肌损伤,在临床上具有一定应用前景。
[1]袁红艳,张 晔,王 丹,崔炯漠等.柞树皮对脂多糖和D-氨基半乳糖诱导败血症休克小鼠的保护作用[J].时珍国医国药,2011,22:2886-7.
[1]Yuan H Y,Zhang Y,Wang D,et al.Protective effect of quercus mongolica stem bark against sepsis shock induced by Li-popolysaccharide and D-galactosamine in mice[J].Lishizhen Med Mat Med Res,2011,22:2886-7.
[2]Gu Q,Yang X P,Bonde P,et al.Inhibition of TNF-alpha reduces myocardial injury and proinflammatory pathways following ischemia-reperfusion in the dog[J].Cardiovasc Pharmacol.2006,48(6):320-8.
[3]唐旭东,姜建青,刘宝玉,等.三期总皂苷对心肌缺血再灌注损伤保护作用的分子机制[J].安徽中医学院学报,2003,22:34-8.
[3]Tang X D,Jiang J Q,Liu B Y,et al.Molecular mechanism of protective effect of total saponins of panax notoginseny against myocardial ischemia reperfusion injury[J].J Anhui TCM Coll,2003,22:34-8.
[4]Bhattacharya K,Farwell K,Huang M,et al.Mast cell deficient W/Wv mice have lower serum IL-6 and less cardiac tissue necrosis than their normal littermates following myocardial ischemia-reperfusion[J].Int J Immunopathol Pharmacol,2007,20(1):69-74.
[5]郭钰琪,齐冬梅,郝 钰,等.三七皂苷R1调节炎性T细胞亚群保护血管内皮的实验研究[J].中国药理学通报,2012,28(2):240-4.
[5]Guo Y Q,Qi D M,Hao Y,et al.Regulation of sanchinoside R1 on inflammatory T lymphocytes in protecting vascular endothelium lesion in ApoE-/-mice[J].Chin Pharmacol Bull,2012,28(2):240-4.
[6]Braun-Dullaeus R C,Dietrich S,Schoaff M J.Protective effect of 3-deazaadenosine in a rat model of lipopolysaccharide-induced myocardial dysfunction[J].Shock,2003,19:245-51.
[7]Zhou H,Qian J,Li C,et al.Attenuation of cardiac dysfunction by HSPA12B inendotoxin-induced sepsis in mice through a PI3k-dependent mechanism[J].Cardiovascul Res,2011,89:109-18.
[8]叶 强,陈良海,刘应才,等.辛伐他汀通过Akt/GSP3β 通路抑制心肌梗死后心肌细胞凋亡[J].中国药理学通报,2011,27(12):1656-60.
[8]Ye Q,Chen L H,Liu Y C,et al.Inhibitory effect of simvastatin on cardiomyocyte apoptosis through Akt/GSK3β pathway after myocardial infraction[J].Chin Pharmacol Bull,2011,27(12):1646-60.
[9]罗国刚,樊文静,袁兴运,等.天麻皂苷对三叉神经节离体培养后降钙素基因相关肽表达影响的机制研究[J].药学学报,2011,46(12):1451-6.
[9]Luo G G,Fan W J,Yuan X Y,et al.The pharmacological mechanism of gastrodin on calcitonin gene-related peptide of cultured rat trigeminal ganglion[J].Acta Pharm Sin,2011,46(12):1451-6.
[10]许成芳,李小毛,李 田,王小韵.紫杉醇对PTEN不同状态的子宫内膜癌细胞株的作用及其机制探讨[J].中国药理学通报,2011,27(11):1528-32.
[10]Xu C F,Li X M,Li T,Wang X Y.The effect of taxol on endometrial cancer cells with different PTEN status[J].Chin Pharmacol Bull,2011,27(11):1528-32.
[11]Cao W J,Zhang W,Liu J J,Wang Y.Paeoniflorin improves survival in LPS-challenged mice through the suppression of TNF-αand IL-1β release and qugmentation of IL-10 productiom[J].ELISEVIER,2011,11:172-8.
[12]龙石银,张彩平,高细强,等.NF-κB/IκB在二苯乙烯苷抑制过氧化氢诱导内皮细胞凋亡中的表达变化[J].中国药理学通报,2011,27(10):1353-7.
[12]Long S Y,Zhang C P,Gao X Q,et al.Effects of 2,3,5,4’-tetrahydroxystilbene-2-O-β-D-Aglucoside on the NF-κB/IκB and apoptosis of HUVECs induced by H2O2[J].Chin Pharmacol Bull,2011,27(10):1353-7.
[13]安群星,贾 宏,刘利兵,等.己酮可可碱对内毒素血症大鼠心肌炎症的抑制作用[J].广东医学,2004,25(12):1386-7.
[13]An Q X,Jia H,Liu L B,et al.Protective effect of pentoxifylline on the inflammation of myocardium in endotoxemia-affected rats[J].Guangdong Med J,2004,25(12):1386-7.
[14]Henninger D D,Panes J,Eppihimer M,et al.Cytokine-induced VCAM-1and ICAM-1expression in different organs of the mouse[J].J Immunol,1997,158:1825-32.
[15]Sugano M,Hata T,Tsuchida K,et al.Local delivery of soluble TNF-alpha receptor 1 gene reduces infarct size following ischemia/reperfusion injury in rats[J].Mol Cell Biochem,2004,266(1/2):127-32.
[16]张翼冠,李晓辉,樊继山,等.三七总皂苷通过抗炎和调血脂作用抑制大鼠动脉粥样硬化形成[J].现代生物医学进展,2007,7(11):1601-5.
[16]Zhang Y G,Li X H,Fan J S,et al.The inhibitory effect of total saponins of panax notoginseng on rats with atherosclerosis[J].Prog Mord Biomed,2007,7(11):1601-5.