亮蓝G对颈上神经节P2X7受体介导心肌缺血损伤的作用研究
2013-12-07李桂林涂桂花彭海英刘双梅彭力超宋渺渺梁尚栋
吴 炳,李桂林,涂桂花,彭海英,刘双梅,彭力超,宋渺渺,梁尚栋,2
(南昌大学医学院1.生理学教研室、2.基础医学重点实验室,江西南昌 330001)
颈上神经节(superior cervical ganglia,SCG)发出的节后纤维可影响心脏的功能[1-2]。SCG不是简单的信号中继站,对传入和传出信号具有整合作用[3]。交感神经的传入纤维传递急性心肌缺血伤害性感受信号,进而兴奋中枢下达交感传出信息对心脏功能产生影响。文献显示心脏的感觉传入神经元与颈上交感神经节(SCG)神经元之间存在相互联系,通过颈上交感神经节的节后神经对心脏活动产生影响,从而形成感觉传入与交感传出之间的反馈环路[4-5]。
嘌呤2受体(P2受体)包括 P2X受体亚型(P2X1-7)和P2Y受体亚型[6]。三磷酸腺苷(ATP)及其类似物是P2受体的天然配体。P2X受体为非选择性阳离子通道,兴奋时可引起通道开放,可通透阳离子 Na+、K+、Ca2+,引发生物学效应[7]。ATP 作用于P2X受体调节神经信息传递。由595个氨基酸组成的P2X7受体有395个氨基酸编码的两个跨膜区、包含一个N端和大的胞外环,P2X7受体位于胞内的 C 端长于其它亚型[5,8-9]。
我们实验室的前期实验结果显示P2X3和P2X2/3受体涉及心肌缺血损伤性信息传递并导致交感兴奋反射[10]。P2X7受体存在于颈上交感神经节[8],P2X7受体参与多种神经功能与病理变化[8],但颈上交感神经节P2X7受体是否与心肌缺血损伤相关尚不清楚。本研究通过观察心肌缺血模型大鼠SCG中P2X7受体水平的变化与心肌缺血功能损伤的关系,及应用P2X7受体特异性拮抗剂亮蓝 G(brilliant blue G,BBG)后的影响,了解急性心肌缺血损伤时颈上交感神经节P2X7受体在损伤性信息导致交感兴奋反射信号传递中的作用,为心肌缺血病变的预防和治疗提供实验基础。
1 材料与方法
1.1 心肌缺血实验动物模型与分组 健康Sprague-Dawley大鼠(SD大鼠),体质量180-220 g,♀,由南昌大学实验动物科学部提供。大鼠心肌缺血模型建立方法[11]简述如下:麻醉后暴露大鼠的声门,气管插管后接通小动物呼吸机。在左胸胸骨角第4肋间隙位置纵切皮肤,暴露心脏,用玻璃分针剌破心包膜。用小号缝合针快速穿刺血管底部心肌结扎左心耳与动脉圆锥间的左冠状动脉前降支(深度约1.5~2.0 mm),大鼠心电图出现ST段呈弓背向上抬高时表明成功建立心肌缺血大鼠模型。
SD大鼠随机分为假手术组、假手术加BBG组、心肌缺血模型组和心肌缺血模型加P2X7受体拮抗剂BBG干预组。假手术加BBG组和心肌缺血模型加BBG干预组腹腔注射P2X7受体拮抗剂BBG(30 mg·kg-1·d-1),分别连续注射 20 d。
1.2 药品与试剂 兔抗P2X7单克隆抗体(Abcam公司)、β-actin抗体(北京中杉金桥)、亮蓝G(brilliant blue G,BBG)(美国Sigma-aldrich)。
1.3 大鼠心电图、血压和心率测定 腹腔注射10%水合氯醛(0.3 ml/100 g体质量)进行麻醉。大鼠麻醉后固定于手术台,将心电图电极分别固定在双上肢和右下肢皮下,进而用Medlab生物信号采集处理系统记录标准Ⅱ导联的心电图。
应用BP-2006A智能无创血压计监测假手术组、假手术加BBG组、心肌缺血模型组和心肌缺血模型加P2X7受体拮抗剂BBG干预组大鼠血压和心率的变化。相同时间内重复测量3次大鼠的血压和心率后取其平均值,由同一人完成每次操作。
1.4 心肌酶测定 应用抗凝玻璃毛细管在麻醉后大鼠的眶后静脉丛采集约1~2 ml血液。将收集的血液立即离心5 min(3 000 r·min-1)后取上层血浆,用全自动电化学发光仪(美国罗氏 COBAS E601)检测各组大鼠血清心肌酶。
1.5 免疫组织化学 冰冻切片大鼠颈上神经节,当神经节切片恢复至室温后,用PBS(0.1 mol·L-1)洗3次(5 min/次);再用0.3%的H2O2室温孵育5 min(以降低内源性过氧化物酶);0.1 mol·L-1PBS洗3次(5 min/次);封闭液37℃ 孵育1 h;加入兔源并用0.1 mol·L-1PBS稀释为1∶100的P2X7一抗后4℃ 孵育过夜;用0.1 mol·L-1PBS洗3次(5 min/次);滴加适量生物素标记二抗工作液后37℃孵育 40 min;0.1 mol·L-1PBS 洗3 次(5 min/次);滴入适量过氧化物酶标记的链霉卵白素工作液(室温孵育20 min);0.1 mol·L-1PBS洗3次(5 min/次);用DAB显色、双蒸水冲洗、梯度酒精脱水、二甲苯透明、中性树脂封片。
1.6 蛋白印迹 提取各组大鼠颈上神经节提取蛋白,上样及进行SDS-PAGE蛋白分离电泳,转膜后进行免疫学检测。通过Image-Pro Plus图像分析系统分析目的条带在X线胶片测得的综合光密度值,以各组β-actin条带的IOD值标化其蛋白的表达量。1.7 统计学方法 实验数据用Excel及SPSS 11.5统计软件进行统计分析,各实验组数据以±s表示,各组数据间的统计采用方差分析,组间比较采用LSD法。
2 结果
2.1 心率、血压及心电图的变化 心肌缺血大鼠模型组心率、血压(收缩压和舒张压)与假手术组、假手术加BBG组、心肌缺血模型加P2X7受体拮抗剂(BBG)干预组大鼠比较出现明显加快和增高(P<0.05)。心肌缺血大鼠模型加BBG干预组的收缩压、舒张压与假手术组、假手术加BBG组比较无明显差异(P>0.05)。心肌缺血大鼠模型加BBG干预组心率略高于假手术组和假手术加BBG组(P<0.05)。见Tab 1。
心肌缺血成功建模大鼠的心电图显示ST段呈弓背抬高;建模20 d后心肌缺血大鼠模型的心电图出现深大的病理性Q波,而心肌缺血模型加BBG干预组大鼠无明显的病理性Q波(Fig 1)。
2.2 心肌酶浓度变化 应用全自动电化学发光仪(美国罗氏COBAS E601)检测乳酸脱氢酶(LDH)、肌酸激酶(CK-MB)、肌酸激酶(CK)和心肌肌钙蛋白T(cTn-I)。心肌缺血模型组的 LDH,CK-MB,CK和cTn-I浓度,与假手术组、假手术+BBG组和心肌缺血模型+BBG组比较明显增加(P<0.05)。心肌缺血模型+BBG组CK-MB、CK、LDH和cTn-I浓度较假手术组、假手术+BBG组略有增高(P<0.05)。见Tab 2。
Tab 1 Value of heart rate and blood pressure(systolic blood pressure and diastolic blood pressure)after 20 days of myocardial ischemia in each group(±s,n=5)

Tab 1 Value of heart rate and blood pressure(systolic blood pressure and diastolic blood pressure)after 20 days of myocardial ischemia in each group(±s,n=5)
*P<0.05 vs sham group,sham+BBG group and ischemia+BBG group;#P<0.05 vs sham group and sham+BBG group.
Group Heart rate/min pressure/kPa Sham 332.850 ±36.720 15.928 ±1.591 11.268 ±1.Systolic blood pressure/kPa Diastolic blood 16.246 ±1.578 11.380 ±1.180 087 Sham+BBG 335.650 ±33.671 15.991 ±1.550 11.169 ±1.087 Ischemia 428.650 ±45.752*18.354 ±1.816* 12.443 ±1.228*Ischemia+BBG 389.870 ±38.961#
2.3 颈上神经节P2X7受体免疫反应性 用Image-Pro Plus软件分析免疫组织化学结果,颈上交感神经节细胞P2X7受体免疫反应性的光密度值在假手术组、假手术+BBG组、心肌缺血模型组、心肌缺血模型+BBG组(n=10)分别为:205.015±20.98、198.52±20.06、403.76 ±41.29、223.83 ±24.36。统计学分析显示,心肌缺血模型组大鼠颈上神经节P2X7受体蛋白的表达明显高于假手术组、假手术+BBG组和心肌缺血模型+BBG组(P<0.05);假手术组、假手术+BBG组和心肌缺血模型+BBG组之间P2X7受体蛋白的表达差异无显著性(P>0.05)。见Fig 2。
2.4 颈上神经节P2X7受体的蛋白表达 将蛋白印迹实验结果通过β-actin标化后显示颈上交感神经节P2X7受体蛋白表达的光密度值在假手术组、心肌缺血模型组、假手术+BBG组、心肌缺血模型+BBG组(n=10)分别为:0.98±0.09、1.46±0.13、1.03 ±0.09、0.90 ±0.08。心肌缺血模型组P2X7受体蛋白表达高于假手术组、假手术+BBG组、心肌缺血模型+BBG组(P<0.05);假手术组、假手术+BBG组和心肌缺血模型+BBG组的P2X7蛋白表达无明显差异(P>0.05)。见Fig 3。
3 讨论
冠心病及心绞痛是由于心肌缺血和缺氧引起以心前区疼痛为主要临床表现的一组综合征[2,11]。颈部交感神经对心功能兴奋传导、心跳频率调节、心肌收缩和舒张具有重要作用。颈上交感神经节不是单一的信息中转站,它可以对心脏感觉信息的传入信息与交感传出信息进行整合调控心脏的功能活动[3-5,12]。本研究观察到相对于假手术组大鼠,心肌缺血模型组大鼠的心率明显加快、血压明显升高。颈上交感神经节节后交感神经末梢可分布于心脏与冠状血管,急性心肌缺血、缺氧的损伤性感觉信号传入后可以通过颈上交感神经节节后交感神经加强心脏的兴奋性,导致心率加快、血压升高和心交感神经兴奋性增强[4-5,12]。本实验结果显示心肌缺血大鼠模型心率加快、血压升高,表明心肌缺血增强交感兴奋性活动。
冠心病及心肌损伤使心肌细胞破坏,使血中肌酸激酶、乳酸脱氢酶、肌钙蛋白升高。乳酸脱氢酶(LDH)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)可作为观察心肌缺血损伤程度的血清标志物[13]。实验结果显示心肌缺血模型组大鼠血清乳酸脱氢酶(LDH)、肌酸激酶(CK-MB)、肌酸激酶(CK)和心肌肌钙蛋白T(cTn-I)升高明显,表明心肌已出现损伤。心肌肌钙蛋白I(cTnI)是一种高特异性、高灵敏度的心肌损伤标志物。心电图检测观察到心肌缺血模型组大鼠出现深大的异常Q波,表明出现明显的心肌缺血损伤。
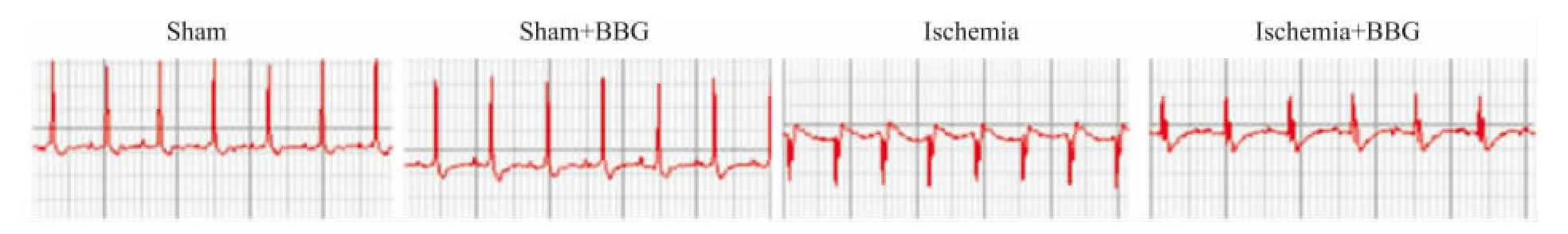
Fig 1 Representative traces of the ECG after 20 days of myocardial ischemia in each group
Tab 2Serum concentrations of LDH,CK-MB,CK and cTn-I after 20 days of myocardial ischemic injury in each group(±s,n=5)

Tab 2Serum concentrations of LDH,CK-MB,CK and cTn-I after 20 days of myocardial ischemic injury in each group(±s,n=5)
*P <0.05 vs sham group,sham+BBG group and ischemia+BBG group;#P <0.05 vs sham group and sham+BBG group.
Group CK-MB/U·L-1 CK/U·L-1 LDH/U·L-1 cTn-I/μg·L -1 Sham 37.87 ±3.87 480.85 ±47.76 292.85 ±28.83 0.052 ±0.0052 Sham+BBG 42.41 ±4.92 502.84 ±50.92 305.93 ±30.43 0.056 ±0.0043 Ischemia 84.30 ±8.82* 2125.84 ±204.52* 942.64 ±93.61* 0.192 ±0.0185*Ischemia+BBG 65.20 ±6.53# 856.38 ±85.73# 465.90 ±46.85# 0.078 ±0.0071#
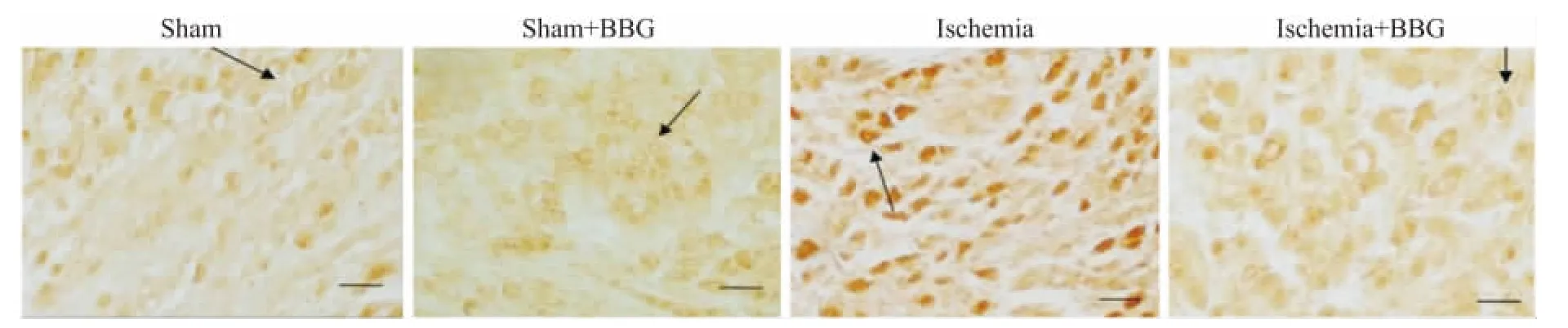
Fig 2 Expression of P2X7in SCG tested by immunohistochemistry
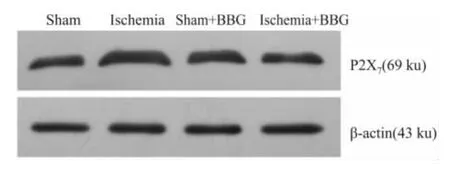
Fig 3 Expression of P2X7protein in SCG tested by Western blot
P2X受体参与心血管功能调节及病理变化过程[6,14]。颈上交感神经节存在 ATP 释放[15],组织损伤时可释放大量 ATP[6],进而激活 P2X受体,加强心交感神经传出活动。我们实验室前期的实验结果表明心肌缺血模型大鼠颈部交感神经节P2X3和P2X2/3表达明显增加,交感兴奋性增强[10],应用P2X3和P2X2/3受体拮抗剂A-317491可降低心肌缺血大鼠升高的血压和加快的心率,由此表明颈部交感神经节P2X受体涉及心交感反射。本实验观察到缺血模型大鼠术后20 d出现心率加快和血压升高,当心肌缺血模型大鼠应用P2X7受体拮抗剂BBG干预后可明显降低升高的血压和加快的心率,表明BBG可明显抑制心肌缺血损伤引起心交感传出神经兴奋性增强现象。心肌缺血模型大鼠应用BBG预处理后心电图的异常变化得到改善、心肌缺血模型大鼠血清的乳酸脱氢酶(LDH)、肌酸激酶(CK-MB)、肌酸激酶(CK)和心肌肌钙蛋白T(cTn-I)水平降低,实验结果进一步表明P2X7受体拮抗剂BBG可能通过抑制心交感兴奋反射对心肌缺血介导的心肌缺血性损伤产生保护作用。
实验结果显示心肌缺血损伤后颈上交感神经节神经元P2X7受体的mRNA和蛋白水平表达明显增加,P2X7受体特异性拮抗剂BBG可降低上调表达的P2X7受体mRNA及蛋白水平。由此提示颈上交感神经节P2X7受体参与心肌缺血损伤介导的心交感节后传出兴奋性反射的病理变化,P2X7受体拮抗剂BBG可降低颈上神经节神经元P2X7受体mRNA及蛋白水平,抑制颈上交感神经节节后神经介导的交感兴奋反射,降低心交感兴奋反射引起的血压升高和心率加快,从而对心肌缺血损伤产生保护作用。
总之,心肌缺血损伤导致颈上神经节P2X7受体表达增加,大量释放的ATP兴奋P2X7受体,引起心交感兴奋反射增强,出现心率加快和血压升高而加重心肌缺血引发的损伤。P2X7受体拮抗剂BBG可通过降低颈上交感神经节P2X7受体mRNA及蛋白的上调表达,对心肌缺血损伤介导的心交感兴奋反射产生抑制作用,从而减轻心肌缺血损伤,对心脏产生保护作用。
[1]Pather N,Partab P,Singh B,Satyapal K S.The sympathetic contribution to the cardiac plexus[J].Surg Radiol Anat,2003,25:210-5.
[2]Vaseghi M,Shivkumar K.The role of autonomic nervous system in sudden cardiac death[J].Prog Cardiovasc Dis,2008,50:404 -19.
[3]Boehm S,Kubista H.Fine tuning of sympathetic transmitter release via ionotropic and metabotropic presynaptic receptors[J].Pharmacol Rev,2002,54:43 -99.
[4]Armour J A.Myocardial ischaemia and the cardiac nervous system[J].Cardiovascul Res,1999,41:41 -54.
[5]Armour J A.Potential clinical relevance of the‘little brain’on the mammalian heart[J].Exp Physiol,2008,93:165 -76.
[6]Burnstock G,Krügel U,Abbracchio M P,Illes P.Purinergic signalling:from normal behaviour to pathological brain function[J].Prog Neurobiol,2011,95:229 - 74.
[7]Jarvis M F,Khakh B S.ATP-gated P2X cation-channels[J].Neuropharmacol,2009,56:208 -15.
[8]Sperlagh B,Vizi E S,Wirkner K,Illes P.P2X7receptors in the nervous system[J].Prog Neurob,2006,78:327 -46.
[9]Volonté C,Apolloni1 S,Skaper S D,Burnstock G.P2X7receptors:channels,pores and more[J].CNS Neurol Disord Drug Targets,2012,11(6):705 -21.
[10]Li G L,Liu S M,Zhang J,et al.Increased sympathoexcitatory reflex induced by myocardial ischemic nociceptive signaling via P2X2/3receptor in rat superior cervical ganglia[J].Neurochem Int,2010,9:84 -90.
[11]Higuchi T,Nekolla S G,Huisman M M,et al.A new 18F-labeled myocardial PET tracer:myocardial uptake after permanent and transient coronary occlusion in rats[J].J Nucl Med,2008,49(10):1715-22.
[12]Zipes D P.Heart-brain interactions in cardiac arrhythmias:role of the autonomic nervous system[J].Cleve Clin J Med,2008,75:S94-6.
[13]O’Neil B J,Ross M A.Cardiac markers protocols in a chest pain observation unit[J].Emerg Med Clin North Am,2001,19:67 -86.
[14]Erlinge D,Burnstock G.P2 receptors in cardiovascular regulation and disease[J].Purinergic Signal,2008,4(1):1 -20.
[15]Vizi E S,Liang S D,Sperlágh B,et al.Studies on the release and extracellular metabolism of endogenous ATP in rat superior cervical ganglion:support for neurotransmitter role of ATP[J].Neuroscience,1997,79:893 -903.