DNA主动去甲基化酶研究进展及药物开发
2013-05-29甘我挺许锦文
段 菊,凌 霜,甘我挺,孙 丽,许锦文
(上海中医药大学穆拉德中药现代化研究中心,上海 201203)
DNA主动去甲基化是表观遗传调控的一个重要过程,近几年逐步明确了其机制、与疾病的关系、酶的活性和表达的影响因素。这些研究结果显示,DNA主动去甲基化酶类不仅与胚胎发育过程相关,也同我们的日常生活中饮食营养(维生素C、D和铁的摄取)、疾病过程(炎症过程前列腺素E2的释放)和激素水平(雌激素动态变化)有着密不可分的关系,也是未来药物开发的关键酶类。
1 DNA去甲基化机制
DNA的去甲基化方式有被动去甲基化(replication-coupled DNA demethylation)和主动去甲基化 (active DNA demethylation)两种。
1.1DNA被动去甲基化DNA被动去甲基化是指当甲基化转移酶(DNMTs)活性被抑制或浓度过低时,无法维持原有的甲基化状态,使DNA甲基化程度降低的过程。通常是在DNA复制过程中,当序列特异的转录因子结合到DNA甲基化位点时,可能阻止DNMTs与这些位点的接近,导致DNA渐进地去甲基化。
1.2DNA主动去甲基化DNA主动去甲基化过程不依赖于DNA的复制,以5-甲基胞嘧啶 (5mC)为起始,在酶的催化作用下,使5 mC转化为未甲基化的胞嘧啶(C)。尽管DNA主动去甲基化机制仍不十分清楚[1],不同细胞内或不同组织中DNA去甲基化的途径还不明确,但目前主流观点认为是由5mC的修饰开始,主要以脱氨基作用、氧化作用、甲基团脱氢过程实现(Fig 1)。
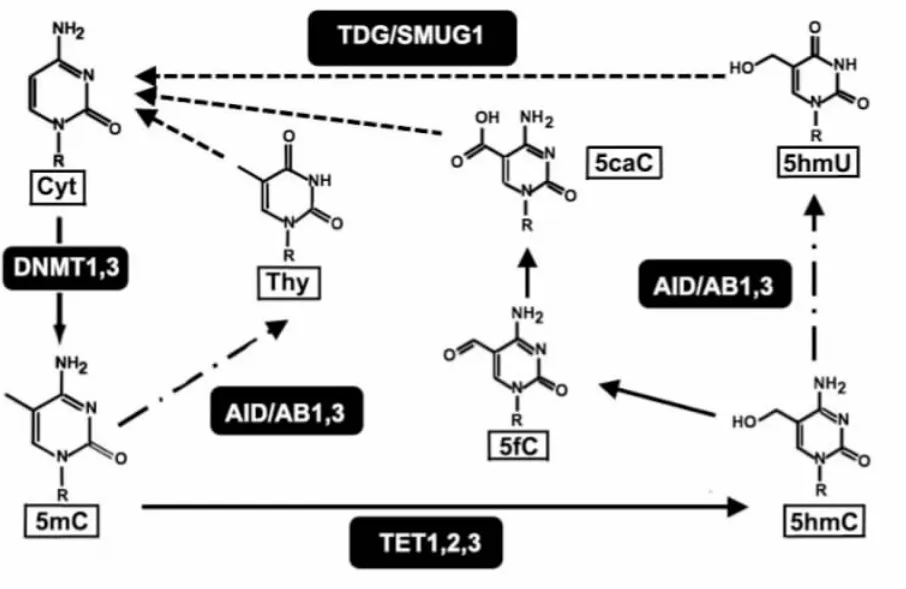
Fig 1 Schematic diagram of DNA active demethylation[1-3]
目前比较主流的认识有以下5种DNA主动去甲基化方式:
1.2.1氧化脱氨基偶联碱基切除修复(BER)方式 这种方式需要3个步骤,5mC先经过TET羟化酶氧化转化为5-hydromethylcytosine(5hmC),然后经过 AID脱氨基转变为5hmU,5hmU可被胸腺嘧啶DNA糖基化酶TDG识别并切除,再通过BER最终将该位点转化为C,实现DNA去甲基化。
1.2.1.1步骤1:羟化酶TET(ten-eleven translocation)人类和小鼠都拥有铁依赖性氧化酶TET蛋白,人TET蛋白家族共有3名成员,分别为TET1、TET2和TET3。TET1是在研究1例存在t(10;11)(q22;q23)异位的白血病患者时作为组蛋白H3赖氨酸4甲基转移酶MLL的融合伴侣而鉴定成功的,并由此而得名。TET1蛋白包含核定位序列,具有与DNA结合能力,因此主要在细胞核内发挥其生理作用。哺乳动物DNA中5hmC的发现推进了人们对其生物功能的广泛探索[4],其中最主要的是关注其在DNA主动去甲基化过程中的作用,大量实验研究表明5hmC是DNA去甲基化过程中的中间产物,而其最直接的证据就是确定了TET1作为5mC羟化酶的作用[5]。研究发现TET1蛋白在体外可以将5mC氧化成5hmC,且5hmC稳定存在于胚胎干细胞及浦肯野细胞中,这提示5mC可能通过一个铁依赖性氧化途径经由5hmC最终转化成非甲基化的胞嘧啶。TET1敲低的小鼠胚胎干细胞中TET1通过将5mC转化为5hmC调节DNA甲基化水平[4],Guo等[6]提出 TET1高表达同样也促进了人类细胞内源性基因座区域特异性DNA去甲基化过程。
1.2.1.2步骤2:脱氨酶AID(activation-induced deaminase)
活化诱导脱氨酶AID是APOBEC(apolipoprotein B mRNA-editing,catalyticpolypeptide)家族中的一员,AID最初被确定是作为B淋巴细胞免疫球蛋白基因的类别转换重组(CSR)和体细胞高频突变过程 (SHM)中的必需关键因子[7-8]。体外实验和大肠杆菌中均证实AID能将单链DNA中胞嘧啶转化为尿嘧啶。在斑马鱼实验中,AID能使5mC脱氨基变为T造成T/G错配,这种错配激活DNA修复通路BER,进而完成完整的去甲基化。同样,在哺乳动物中,AID也参与了DNA主动去甲基化过程。据报道,AID-/-小鼠PGC基因组甲基化水平高于野生型,AID基因缺失主要影响内含子、转座子以及部分外显子的去甲基化,而启动子甲基化水平与野生型相当[9]。利用RNA干扰技术阻断人类成纤维细胞和小鼠ESC中的AID后,两者融合形成的异核体中多能性相关基因Octz4和Nanog启动子处于甲基化状态,使Oct4和Nanog基因表达受到限制,表明AID可能在体细胞DNA甲基化重编程以及其多能性诱导过程中起重要作用,且AID依赖的去甲基化必然是主动的过程[10]。
1.2.1.3步骤3:糖苷酶TDG(thymine-DNA glycosylase)TDG是针对G/U错配的糖苷酶,碱基修复BER途径最上游的蛋白分子,实验证明TDG可以将5hmC转化为C[11]。
1.2.2氧化去甲基化偶联BER方式 5mC先经过TET羟化酶氧化转化为5hmC,然后继续在TET作用下氧化成 5-Form-lcytosine(5fC),进一步又氧化成 5-Carboxylcytosine(5aC),生成的5caC可被TDG识别并切除,在BER机制下也可实现该位点C的生成[12]。
1.2.3脱氨基化偶联BER方式 脱氨酶使5mC脱氨基变为T造成T/G错配,而T/G错配可激活DNA修复通路完成完整的去甲基化过程。这个过程有两类酶参与,MBD4(methylated DNA binding)和DNMT3。
MBD4对5mC同样具有糖苷酶活性,但是其活性比其T/G错配时的糖苷酶活性要低30-40倍左右,而蛋白激酶磷酸化后的胞嘧啶能增强MBD4对5mC的糖苷酶活性。MBD4缺失的受精卵仍表现出正常的合子父源DNA的去甲基化,并且,MBD4缺失小鼠不管其胞嘧啶是否被甲基化都表现出大量的C-T突变,提示其在去甲基化过程的有限性。斑马鱼胚胎的研究证明,AID与MBD4二者同时高表达,能促进DNA的去甲基化,而二者单独高表达无此结果。相反,敲低MBD4引起DNA的再次甲基化[13]。
DNMT3是DNA甲基化转移酶家族 (DNMTs)的一个成员,又分为DNMT3A和DNMT3B两个亚型。尽管DNMTs一直被认为是催化DNA甲基化过程,但最近的研究报道DNMTs也参与到5mC脱氨基作用。起初是在细菌甲基转移酶的研究过程中,发现它们具有脱甲基活性而参与到脱氨基过程。接着在哺乳动物的体外研究中发现DNMT3A和DNMT3B同样具有脱甲基活性[20],且报道指出 DNMT3A和DNMT3B能够刺激TDG的酶活性并与之相互作用。DNMTs对于哺乳动物的生长发育是十分重要的,它们的功能异常将导致胚胎发育障碍、癌症等多种疾病。因此,DNMTs可能成为一个重要的分子靶标,在疾病的治疗和预防中发挥重要作用。
1.2.4水解去甲基化方式 通过酶促反应直接移除5mC上的甲基基团,MBD2酶(Methylated DNA binding domaincontaining protein 2)能过通过酶促反应直接移除5mC上的甲基基团来实现去甲基化过程。完成DNA去甲基化最简单的方式就是通过酶促反应直接移除5mC上的甲基基团,而这需要有强烈的催化活性才能使牢固的C-C键断裂。MBD2是第1个被报道能实现该过程的酶,不需要其他任何特定的因素而通过催化水解反应直接从5mC上去除甲基团后释放甲醇,但这种不利于热力学的机制一直备受争议。
1.2.5核苷酸外切修复方式(NER)针对由紫外线和致癌物质诱导产生的DNA螺旋扭曲损伤,NER核酸酶XPF和XPG酶切损伤附近的DNA片段,接着在DNA聚合酶的作用下C取代5mC,导致DNA甲基基团的丢失,从而实现DNA去甲基化。
2 DNA主动去甲基化相关酶类影响因素
参与去甲基化的酶或各种因子同样受到机体环境的影响,这些影响因素直接作用于这些酶或因子,从而调节DNA的去甲基化过程。最新研究表明,雌激素、维生素D和C、前列腺素E2可以调控主动去甲基化酶的表达。
Pauklin等[7]通过实验发现了AID基因的启动子区域上雌激素受体的功能性结合位点,提出雌激素与雌激素受体复合物结合到AID启动子上,促进AID mRNA的表达,进一步促进AID蛋白的表达。而Pauklin等[8]通过实验证实黄体酮能够结合AID启动子抑制AID的表达,AID的表达的调节可受到雌激素和黄体酮恰好相反的作用。1,25(OH)2D3通过抑制DNA甲基化转移酶DNMT3a和DNMT3b的表达,下调细胞整体DNA甲基化水平[14]。最新研究发现,维生素C可作为TET酶的辅因子从而促进5-hmC的生成,提示维生素可促进主动去甲基化酶的表达从而促进主动去甲基化过程[15]。Lee等[16]提出了增强COX-2通路蛋白的前列腺素2的前馈机制能够逐步促进AID的mRNA及蛋白的表达水平,提示前列腺素E2可作为潜在主动去甲基化药物发挥相关作用。
3 DNA甲基化和去甲基化与疾病的关系
DNA甲基化与DNA的去甲基化这两个过程相互平衡,维持了DNA甲基化模式的稳定。任何一方的失调都会导致DNA甲基化模式的紊乱和导致多种疾病和癌症的发病过程,如阿尔采末病、炎症、髓系恶性白血病和精神分裂症。
3.1DNA甲基化和去甲基化与衰老的关系基因组DNA甲基化水平降低的趋势在衰老中是普遍存在的。Szulwach等[17]提出在衰老过程中,哺乳动物大脑中的5hmC水平呈动态性变化,小鼠海马DNA羟基化水平的增加亦是年龄相关的。与4月龄小鼠相比,衰老的24月龄小鼠大脑额叶皮层线粒体内5hmC水平降低,5mC水平增加,表明衰老的线粒体哺乳动物大脑中的表观遗传机制的存在及其易感性[18]。同样,老龄化还会导致人体B细胞内AID表达水平的下降[19]。
3.2DNA甲基化和去甲基化与炎症的关系DNA甲基化在炎症的发生发展过程中亦发挥重要调控作用,人天然脂蛋白诱导的DNA从头甲基化与THP-1巨噬细胞炎症基因的抑制相关[20]。炎症性肠病相关基因的甲基化状态的变化可明显改变疾病的发生发展过程中基因表达水平[21]。同样,DNA主动去甲基化也参与到炎症过程中,Neves-Costa等[22]证实TET1是IL-1β的负向转录调控因子,胃肠组织中观察到AID激活与各种炎症相关,如慢性病毒性肝炎、幽门螺杆菌相关性胃炎、巴雷特食管和炎性肠疾病等[23]。
3.3DNA甲基化和去甲基化与肿瘤的关系单基因水平及基因组范围内的DNA甲基化改变在肿瘤发生发展中亦发挥重要作用。在许多肿瘤的研究中都发现了基因组整体DNA低甲基化所导致的染色体不稳定性。抑癌基因的异常甲基化引起的表达抑制,可导致肿瘤细胞的增殖失控和侵袭转移,并参与肿瘤组织的血管生成过程。在各类型髓系恶性白血病中,TET2也是一个最常见的突变基因,有文献证明TET2突变造成的酶活性破坏可导致骨髓生成异常而引发肿瘤发生[24],在TET2突变体骨髓癌中,5-mC的羟化是不平衡的,而 TET1的表达增加可以抑制癌细胞的浸润[25],提示DNA主动去甲基化过程与癌症密切相关。
3.4DNA甲基化和去甲基化与脑疾病的关系大脑新皮质DNA异常甲基化已被认为可作为精神病的病理生理学因素[26]。精神分裂症病人额前皮质中颤蛋白基因RELN启动子CpG岛DNA的甲基化增强[27],从而导致 RELN表达下降。在大脑以及浦肯野神经细胞含有丰富的5hmC,而肿瘤细胞株中是不存在的,提示5hmC在大脑中具有表观遗传控制神经元的功能作用[28]。精神病患者的顶叶皮层中TET1表达上调,而APOBEC3A和APOBEC3C的表达却是下降的[29]。Gavin 等[26]提出在精神病中,GADD45b 可能会代偿性的增加从而无法进入基因启动子区域。这些理论都使得开发DNA主动去甲基化抑制剂来建立新的精神障碍治疗方法变得可行。
4 去甲基化药物的应用与开发
DNA甲基化水平和模式的变化会导致生物的表型异常引发各种疾病,介于DNA甲基化的可逆转特性,因此可以作为疾病治疗的靶点。在这种理论的指导下,人们开始广泛开发去甲基化药物。
在很多肿瘤细胞中,都存在DNA甲基转移酶DNMT异常过度表达。因此,通过抑制DNMT活性,阻断DNA的高度甲基化来抑制或杀死肿瘤细胞这一思路已经越来越多地受到科研工作者重视,DNA甲基转移酶抑制剂的研究也已成为药物化学的一个研究热点。目前已经有两个美国FDA批准用于临床的维持甲基化转移酶DNMT1的抑制剂,分别是5-aza-cytidine和5-aza-20-deoxycytidine,临床用以治疗骨髓增生异常综合症[30]。李洪利等[31]提出 5-Aza-dC 能够逆转A549细胞FHIT癌基因的去甲基化,且FHIT的mRNA及蛋白的表达恢复,提示5-Aza-dC在恶性肿瘤治疗中具有良好的应用前景。
最新研究发现中药单体姜黄素能有效抑制DNMT作用,姜黄素还可以诱导非白血性白血病细胞的DNA去甲基化。同时姜黄素对肿瘤细胞的异常甲基化亦有抑制作用[32]。姜黄素的发现为今后研究开发DNMT抑制剂提供了新型的骨架结构,并有可能以此为先导化合物,开发出疗效好毒性小的DNMT抑制剂,同时也为开发中药运用提供新的思路。
DNA主动去甲基化通路在疾病治疗中是一个极具潜力而又新颖的表观遗传治疗干预的关键,参与DNA去甲基化过程的酶将作为一个重要的药物分子靶标,在药物开发、疾病治疗上显示出极大的魅力,从疾病着手,从主动去甲基化关键酶着手,探索新的药物将是一个挑战。随着研究的深入,对去甲基化药物的探索研究亦可能将疾病的治疗提升到新的高度。
[1]Ooi S K,Bestor T H.The colorful history of active DNA demethylation [J].Cell,2008,133(7):1145-8.
[2]Wu S C,Zhang Y.Active DNA demethylation:many roads lead to rome[J].Nat Rev Mol Cell Biol,2010,11(9):607-20.
[3]Bhutani N,Burns D M,Blau H M.DNA demethylation dynamics[J].Cell,2011,146(6):866-72.
[4]Ito S,D'Alessio A C,Taranova O V,et al.Role of Tet proteins in 5mC to 5hmC conversion,ES-cell self-renewal and inner cell mass specification [J].Nature,2010,466(7310):1129-33.
[5]Tahiliani M,Koh K P,Shen Y,et al.Conversion of 5-methylcytosine to 5-hydroxymethyl cytosine in mammalian DNA by MLL partner TET1 [J].Science,2009,324(5929):930-93.
[6]Guo J U,Su Y,Zhong C,et al.Hydroxylation of 5-methylcytosine by TET1 promotes active DNA demethylationin the adult brain [J].Cell,2011,145(3):423-34.
[7]Pauklin S,Sernández I V,Bachmann G,et al.Estrogen directly activates AID transcription and function [J].Exp Med,2009,206(1):99-111.
[8]Pauklin S,Petersen-Mahrt S K.Progesterone inhibits activationinduced deaminase by binding to the promoter[J].J Immunol,2009,183(2):1238-44.
[9]Popp C,Dean W,Feng S,et al.Genome-wide erasure of DNA methylation in mouse primordial germ cells is affected by AID deficiency[J].Nature,2010,463(7284):1101-5.
[10]Bhutani N,Brady J J,Damian M,et al.Reprogramming towards pluripotency requires AID-dependent DNA demethylation [J].Nature,2010,463(7284):1042-7.
[11]Cortellino S,Xu J,Sannai M,et al.Thymine DNA glycosylase is essential for active DNA demethylation by linked deamination-base excision repair[J].Cell,2011,146(1):67-79.
[12]He Y F,Li B Z,Li Z,et al.Tet-mediated formation of 5-Carboxylcytosine and its excision by TDG in mammalian DNA[J].Science,2011,333(6047):1303-7.
[13]Rai K,Huggins I J,James S R,et al.DNA demethylation in Zebrafish involves the coupling of a deaminase,a glycosylase,and Gadd45 [J].Cell,2008,135(7):1201-12.
[14]蒋艳玲.1,25-二羟维生素D3对HaCaT细胞增殖活性的影响及其表观遗传调控机制研究[D].中南大学.2012.
[14]Jiang Y L.Study on the effect and epigenetic mechanisms of 1,25-(OH)2D3regulating cell viability of HaCaT cells[D].Central South Univ,2012.
[15]Minor E A,Court B L,Young J I,et al.Ascorbate induces ten-eleven translocation(Tet)methylcytosine dioxygenase-mediated generation of 5-hydroxymethylcytosine[J].J Biol Chem,2013,288(19):13669-74.
[16]Lee H,Trott J S,Haque S,et al.A cyclooxygenase-2/prostaglandin E2 pathway augments activation-induced cytosine deaminase expression within replicating human B cells [J].J Immunol,2010,185(9):5300-14.
[17]Szulwach K E,Li X,Li Y,et al.5-hmC-mediated epigenetic dynamics during postnatal neurodevelopment and aging[J].Nat Neurosci,2011,14(12):1607-16.
[18]Dzitoyeva S,Chen H,Manev H.Effect of aging on 5-hydroxymethylcytosine in brain mitochondria[J].Neurobiol Aging,2012,33(12):2881-91.
[19]Frasca D,Van der Put E,Riley R L,et al.Reduced Ig class switch in aged mice correlates with decreased E47 and activationinduced cytidine deaminase [J].J Immunol,2004,172(4):2155-62.
[20]Lin Z,Hegarty J P,Cappel J A,et al.Identification of diseaseassociated DNA methylation in intestinal tissues from patients with inflammatory bowel disease[J].Clin Genet,2011,80(1):59-67.
[21]Rangel-Salazar R,Wickström-Lindholm M,Aguilar-Salinas C A,et al.Human native lipoprotein-induced de novo DNA methylation is associated with repression of inflammatory genes in THP-1 macrophages[J].BMC Genomics,2011,12:582.
[22]Neves-Costa A,Moita L F.TET1 is a negative transcriptional regulator of IL-1β in the THP-1 cell line[J].Mol Immunol,2013,54(3-4):264-70.
[23]Shimizu T,Marusawa H,Endo Y,Chiba T.Inflammation-mediated genomic instability:roles of activation-induced cytidine deaminase in carcinogenesis[J].Cancer Sci,2012,103(7):1201-6.
[24]Delhommeau F,Dupont S,Della Valle V,et al.Mutation in TET2 in myeloid cancers[J].N Engl J Med,2009,360(22):2289-301.
[25]Hsu C H,Peng K L,Kang M L,et al.TET1 Suppresses cancer invasion by activating the tissue inhibitors of metalloproteinases[J].Cell Rep,2012,2(3):568-79.
[26]Gavin D P,Sharma R P,Chase K A,et al.Growth arrest and DNA-damage-inducible,beta(GADD45b)-mediated DNA demethylation in major psychosis [J].Neuropsychopharmacology,2012,37(2):531-42.
[27]Abdolmaleky H M,Cheng K H,Russo A,et al.Hypermethylation of the reelin(RELN)promoter in the brain of schizophrenic patients:a preliminary report[J].Am J Med Genet B Neuropsychiatr Genet,2005,134B(1):60-6.
[28]Kriaucionis S,Heintz N.The nuclear DNA base 5-hydroxymethylcytosine is present in Purkinje neurons and the brain[J].Science,2009,324(5929):929-30.
[29]Dong E,Gavin D P,Chen Y,et al.Upregulation of TET1 and downregulation of APOBEC3A and APOBEC3C in the parietal cortex of psychotic patients[J].Transl Psychiatry,2012,2:e159
[30]Cang S,Lu Q,Ma Y,et al.Clinical advances in hypomethylating agents targetingepigenetic pathways[J].Curr Cancer Drug Targets,2010,10(5):539-45.
[31]李洪利,李文通,张伟栋,等.5-氮杂脱氧胞苷对非小细胞肺癌细胞A549中抑癌基因FHIT表达的影响[J].中国药理学通报,2009,25(10):1399-40.
[31]Li H L,Li W T,Zhang W D,et al.Effect of 5-Aza-dC on FHIT gene expression in non-small cell lung cancer cell line A549 [J].Chin Pharmacol Bull,2009,25(10):1399-40.
[32]Khor T O,Huang Y,Wu T Y,et al.Pharmacodynamics of curcumin as DNA hypomethylation agent in restoring the expression of Nrf2 via promoter CpGs demethylation [J].Biochem Pharmacol,2011,82(9):1073-8.