姜黄素对人正常肝细胞角蛋白1和内质网蛋白19表达的影响
2013-12-07周中运范春雷窦晓兵胡林峰
周中运,范春雷,窦晓兵,胡林峰,钱 颖
(浙江中医药大学生命科学学院,浙江杭州 310053)
姜黄素(Curcumin,CUR)是从姜科姜黄属(Curcuma longaL.)植物姜黄、莪术、郁金等的根茎中提取得到的一种植物多酚,也是中药姜黄发挥药理作用的重要活性成分。系列研究表明CUR具有降血脂、抗氧化、抗炎、抗动脉粥样硬化和抗肿瘤等多种生物学效应[1-5]。近年来姜黄素已成为国内外的研究热点,涉及的研究领域也越来越广泛。本研究以人正常肝细胞(L-02)作为实验对象,应用双向凝胶电泳和质谱技术初步研究CUR对人正常肝细胞蛋白质组的影响,从中筛选出表达量变化最大的两种蛋白质分别为角蛋白1(Cytokeratin 1,CK1)和内质网 蛋 白 19(Endoplasmicreticulum protein 19,ERp19),用Western blot进一步进行验证,从蛋白质表达水平上探讨CUR药理作用的分子机制,也为揭示CUR药理作用分子机制提供了新的思路。
1 材料与方法
1.1 实验材料与仪器 人正常肝细胞L-02细胞系(中国科学院上海细胞研究所);姜黄素(批号20100609)购自上海三爱思试剂有限公司;固相pH梯度胶条 (IPG strip pH 4-7,24 cm)(批号922804E)均购自 Bio-Rad Laboratories公司;2-D Quant Kit蛋白定量试剂盒(批号0807-03)购自GE healthcare公司;兔抗人抗体(CK1)(批号 bs-1244R)购于BIOSS公司,兔抗人抗体(ERp19)(批号O95881)购于Abcam公司。EttanTMIPGphorTM等电聚焦电泳仪,EttanTM DALTSix垂直板电泳仪,UMAX ImageScanner凝胶扫描仪,Image Master 2D Platinum 6.0双向电泳凝胶图像分析软件,均购自Amersham BioSciences公司,Biofuge stratos高速冷冻离心机为德国Heraeus公司产品,UV8200分光光度计为日本日立公司产品,飞行时间串联质谱仪MALDI TOF/TOFTMAnalyzer 4800购自美国应用生物系统公司。
1.2 实验方法
1.2.1 细胞培养 用10%的灭活胎牛血清、含青霉素和链霉素的RPMI1640培养液在37℃、5%CO2条件下培养,待细胞呈对数生长时即开始实验。随机将人正常肝细胞L-02分成两组,对照组不作任何处理,姜黄素组以 25 mol·L-1[6-7]姜黄素处理 L-02细胞24 h。
1.2.2 细胞总蛋白提取 24 h后,分别收集两组细胞于试管中,各加入2 ml细胞裂解液(30 mmol·L-1Tris,8 mol·L-1尿素,4%CHAPS,pH 8.5),4℃孵育1 h。置冰上超声,超声后用4℃,12 000 r·min-1离心30 min,取上清用2-D Quant Kit测定蛋白质浓度,置-80℃保存。
1.2.3 双向电泳 将各组蛋白质的样品和水化液(8 mol·L-1尿素,2%CHAPS,13 mmol·L-1DTT,0.5%IPG buffer,0.002% 溴酚蓝)混合后共 450 μl(每块胶蛋白质上样量为300 μg,每组做3块重复胶),制成第一向等电聚焦体系,采用胶内泡涨的方法上样。等电聚焦的参数:30 V,12 h;500 V,1 h;1000 V,1 h;8 000 V,8 h。等电聚集后,胶条于平衡液Ⅰ(1%DTT,50 mmol·L-1Tris-HCl,6 mol·L-1尿素,30%甘油,2%SDS,0.002% 溴酚蓝)、平衡液Ⅱ(4% 碘乙酰胺,50 mmol·L-1Tris-HCl,6 mol·L-1尿素,30% 甘油,2%SDS,0.002% 溴酚蓝)中各平衡15 min后转移到第二向已制好的12.5%SDSPAGE胶上,用0.5%琼脂糖封顶,进行第二向电泳,电泳参数设定为:30 W,45 min;90 W,6 h。直到溴酚蓝染料迁移至胶的底部边缘结束电泳。
1.2.4 图像扫描分析 电泳结束后,取出凝胶转移到染色盒里进行硝酸银染色。所得的蛋白质组图谱使用UMAX ImageScanner凝胶扫描仪及LabScan软件进行扫描。然后用Image Master 2D Platinum 6.0分析,进行点识别、背景消除、点匹配及差异蛋白质分析,获得两组比较后的差异蛋白质点。
1.2.5 差异蛋白点的质谱鉴定 从胶内挖取某些差异蛋白点后,进行脱色、胶内胰酶酶切和肽段提取,然后用基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)进行肽质量指纹图谱分析。通过Mascot软件,在蛋白质数据库中搜索与肽质量指纹图谱数据相匹配的蛋白质,从而鉴定出有差异的蛋白质。
1.2.6 Western blot鉴定 取用上述已经定量的两组细胞总蛋白样品融解,蛋白样品先用10%SDSPAGE凝胶进行分离,然后用湿转法将蛋白转移到PVDF膜上,5%脱脂奶粉对膜进行封闭,按照蛋白Mark标志将膜裁剪,分别用1∶400的CK1和1∶5 000的ERp19兔抗人一抗孵育,1∶4 000羊抗兔的二抗孵育,ECL显色,凝胶成像系统对图像进行采集。
1.2.7 统计学处理 采用SPSS 11.0统计软件分析数据,实验数据以±s表示,采用方差分析比较各组间差异。
2 结果
2.1 双向银染图谱的分析 银染蛋白质图谱经Image Master 2D Platinum 6.0软件分析后,经比较结果发现,对照组3块凝胶的平均蛋白质点数为521个,姜黄素作用后3块凝胶的平均蛋白质点数为587个。两组比较,如果蛋白质表达的量差异超过1倍(增加或者降低),并且3块胶中蛋白质表达量变化的趋势相一致,则被认为该蛋白质表达差异是由药物所引起,而不是样品材料和操作过程所带来的误差。根据这个原则,共找到40个差异蛋白点,其在图谱中的位置见Fig 1。
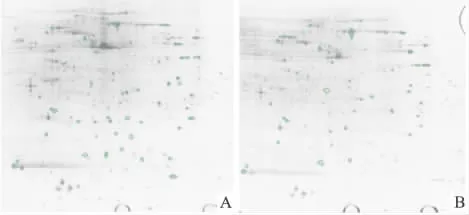
Fig 1 2-DE silver-staining patterns(pH 4-7,24 cm,Nonlinear strip)
2.2 差异表达点的质谱鉴定 上述差异蛋白质点经过胶内酶解后用MALDI-TOF-MS对其中差异最大的两个蛋白质进行鉴定,并与蛋白质文库进行比对分析后,这两个蛋白的分子量与等电点被确定见Tab 1。结果显示:姜黄素处理后角蛋白1和内质网蛋白19表达均增高。

Tab 1 MS identified results of differentially expressed proteins
2.3 Western blot分析 Western blot结果表明人肝细胞L-02经姜黄素处理后角蛋白1和内质网蛋白19表达均明显增高,与双向质谱鉴定的上调趋势基本相同(Fig 2)。
3 讨论
传统中医中姜黄具有破血行气、通经止痛的功能,用于胸胁刺痛,闭经,风湿肩臂疼痛等。以往的大量研究也表明[7-8],姜黄的主要活性成分姜黄素具抗氧化、抗肿瘤、抗炎以及对心血管系统、消化系统等多方面药理作用。肝脏是体内重要的代谢器官,肝细胞在其过程中发挥了主要的作用。机体中多种抗氧化的酶类及其它重要的活性因子主要是由肝细胞产生,而且进行生物氧化的线粒体也主要存在于肝细胞中。因此肝脏的保护显得尤为重要,已有研究发现姜黄素对诱导的肝损伤具有保护作用[9-10],本实验室前期的研究表明,姜黄素能提高人肝癌细胞HepG2表面的低密度脂蛋白受体(LDLR)表达[6],提示其对抗动脉粥样硬化(AS)起积极的作用。但是,当姜黄素的浓度超过 30 μmol·L-1[6]后,则它能够抑制 HepG2 细胞的生长,表明姜黄素也具有抗肿瘤的作用。本实验从蛋白质组学角度,应用双向凝胶电泳、质谱技术和蛋白免疫印迹来探讨姜黄素对人正常肝细胞的作用机制,结果发现了2个明显差异蛋白质角蛋白1和内质网蛋白19。
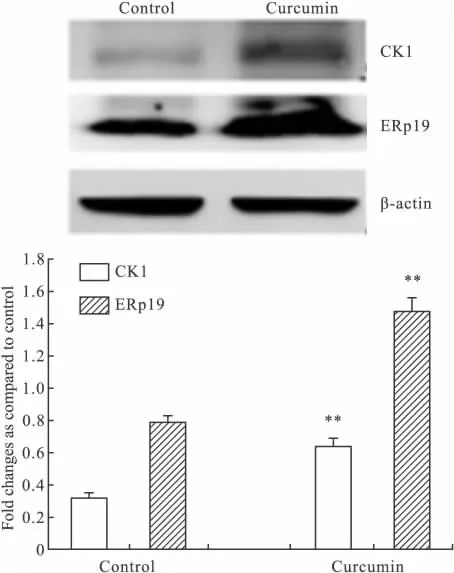
Fig 2 Effects of curcumin on expression of CK1 and ERp19
角蛋白(keratin)是最大的中间纤维亚组,分属Ⅰ型和Ⅱ型中间纤维蛋白,目前已发现有50余种,主要分布于上皮组织细胞中[11-12]。在分化过程中,伴随着各种角蛋白的基因表达改变,其中存在于基底上层的角蛋白1常被作为早期正常分化的标志[13]。硫氧还蛋白(Trx)被认为是除GSH和SOD系统之外的另一个内源性抗氧化系统,硫氧还蛋白结构域是内质网蛋白19中主要的结构域,Trx是一个控制细胞氧化还原状态的、广泛表达的小分子蛋白质,通过其活性中心硫氢键和二硫键的可逆转换参与细胞内的氧化还原过程[14]。
通过本实验研究表明,加入姜黄素药物组与空白对照组的蛋白质差异明显,其中表达量变化最大的角蛋白1和内质网蛋白19明显上调。角蛋白1具有促分化作用,对于癌细胞以分裂为主的特性有抑制作用,能使癌细胞分裂降低,趋向分化;内质网蛋白19中的硫氧还蛋白结构域具有抗氧化作用。因此上调肝细胞角蛋白1和具硫氧还蛋白结构域的内质网蛋白19可能是姜黄素抗肿瘤、抗氧化作用的机制之一。
[1]赵革平,沃兴德.姜黄素及其衍生物的抗氧化作用研究概况[J].浙江中医学院学报,1998,22(6):10-2.
[1]Zhao G P,Wo X D.The antioxidant reasch of curcumin and its derivatives[J].J Zhejiang Med Univ,1998,22(6):10- 2.
[2]Fan C,Wo X,Qian Y,et al.Effect of curcumin on the expression of LDL receptor in mouse macrophages[J].J Ethnopharmacol,2006,105(1-2):251-4.
[3]沃兴德,洪行球,赵革平,等.姜黄素对低密度脂蛋白和脂蛋白(a)代谢的影响[J].中国动脉硬化杂志,1999,7(4):339-41.
[3]Wo X D,Hong X Q,Zhao G P,et al.The effects of curcumin on the metabolism of LDL and lipoprotein(a)[J].J Chin Arteriosclerosis,1999,7(4):339-41.
[4]丁志山,高承贤,陈铌铍,等.姜黄素具有抑制血管生成与诱导肿瘤细胞凋亡双重作用[J].中国药理学通报,2003,19(2):171-3.
[4]Ding Z S,Gao C X,Chen L P,et al.Effects of curcumin:antiangiogenesis and induction of SMMC-7721 cell apoptosis[J].Chin Pharmacol Bull,2003,19(2):171-3.
[5]钱 颖,范春雷,窦晓兵,等.姜黄素对293细胞固醇调控报告系统的作用[J].中国药理学通报,2006,22(7):828-30.
[5]Qian Y,Fan C L,Dou X B,et al.Efect of curcumin on sterol regulatory report system in HEK-293[J].Chin Pharmacol Bull,2006,22(7):828-30.
[6]窦晓兵,沃兴德,范春雷,等.姜黄素对人肝细胞HepG2中低密度脂蛋白受体基因表达影响的研究[J].中国药学杂志,2007,42(8):572-5.
[6]Dou X B,Wo X D,Fan C L,et al.Effect of curcumin on the expression of low density lipoprotein Receptor in HepG2 cell line[J].Chin Pharm J,2007,42(8):572-5.
[7]李 强,赵曙光,王旭霞,等.姜黄素对人肝细胞氧化应激及胰岛素抵抗的影响[J].山西医科大学学报,2010,41(4):300-303.
[7]Li Q,Zhao S G,Wang X X,et al.Effect of curcumine on intracellular reactive oxygen species and insulin resistance in cultured human hepatocytes[J].J Shanxi Med Univ,2010,41(4):300-3.
[8]欧阳英英,李 珂,荣 爽,等.HO-1在姜黄素拮抗乙醇所致肝细胞氧化损伤过程中的作用[J].华中科技大学学报,2010,39(1):82-6.
[8]Ouyang Y Y,Li K,Rong S,et al.Involvement of heme oxygenase-1 in the protective actions of curcumin against ethanol-induced oxidative damage in rat primary hepatocytes[J].Acta Med Univ Sci Technol Huazhong,2010,39(1):82-6.
[9]El-Agamy D S.Comparative effects of curcumin and resveratrol on aflatoxin B(1)-induced liver injury in rats[J].Arch Toxicol,2010,84(5):389-96.
[10]Rong S,Zhao Y,Bao W,et al.Curcumin prevents chronic alcoholinduced liver disease involving decreasing ROS generation and enhancing antioxidative capacity[J].Phytomedicine,2012,19(6):545-50.
[11]Godsel L M,Hobbs R P,Green K J.Intermediate filament assembly:Dynamics to disease[J].Trends Cell Biol,2008,18(1):28-37.
[12]Coulombe P A,Omary M B.‘Hard’and‘soft’principles defining the structure,function and regulation of keratin intermediate filaments[J].Curr Opin Cell Biol,2002,14(1):110-22.
[13]Akunda J K,Lao H C,Lee C A,et al.Genetic deficiency or pharmacological inhibition of cyclooxygenase-1 or-2 induces mouse keratinocyte differentiationin vitroandin vivo[J].FASEB J,2004,18(1):185-7.
[14]Galligan J J,Petersen D R.The human protein disulfide isomerase gene family[J].Hum Genomics,2012,6(1):6.
猜你喜欢
——疾病防治的新靶标