EGCG对三阴乳腺癌细胞MDA-MB-231的增殖抑制作用及机制
2013-12-07蒋国君马琳艳
魏 芳,刘 浩,张 配,蒋国君,马琳艳,陈 超
(蚌埠医学院药学系,安徽省生化药物工程技术研究中心,安徽蚌埠 233030)
三阴乳腺癌(triple-negative breast cancer,TNBC)是指雌激素受体(ER)、孕激素受体(PR)和人类表皮生长因子受体2(HER2)均不表达的乳腺癌亚型。有报道其生物学行为具有高侵袭性、恶性程度高、治疗棘手等特点[1]。患此型乳癌的病人无法从内分泌治疗和抗HER2的靶向治疗中获益,因此化疗在TNBC的全身治疗中起重要作用[2]。如何提高此类患者的治疗效果,筛选治疗三阴乳腺癌的天然药物是医学临床和基础研究的热点。茶叶作为一种传统的“医食同源”的保健饮料,同时也是一种常用的中药,其具有多种生物学活性和药理效应,如抗突变、抗肿瘤、抗炎抗病毒及清除自由基和抗氧化等作用。经研究发现这些作用主要是由茶多酚介导的,包括黄烷醇、黄烷双醇、黄酮类和茶多酚酸类,其中大部分是黄烷醇,通称为儿茶素[3]。表没食子儿茶素没食子酸酯[(-)-epigallocatechin-3-gallate,EGCG]是茶叶特有的儿茶素,其含量最高,约占儿茶素的50%左右,而且生物活性最强[4]。本实验旨在研究EGCG对体外培养的三阴乳腺癌细胞MDAMB-231的增殖抑制作用,并对其作用机制进行初步探讨。
1 材料
1.1 细胞株、主要试剂及仪器 人乳腺癌细胞MDA-MB-231,由中山大学药学院药理学实验室惠赠。DMEM培养基、胰酶购自Gibco公司,胎牛血清(FBS)购自杭州四季青工程材料有限公司、EGCG、Hoechst 33258染色试剂盒购自Sigma公司,CCK-8检测试剂盒,Caspase-3检测试剂盒、JC-1检测试剂盒、BCA蛋白定量试剂盒均购自碧云天生物技术有限公司。GRP78、caspase-3单克隆抗体为Santa Cruz公司产品,β-actin单克隆抗体为艾比玛特生物医药(上海)有限公司产品,辣根过氧化物酶标记的二抗为武汉博士德生物工程有限公司。
1.2 仪器 CO2培养箱(美国热电公司);倒置荧光显微镜IX-71(日本Olympus公司);BioTek酶标仪(德国Synergy HT公司);Milli-Q Biocel超纯水仪(美国Millipore公司);Mini-Prote电泳仪(美国伯乐公司)图像采集系统(日本Olympus公司);细胞培养板(美国Corning公司)。
2 方法
2.1 细胞培养及药液配制 MDA-MB-231细胞常规培养于含10%灭活新生牛血清、100 kU·L-1青霉素和100 mg·L-1链霉素的DMEM培养液中,置于37℃、5%CO2培养箱中培养,2~3 d传代1次,取对数生长期细胞进行实验。EGCG以DMEM培养液稀释至终浓度使用。
2.2 CCK-8法检测细胞的增殖抑制率 实验设空白对照组,细胞对照组,10、20、40、80、160 mg·L-1EGCG 5个浓度处理组每组设3个复孔,取对数生长期的MDA-MB-231细胞,0.25%胰酶溶液充分消化后用DMEM培养液稀释成单细胞悬液,调整细胞密度为2×107·L-1,细胞对照组和药物处理组每孔加入细胞悬液100 μl,空白对照组加入100 μl培养液接种于96孔培养板,接种过程细胞悬液保持吹打和晃动使细胞分布尽量均匀,置于37℃、5%CO2的恒温培养箱中培养24 h待细胞贴壁后,弃掉原培养基,向每孔加入含药培养基100 μl放入培养箱内继续培养 12、24、48 h 作用结束后,加入10 μl的 CCK-8,在培养箱内培养60 min后,在酶标仪450 nm波长处测定吸光度(A)值,计算肿瘤细胞存活率。肿瘤细胞存活率/%=(处理组A值-对照组A值)/(对照组A值-空白对照组A值)×100%,通过IC50计算软件计算IC50值,实验重复3次。
2.3 Hoechst33258染色法观察细胞凋亡的形态学改变 取对数生长MDA-MB-231细胞,以 1×105个/孔的密度接种于6 孔培养板,20、40、80 mg·L-1EGCG作用24、48 h后,吸出培养液,PBS漂洗1次,加4%多聚甲醛4℃固定30 min,PBS漂洗2次,加入1 ml终浓度为10 mg·L-1的 Hoechst33258染色液,避光染色30 min,PBS漂洗2次,倒置荧光显微镜观察并拍照,实验重复3次。
2.4 线粒体膜电位(mitochondrial membrane potential,Δψm)检测 JC-1是一种广泛用于检测线粒体膜电位的理想荧光探针。取对数生长期细胞加入20、40、80 mg·L-1EGCG 作用24、48 h 后,PBS 洗两遍,按试剂盒说明加入1 ml细胞培养液和1 ml JC-1染色工作液混匀,37℃孵育20 min,孵育结束后用JC-1染色缓冲液(1×)洗涤2次,加入培养液,冰浴保存,30 min内在荧光显微镜观察,JC-1单体的最大激发波长为514 nm,最大发射波长为529 nm;JC-1聚合物的最大激发波长为585 nm,最大发射波长为590 nm,实验重复3次。
2.5 caspase-3活性检测 caspase-3活性检测试剂盒采用分光光度法检测细胞裂解液中caspase-3活性。casepase-3可以催化底物Ac-DEVD-pNA(acetyl-Asp-Glu-Val-Asp p-nitroanilide)产生黄色的pNA(p-nitroani-line),从而可以通过测定吸光度来检测caspase-3的活性,具体检测步骤参照试剂盒说明书进行,实验重复3次。
2.6 Western 印迹法检测 GRP78、caspase-3 蛋白的表达 取对数生长期MDA-MB-231细胞,制成单细胞悬液,8×105个/孔,加入不同浓度EGCG作用48 h后,终止培养,收集细胞,4℃预冷的PBS洗涤细胞3次,加入75 μl细胞裂解液,冰上裂解30 min后,提取细胞总蛋白,BCA法测蛋白浓度。确定上样蛋白约30 μg,10%SDS-PAGE聚丙烯酰胺凝胶电泳分离蛋白,50 V湿转120 min转至PVDF上,用5%脱脂牛奶的封闭液4℃封闭过夜。洗膜后,加入兔抗GRP78抗体(1∶500稀释)过夜,辣根过氧化物酶标记的二抗(1∶2 000稀释)反应2 h。按照MILLIPORE公司Immobilon Western Chemiluminescent HRP Substrate试剂盒说明,将化学发光增强液A和B两种试剂等体积混匀涂抹于PVDF膜上。用Bio-Rad凝胶成像系统获取图像,实验重复3次。
2.7 统计学方法 采用SPSS 13.0统计学软件进行数据处理,结果以±s表示,组间差异采用单因素方差分析。
3 结果
3.1 EGCG对MDA-MB-231细胞增殖的抑制作用 实验中观察了5个浓度的EGCG在3个不同时间点对MDA-MB-231细胞增殖抑制的量效和时效关系,结果表明 10、20、40、80、160 mg·L-1EGCG作用随着其浓度的增加和作用时间的延长,细胞存活率逐渐降低,见Fig 1。作用12、24、48 h后的IC50分别为 69.1、40.4、29.4 mg·L-1。
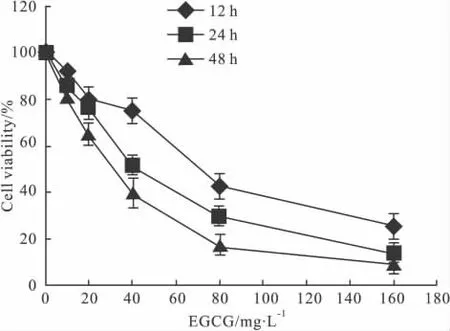
Fig 1 Effects of EGCG on cell viability of MDA-MB-231
3.2 Hoechst33258染色观察EGCG作用后细胞凋亡的形态 Hoechst 33258染色观察,对照组细胞核形态正常,细胞发出淡蓝色荧光,染色均匀,随着EGCG浓度的增加,逐渐出现各期凋亡细胞形态:细胞核皱缩变形,染色质浓集,部分细胞呈现致密浓染,呈现高度凝聚、边缘化,甚至裂解为碎块,产生凋亡小体,且中浓度和高浓度组在细胞数量上也明显减少(Fig 2)。
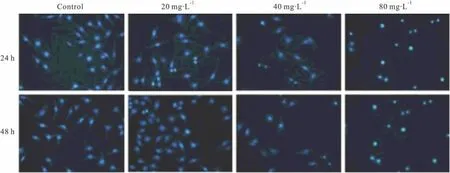
Fig 2 The morphological changes of MDA-MB-231 apoptosis induced by EGCG(stained with Hoechst 33258 ×200)
3.3 EGCG对MDA-MB-231细胞线粒体膜电位的影响 线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。通过JC-1从红色荧光到绿色荧光的转变可以检测到细胞膜电位的下降。结果显示:EGCG刺激MDA-MB-231细胞24 h后,随着浓度的增加,与阴性对照和阳性对照药CCCP作用后相比40,80 mg·L-1EGCG组红色荧光向绿色荧光转变较明显(Fig 3)。
3.4 EGCG对MDA-MB-231细胞caspase-3活性的影响 通过caspase-3活性检测试剂盒对EGCG作用48h后caspase-3的活性进行检测,结果表明:EGCG低浓度作用时caspase-3的活性激活不明显,中、高浓度EGCG均可明显增强caspase-3的活性(Fig 4)。
3.5EGCG 对 MDA-MB-231 细胞 GRP78、caspase-3蛋白表达的影响 40、80 mg·L-1EGCG作用48 h后通过Western blot检测GRP78、caspase-3蛋白表达情况,从见Fig 5可看出,EGCG随着剂量的增加可明显抑制GRP78蛋白的表达,而活性caspase-3蛋白表达是明显增强的。
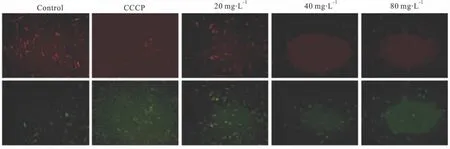
Fig 3 Effects of EGCG on mitochondrial membrane potential in MDA-MB-231(stained with JC-1 ×200)
4 讨论
TNBC占所有乳腺癌患者的15% ~20%,在我国近1/4患者为三阴乳腺癌。TNBC具有侵袭性高、恶性程度高、易转移和复发、预后差、生存率低等特点。目前对于TNBC在临床上仍然没有统一的标准治疗方案,关于TNBC治疗的靶点和靶向药物研究也非常有限[5]。
很多研究表明[6-9]EGCG在体内体外具有较好的抗肿瘤作用,本实验观察了EGCG对三阴乳腺癌细胞MDA-MB-231增殖、细胞凋亡、线粒体膜电位变化以及葡萄糖调节蛋白78(glucose regulatd protein 78,GRP78)和活性caspase-3表达的影响,结果表明EGCG能明显抑制MDA-MB-231细胞增殖,促进其凋亡。
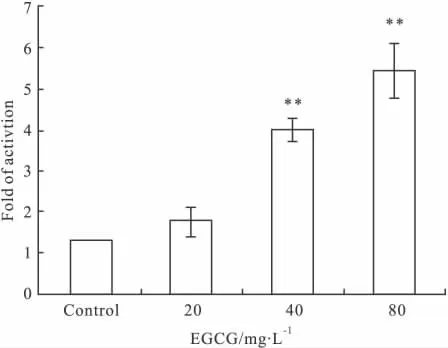
Fig 4 Effects of EGCG on activities of caspase-3 in MDA-MB-231
文献报道[10-11],抗癌药物诱导细胞凋亡的机制主要有线粒体介导的内源性途径和死亡受体诱导的外源性途径。肿瘤细胞由于生长旺盛常处于糖缺乏,酸中毒和低氧状态,导致细胞中低糖基化,未折叠蛋白在内质网中积聚,产生内质网应激(Endoplasmic reticulum stress,ERS)。GRP78 是细胞内质网内分泌的一种蛋白,是公认的ERS中最重要、最具有代表性的应激蛋白之一,其作为内质网中主要的分子伴侣,参与新合成蛋白质的转运和高级结构折叠及跨内质网膜转运。当肿瘤细胞处于ERS时,GRP78 大量表达[12],目前许多研究证实[13-14],在肺癌、肝癌等多种肿瘤细胞中,ERS诱导通路的持续活化可抑制肿瘤细胞凋亡、促进细胞的侵袭和转移,引起对化疗药物的耐药性增加。有文献报道[15-17],下调GRP78可逆转肿瘤多重耐药,降低肿瘤细胞的侵袭转移能力。因此,抑制肿瘤细胞发生过强的ERS可能是治疗肿瘤更有前景的潜在靶点[18-19]。
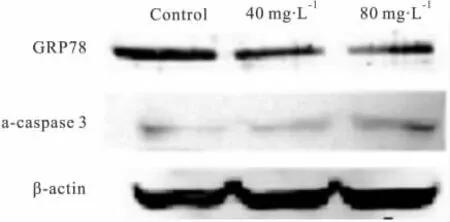
Fig 5 Effects of EGCG on expression of GRP78 and a-caspase-3 in MDA-MB-231
本研究发现40,80 mg·L-1EGCG刺激 MDAMB-231细胞48h明显下调了GRP78的表达,提示EGCG所引起的细胞凋亡可能与抑制了MDA-MB-231细胞过度的ERS有关。
综上,本实验证实了EGCG能明显抑制三阴乳腺癌细胞MDA-MB-231增殖,其机制可能与抑制GRP78蛋白表达,增强caspase-3活性诱导其凋亡有关。那么EGCG能否通过抑制ERS增强三阴乳腺癌对化疗药物的敏感性,其机制如何,还需要进一步通过实验深入研究,以期为临床联合应用化疗药物治疗三阴乳腺癌提供实验基础和联合用药策略。
[1]Dent R,Trudeau M,Pritchard K I,et al.Triple-negative breast cancer:clinical features and patterns of recurrence[J].Clin Cancer Res,2007,13:4429-34.
[2]Tischkowitz M,Brunet J S,Begin L R,et al.Use of Immunohistochemical markers can refine prognosis in triple negative breast cancer[J].BMC Cancer,2007,7:134- 8.
[3]Bachrach U,Wang Y C.Cancer therapy and prevention by green tea:role of ornithine decarboxylase[J].Amino Acids,2002,22:1-13.
[4]Xi W,Miao W H,Ke D,et al.Apoptosis induction effects of EGCG in laryngeal squamous cell carcinoma cells through telomerase repression[J].Arch Pharm Res,2009,32(9):1263-9.
[5]Edith A P,Tejal P,Alvaro M A.Efficacy of ixabepilone in ER/PR/HER2-negative(triple-negative)breast cancer[J].Breast Cancer Res Treat,2010,121:261-71.
[6]Zhang Q,Fu H J,Pan J,et al.Effect of dietary polyphenon E and EGCG on lung tumorigenesis in A/J Mice[J].Pharm Res,2010,27:1066-71.
[7]Yan C X,Yang J H ,Shen L,et al.Inhibitory effect of Epigallocatechin gallate on ovarian cancer cell proliferation associated with aquaporin 5 expression[J].Arch Gynecol Obstet,2012,285:459-67.
[8]Surh Y J.NF-κ B and AP-1 as molecular targets for chemoprevention with EGCG,a review[J].Environ Chem Lett,2006,4:137-41.
[9]Nishant M,Karmakar S,Naren L B,et al.SU5416 and EGCG work synergistically and inhibit angiogenic and survival factors and induce cell cycle arrest to promote apoptosis in human malignant neuroblastoma SH-SY5Y and SK-N-BE2 cells[J].Neurochem Res,2011,36:1383-96.
[10]Yeh T C,Chiang P C,Li T K,et al.Genistein induces apoptosis in human hepatocellular carcinomas via interaction of endoplasmic reticulum stress and mitochondrial insult[J].Biochem Pharmacol,2007,73:782-92.
[11]李禄椿,高 青,颜晓丽.葡萄糖调节蛋白与胃癌细胞化疗敏感性的关系[J].重庆医科大学学报,2011,36(1):46-50.
[11]Li L C,Gao Q,Yan X L.Research on the relation between expression GRP78 in gastric cancer cell lines and its sensitivity to chemotherapeutic drugs[J].J Chongqing Med Univ,2011,36(1):46-50.
[12]Zhang L H,Zhang X.Roles of GRP78 in physiology and cancer[J].J Cell Biochem,2010,110:1299-305.
[13]Tan Y H,Lee K H,Lin T,et al.Cytotoxicity and proteomics analyses of OSU030 in lung[J].Cancer Clin Cancer Res,2008,14:1823-30.
[14]Su R,Li Z,Li H,et al.Grp78 promotes the invasion of hepatocellular carcinoma[J].BMC Cancer,2010,10:20.
[15]Park H R,Ryoo I J,Choo S J,et al.Glucose-deprived HT-29 human colon carcinoma cells are sensitive to verrucosidin as a GRP78 down-regulator[J].Toxicology,2007,229:253-61.
[16]Jiang C C,Mao Z G,Avery-Kiejda K A,et al.Glucose-regulated protein 78 antago nizes cisplatin and adriamycin in human melanoma cells[J].Carcinogenesis,2009,30,197-204.
[17]Kuo T C,Chiang P C,Yu C C,et al.A unique P-glycoprotein interacting agent displays anticancer activity against hepatocellular carcinoma through inhibition of GRP78 and mTOR pathways[J].Biochem Pharmacol,2011,81,1136-44.
[18]Lee E,Nichols P,Spicer D,et al.GRP78 as a novel predictor of responsiveness to chemotherapy in breast cancer[J].Cancer Res,2006,66:7849-53.
[19]程 秀,刘 浩,方 琳,等2DG增强乳腺癌细胞对阿霉素化疗敏感性的 作用[J].中国药理学通报,2010,26(10):1371-6.
[19]Cheng X,Liu H,Fang L,et al.2-DG enhances chemosensitivity of breast cancer cell to adriamycin[J].Chin Pharmacol Bull,2010,26(10):1371-6.