基于代谢组学的六味地黄丸干预大鼠甲亢模型的作用研究
2013-12-07从文娟朱云云
王 彬,沈 岚,从文娟,朱云云,王 强,冯 怡
(上海中医药大学1.中药现代制剂技术教育部工程中心、2.中药学院,上海 201203)
甲状腺功能亢进症(hyperthyroidism,简称甲亢)是由于甲状腺激素增多,兴奋机体各系统,出现物质、能量代谢亢进现象。常见症状为多食易饥、血糖升高、体重减轻、心动过速、急躁、乏力等。现代医学的治疗方法是通过抑制和破坏甲状腺使甲状腺激素合成减少而达到治疗的目的。然而,这种治疗方法不能从病因治疗,且易发生不良反应,特别是对于机体极为亏虚的情况,更需要滋阴补虚药物的干预。六味地黄丸在滋阴补虚、调节免疫力等方面发挥明显的优势,由熟地黄、山药、牡丹皮、茯苓、泽泻、山茱萸经加工制成。有研究表明,它能够降低血糖、增加肝糖元含量[1]。地黄中的地黄苷D调节机体糖代谢,起到滋阴补血和降血糖的作用;芍药苷对补血及抗心、脑血管损伤有一定的作用,改善能量代谢障碍;六味地黄丸中的多糖CA4[2-3]还能刺激脾分泌IgG和抗体细胞,具有免疫功效。
代谢组学是以“整体性研究”和“动态性研究”为特点的一门新学科[4],与中医药的整体动态性原则具有很大的趋同性,因此被认为是最有可能对中医药研究有所突破的工具[5-6],代谢组学技术在某些病的诊治中具有良好的应用前景,同时也为中医药的整体评价和研究提供了可能[7]。
本文采用UPLC-QTOF-MS技术分析甲亢模型大鼠、正常对照大鼠、六味地黄丸给药组大鼠的血样成分谱变化,结合模式识别方法分类,寻找并解释标记物归属,联系机体物质和能量代谢的代谢通路和代谢网络[8-9],进一步阐释甲亢模型的产生机制和六味地黄丸的干预机制。这种方法为全面建立一种基于代谢组学的手段来诊断甲亢的病因和评价六味地黄丸治疗作用,提供一定的参考。
1 材料与方法
1.1 药品与试剂 六味地黄丸(北京同仁堂科技发展股份有限公司制药厂,批号:1074785);L-左旋甲状腺素钠(L-Thyroxine Sodium)(阿拉丁试剂,规格:1 g/支,批号:1100477)。LC-MS级乙腈购自J.T.Baker公司(J.T.Baker Chemical Co.,USA),HPLC级甲醇购自 Merck公司(Darmstadt,Germany),甲酸购自 Fluka公司(Buchs,Switzerland)。其它试剂均为市售分析纯。超纯水(18.2 MΩ)由本实验室Milli-Q超纯水系统(Millipore,France)制备。
1.2 实验动物 19只 ♂ SD大鼠(140~160 g),购自上海斯莱克实验动物有限责任公司。饲养于上海中医药大学清洁级动物房,室温(24±0.8)℃,相对湿度60%,光照采用12 h明暗交替。
1.3 实验仪器 Waters AcquityTM超高效液相色谱系统(Waters,Millford,MA),配备高压二元梯度泵、可控温自动进样器(4℃)和二极管阵列检测器;质谱检测采用Waters Premier TOF飞行时间质谱仪(Waters,Millford,MA),配有 ESI电离源接口和Lock-spray接口。FA1004N型电子天平(上海精密科学仪器有限公司);SK52004超声清洗装置(上海科导超声仪器有限公司);TGL-16B高速离心机(上海安亭科学仪器厂)。
1.4 造模及取样 大鼠适应性饲养1周,后4天连续灌胃生理盐水,使习惯灌胃及适应环境。后随机分成2组:模型组12只,按35 μg·(100 g)-1皮下注射L-左旋甲状腺素钠续造模1周[10];另7只作为正常对照组,给予适量的生理盐水对照。
将造模成功的12只大鼠,随机分为2组,每组6只,分别为给药组和模型组。实验期间,给药组按剂量4.7 g·kg-1给以六味地黄丸溶液;模型组大鼠灌胃给予等体积的生理盐水。每天上午7:00~8:00给药,1日1次,连续给药3周。3周后,各大鼠腹主动脉取血,离心得血清。
1.5 血清样品处理 取冻融后的血清100 μl,加入400 μl甲醇,涡旋2 min,充分混匀,离心(13 000 r·min-1,4℃,15 min)沉淀蛋白,取上清液。取200 μl加入10 μl内标(1 g·ml-1氯苯丙氨酸水溶液),涡旋(3 000 r·min-1,2 min),取上清液于玻璃进样小瓶,备用。
1.6UPLC/QTOF-MS分析 色谱质谱分析采用Waters Acquity UPLC超效液相色谱仪和Q-TOF质谱联用仪,电喷雾(ESI)离子源。色谱条件:色谱柱采用Waters公司AcquityTM-BEH C18反相分析柱(100×2.1 mm,1.7 μm,Waters,MA,USA),流动相为0.1%甲酸水溶液-1% 乙腈(A)和纯乙腈-0.1% 甲酸-1% 水(B),流速0.4 ml·min-1,自动进样器温度设定4℃,氮气为载气。采用梯度洗脱方式,设置如下:血清正离子:0~4 min(1% ~30%B),4~6 min(30% ~80%B),6~8 min(80% ~90%B),8~9 min(90% ~100%B),9~11 min(100%B),11~13 min(100% ~1%B);血清负离子:0~1 min(1~20%B),1~3 min(20~70%B),3~8 min(70~85%B),8~9 min(85~100%B),9-11 min(100%B),11-13 min(100-1%B)。质谱条件:质谱分析检测参数:脱溶剂气流量650 L·min-1,脱溶剂气温度350℃,锥孔气流量50 L·h-1,离子源温度110℃,毛细管电压3000 V,正离子模式采用锥孔电压35 V、负离子模式采用锥孔电压55 V,质量校准选择“DRE”模式,取LEA“A+1”和“A-1”同位素峰(正离子模式556.2771 m·z-1)、(负离子模式554.2615 m·z-1)作为质量校准峰。质谱图平均扫描速率设为0.28 s~0.02 s,质量扫描范围50~1000 m·z-1,每次进样5 μL,样品运行按照随机顺序进行。
1.7 方法学考察 取空白血样连续进样6次,考察正、负离子下总离子流色谱图中的8个主要指纹峰的保留时间(Retention time)和峰强度(Intensity)的变化情况。结果表明代谢指纹谱中主要指纹峰的保留时间RSD均小于0.3%,峰面积RSD均小于5.0%。因此,该方法稳定可靠,重现性良好,可以满足后续代谢组学分析的要求。
1.8 数据处理 质谱数据处理采用Waters公司Masslynx软件(Waters,MA,USA)进行色谱峰自动识别、峰匹配、峰对齐、峰提取和归一化处理(主要参数见Tab 1),再将数据导入SIMCA-P(11.5 demo version,Umetrics AB,Ume,Sweden)进行 PLS-DA数据分析。
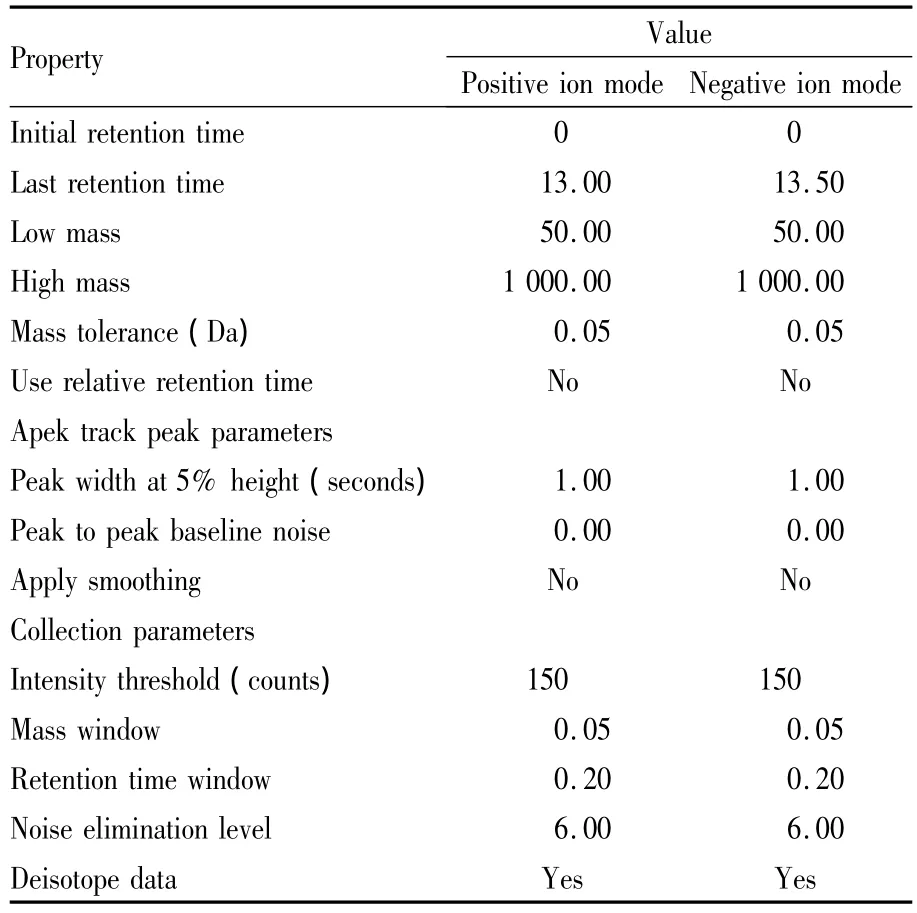
Tab 1 The parameter sets for identification of chromatographic peak
2 结果
2.1 动物特征和变化 造模一周后,模型组大鼠出现毛色黄暗而不顺、脾气暴躁、饮水量增多、鼠笼潮湿、便多、心率加速等症状,模型组大鼠相对空白组大鼠的体重降低、体温升高(如Tab 2所示),预示造模成功。服用六味地黄丸3周后,相对模型组,给药组的大鼠的毛色柔顺、便量减少、心率减缓;上述的脾气暴躁、饮水量增多、鼠笼潮湿等症状也有所缓解;体重和体温也趋于正常(如Tab 2所示)。
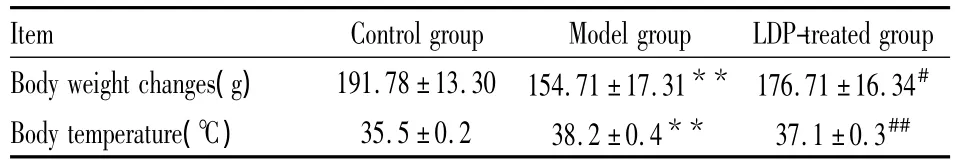
Tab 2 The different groups of body temperatureand body weight changes(n=6)
2.2 血清UPLC-QTOF-MS代谢指纹谱的构建预实验中,本研究采用少量样本对实验条件优化,分别考察样品在正负模式下的响应情况。结果发现正负模式下噪音和基质效应都较低,都可以提供丰富的信息,正离子模型检测到的离子大都以[M-H]-和[M+COOH]-的形式出现,负离子模型检测到的离子大都以[M+H]+和[M-COOH]+的形式出现。
由于样品的成分复杂,对于许多化学性质和极性差异较大的成分,采用常规线性梯度无法在短时间内对其同时分离。在本实验条件下,我们选择了两阶线性梯度方式,既可保证这些物质的有最佳的分离效果,又能提高分析速度。在流动相体系中加入甲酸,能使样品中尤其是酸性化合物的色谱分离得到改善。色谱条件优化重点考察了流速和柱温对UPLC分离的影响,最终确定了上述的几种液-质联用条件。以根据参数优化后得到代表性的大鼠空白血清为例,展示UPLC-QTOF-MS代谢指纹谱,如Fig 1、2 所示。
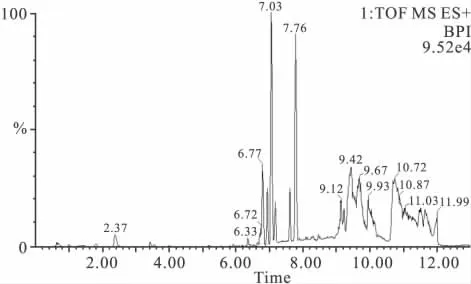
Fig 1 The metabolic fingerprinting of normal rat serum at positive ion mode
2.3 不同组别代谢指纹图谱差异 本研究采用SIMCA-P软件对Masslynx软件处理的正常对照组、模型组、六味地黄丸给药组3组数据进行PLS-DA分析(如Fig 3、4所示)。从PLS-DA聚类score图可以看出,3组都能达到很好的分离,且给药组位于模型组和正常对照组的中间。以上结果说明正常对照组和模型组间内源性代谢物的含量存在明显差异,给予药物后,异常代谢改善。代谢组学分析的结果更加直观、明确、综合反映了模型的诱导和六味地黄丸干预甲亢模型的优势。
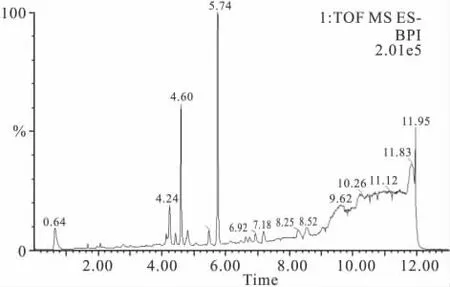
Fig 2 The metabolic fingerprinting of normal rat serum at negative ion mode
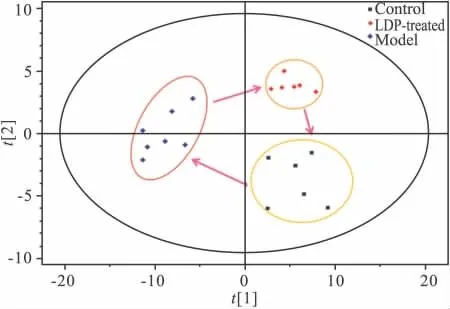
Fig 3 The PLS-DA clustering score map of serum at positive ion for control group(n=7),LDP-treated group(n=6)and model group(n=6)
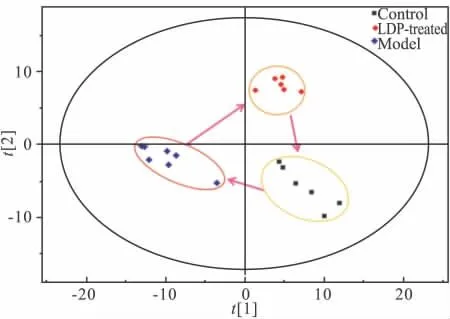
Fig 4 The PLS-DA clustering score map of serum at negative ion for control group(n=7),LDP-treated group(n=6)and model group(n=6)

Tab 3 Identification of potential biomarkers in serum
2.4 潜在生物标志物的指认 在代谢组学分析过程中,对潜在生物标志物的指认是一个非常重要的过程,也是代谢组学研究中的一个难点。采用PLSDA对数据进一步分析,VIP值越大对分组的贡献也越大,利用VIP>1再结合t检验,筛选出差异具有显著性(P<0.05)的化合物被认为对模型有显著贡献。结果正离子模式找到15个具有明显差异的化合物,负离子模式找到5个具有明显差异的化合物(如Tab 3)。TOF-MS可以获得的这些潜在生物标记物的精确分子量,使用Waters公司的Masslynx软件中的i-FIT功能,对所筛查到的具有显著性差异的代谢物进行分析,计算可能的分子式。然后利用公共数据库KEGG(http://www.genome.jp/kegg/ligand.html)和HMDB(http://redpoll.pharmacy.ualberta.ca/~aguo/www_hmdb_ca/HMDB/)等对化合物进一步鉴定[11]。
Tab 3中,相比较正常大鼠,甲亢模型大鼠机体内的草酰乙酸(Oxalacetic acid)、磷酸二羟基丙酮(DHAP)、乙基葡糖苷酸(Ethyl glucuronide)、羟基犬尿氨酸(Hydroxykynurenine)、甘油三酯(TG,Triglycerides)、溶血磷脂(lysophospholipids)和胆固醇(cholesterol)呈明显上调趋势。此外,模型大鼠服用六味地黄丸治疗一段时间后,其体内的草酰乙酸(Oxalacetic acid)、磷酸二羟基丙酮(DHAP)、乙基葡糖苷酸(Ethyl glucuronide)发生明显下调,同时,发现其中的磷酸二羟基丙酮(DHAP,Dihydroxyacetone phosphate)、乙基葡糖苷酸(Ethyl glucuronide)、甘油三酯(TG,Triglycerides)、卵磷脂(PC,phosphatidylcholine)、甘油二酯(DG,diacylglycerol)、磷脂酰肌醇(PI,phosphatidylinositol)等的代谢水平,逐渐接近正常状态。这表明六味地黄丸对甲亢具有一定的治疗作用。
3 讨论
目前,关于六味地黄丸,大多研究集中在探讨其治疗肾阴虚的作用机制,鲜有关于六味地黄丸治疗甲亢的机制研究的报道。王喜军[12]采用 UPLCHDMS技术针对大鼠的尿液进行代谢组学研究,推测六味地黄丸可以改善肾阴虚机体的物质和能量代谢;高岗[13]采用LC-TOF-MS研究了阴虚大鼠的血浆,仅推测其发病机制与脂质代谢有关。由于血液作为生物体系统中最为重要的生物体液,其不仅担负着生命系统中各种营养成分向不同组织、器官的实时补充和转运的任务,还是机体输出各种代谢产物的主要途径。因此本文采用正、负2种不同的检测模式,对甲亢大鼠服用六味地黄丸后的血清进行UPLC-QTOF-MS的分析,结合统计学分析和KEGG、HMDB数据库研究,不仅可以阐明甲亢的诱发机制,还可以进一步解析六味地黄丸的治疗作用研究。
在预实验中,六味地黄丸给药组采用低中高不同的剂量,其中低剂量组0.95 g·kg-1,相当于人剂量的1倍;中剂量组4.7 g·kg-1,相当于人剂量的5倍;高剂量组9.5 g·kg-1,相当于人剂量的10倍。在实验过程中,我们发现低剂量组的效果不如中剂量明显,而高剂量组的大鼠由于药物浓度过大,影响胃肠的正常功能,出现机体消瘦、甚至出现大量死亡等现象。所以正式实验中采用4.7 g·kg-1六味地黄丸药量作为最佳的给药剂量。
研究结果显示模型组大鼠体内草酰乙酸含量升高,推测三羧酸循环受阻;磷酸二羟基丙酮和乙基葡糖苷酸的含量均升高,乳酸含量降低,推测糖代谢出现紊乱;甘油三酯、溶血磷脂、胆固醇等含量呈现增加趋势,推测脂质代谢也发生了紊乱。糖类、脂类代谢水平及三羧酸循环反映机体内物质能量代谢情况[14]。在甲亢机体内,造模药物甲状腺激素类兴奋交感神经系统,代谢酶大量合成[15],代谢加速,引起机体过耗,导致了全身机能减退,出现代谢紊乱。这与我们在实验期间观察到的大鼠毛色黄暗而不顺、体重减轻、体温升高、心率加速、脾气暴躁、饮水量增多、鼠笼潮湿、便多等症状相吻合,说明采用L-左旋甲状腺素钠造甲亢阴虚的模型成功,也为准确判断六味地黄丸干预甲亢的效果奠定基础。
模型动物给予六味地黄丸后,大部分关键标志物的代谢水平可以回调接近正常状态。给药后大鼠体内的草酰乙酸含量相对模型组的有所降低,推测三羧酸循环受阻的现象有所改善;磷酸二羟基丙酮和乙基葡糖苷酸的含量也相对模型组有所降低,乳酸含量升高,推测糖代谢紊乱也有所改善;甘油三酯、溶血磷脂、胆固醇等含量也有一定的调节回调正常,推测脂质代谢紊乱也有改善。这提示我们从对机体代谢的调节角度而言,六味地黄丸对甲亢大鼠具有一定的修复作用。六味地黄丸中从糖代谢、酶活性等能量代谢和免疫调节等方面来改善机体,使机体调至正常,使机体趋向于正常。
[1]刘保林,温文清,朱丹托.六味地黄汤及其组方对小鼠血糖和肝糖元的影响[J].中国中药杂志,1991,16(7):437-8.
[1]Liu B L,Wen W Q,Zhu D T.Effeet of liuweidihuang decoction and Its compositions on blood suger and glycogen in mice [J].China J Chin Mater Med,1991,16(7):437-8.
[2]齐春会,张永祥,乔善义.六味地黄多糖体外对正常及衰老小鼠脾细胞免疫功能的影响[J].中国药理学通报,1999,15(2):157-60.
[2]Qi C H,Zhang Y X,Qiao S Y.Effects of polysaccharides from liuweidihuang decoction on the splenocyte immune functionin vitro[J].Chin Pharmacol Bull,1999,15(2):157-60.
[3]齐春会,付艳荣,张永祥.六味地黄多糖CA4-3对小鼠B细胞功能的作用[J].中国药理学通报,2001,17(4):469-73.
[3]Qi C H,Fu Y R,Zhang Y X.Effect of CA4-3,the acid polysaccharides isolated from Liuwei Dihuang Decoction,on the function of B lymphocytes in mice[J].Chin Pharmacol Bull,2001,17(4):469-73.
[4]刘树民,卢 芳,王喜军,等.基于代谢组学的热病证候模型评价方法研究[J].中国药理学通报,2009,25(4):549-51.
[4]Liu S M,Lu F,Wang X J.Research on evaluation methods of the fever syndrome model based on metabonomics[J].Chin Pharmacol Bull,2009,25(4):549-51.
[5]Qiu J.Traditional medicine:A culture in the balance[J].Nature,2007,448:126-8.
[6]Qiu J.Back to the future for Chinese herbal medicines[J].Nat Rev Drug Discov,2007,6(7):506-7.
[7]从文娟,刘清飞,梁琼麟,等.基于血清代谢组学的吡柔比星注射剂的累积毒性作用研究[J].中国药理学通报,2012,25(9):1294-8.
[7]Cong W J,Liu Q F,Liang Q L.Serum metabolites of commerical pirarubicin injections[J].Chin Pharmacol Bull,2012,25(9):1294-8.
[8]夏建飞,王义明,罗国安.代谢组学研究策略与方法的新进展[J]. 分析化学,2009,37(1):136-43.
[8]Xia J F,Wang Y M,Luo G A.Recent trends in strategies and methodologies for metabonomics[J].Chin J Analyt Chem,2009,37(1):136-43.
[9]Kell D B.Metabolomics and systems biology:making sense of the soup[J].Curr Opin Microbiol,2004,7(3):296-307.
[10]郭 娟,陈长勋,李 欣.加减玉女煎抗甲状腺机能亢进作用的研究[J]. 中国中药杂志,2009,34(18):2369-72.
[10]Guo J,Chen C X,Li X.Experiment research of Jiajian Yunvjian granules on hyperthyroidism graves[J].China J Chin Mater Med,2009,34(18):2369-72.
[11]Weckwerth W.Metabolomics in systems biology[J].Annu Rev Plant Biol,2003,54:669-89.
[12]Wang P,Sun H,LÜ H T.Thyroxine and reserpine-induced changes in metabolic profiles of rat urine and the therapeutic effect of Liu Wei Di Huang Wan detected by UPLC-HDMS [J].J Pharm Biomed Anal,2010,53(3):631-45.
[13]高 岗.肾虚证代谢组学及六味地黄汤的干预研究[D].上海:上海第二军医大学,2009.
[13]Gao G.The intervention study of kidney deficiency metabolomics and the Liuweidihuang[D].Shanghai:The second military medical university,2009.
[14]Buettner R,Parhofer K G,Woenckhaus M.Defining high-fat-diet rat models:metabolic and molecular effects of different fat types[J].J Mol Endocrinol,2006,36(3):485-501.
[15]但汉雄.甲状腺机能对肝脏药物代谢酶的影响[J].中国药理学通报,1996,12(6):569.
[15]Dan H X.Thyroid function to the influence of the liver drug metabolizing enzymes [J].Chin Pharmacol Bull,1996,12(6):569.