杜仲叶总黄酮微波辅助提取工艺的优化及其抗氧化活性研究
2013-12-06李旭,刘停
李 旭,刘 停
(南昌大学科学技术学院,江西南昌330029)
杜仲,为杜仲科植物杜仲(Eucommia ulmoides Oliver)的干燥树皮,是中国特有的名贵滋补药材。研究结果表明,杜仲在促进机体功能,抗衰老、抗癌等方面的效果十分明显,尤其是对血压的双向调节作用,是任何化学药物无法比拟的,属上等的老年保健药物,其提取物在我国作为药食同源的保健食品成分已有广泛使用[1]。杜仲中主要含有木脂素类、环烯醚萜类、黄酮类、多糖、氨基酸和杜仲胶等有机化合物,及钙、铁等无机元素[2]。其所含的黄酮类化合物是杜仲的主要有效成分之一,具有抗氧化,清除自由基的活性[3]。人工合成的抗氧化剂如BHT,TBHQ(特丁基对苯二酚)等,虽然具有较强的抗氧化能力,但经研究发现它们有一定的毒性,TBHQ在日本已被禁止使用,BHT在美国也已被禁止使用。因而寻找安全、天然的食品抗氧化剂日益成为研究热点[4]。其中,黄酮类化合物的抗氧化活性是研究的重点之一,主要表现在减少自由基的产生和清除自由基[5]。杜仲不同部位中总黄酮的含量有很大的差别,以杜仲叶(尤其是老叶)中的总黄酮含量最高[6]。近年来的研究表明,杜仲叶与皮有相似的化学成分和药理作用,可代皮供药用,解决了杜仲药源匮乏的问题[7]。因此研究从杜仲叶中提取黄酮的优化工艺,对提高杜仲的经济价值具有较高的现实意义和广泛的应用前景。微波辅助提取作为一种新型提取工艺,在天然产物活性成分提取中广泛使用[8],它具有控制方便、升温速度快等优点,特别适合热敏性物质的提取[9-10]。响应面分析法是应用合理的实验设计,采用多元二次回归方程来拟合因素与响应值之间的函数关系,通过对响应面等值线的分析来寻求最优工艺参数,解决多变量问题的一种统计分析方法[11-12]。本实验将微波辅助提取技术应用于杜仲叶中总黄酮的提取,并通过响应面法对杜仲叶中总黄酮的提取工艺条件进行优化,并测定了提取物的体外抗氧化活性,为杜仲叶中总黄酮微波辅助提取制备食品用天然抗氧剂的工业化生产提供理论依据。
1 材料与方法
1.1 材料与仪器
杜仲叶 产地湖南张家界,购于南昌市医药公司,经南昌大学生命科学与食品工程学院植物教研室黄兆祥教授鉴定为杜仲科植物杜仲(Eucommia ulmoides Oliver)的干燥树叶;柚皮苷(批号:110722-201107)标准品、橙皮苷(批号:110721-201114)标准品 购自中国食品药品检定研究院;乙腈、甲醇 为色谱纯;水 为自制二次蒸馏水;其余试剂 均为分析纯,购自国药试剂有限公司。
LC-15C型高效液相色谱仪、SPD-15C紫外可见双波长检测器 日本岛津公司;XFB500型植物粉碎机 湖南中诚制药机械厂;N-2000(SP1版)型色谱工作站 浙江大学智达信息工程有限公司;ORW10S-3E型微波提取装置 南京澳润微波科技有限公司;BSA224S型电子天平 德国赛多利斯;SENCOR-205B2型旋转蒸发仪 上海申生科技有限公司;Z206A台式低速离心机 贺默(上海)仪器科技有限公司;SHZ-D(Ⅲ)型循环水式真空泵 巩义市英峪予华仪器厂;UV-1750型紫外可见分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 分析检测方法
1.2.1.1 色谱条件 色谱柱为Shim-pack CLC-ODS(4.6mm×150mm,5.0μm);流动相为乙腈-0.5%乙酸溶液(pH2.90)(体积比为22∶78);流速1.0mL/min;检测波长283nm;柱温35℃;收集时间10min。在该色谱条件下柚皮苷和橙皮苷的保留时间分别为8.587min和9.659min,定量方法为外标工作曲线法。
1.2.1.2 标准曲线方程的绘制[13]精密称定柚皮苷(3.84mg)和橙皮苷(1.56mg)对照品,用甲醇溶解并定容至10mL,用0.45μm微孔滤膜过滤,作为对照品溶液。取上述配制的标准溶液,稀释成系列浓度的对照品溶液。柚皮苷:38、77、192、307、384μg/mL;橙皮苷:16、31、78、125、156μg/mL。分别精密吸取上述对照品溶液20μL注入液相色谱仪,测定其峰面积积分值。以进样量(μg)为横坐标、峰面积值为纵坐标绘制柚皮苷和橙皮苷的标准曲线,得到标准曲线方程。
1.2.2 杜仲叶中总黄酮的提取与含量测定 杜仲叶原料用微型植物粉碎机打成粉末,用不同目数药典筛过筛,在60℃条件下烘干,备用。精确称取干燥后的杜仲叶粉末样品5.0g,在圆底烧瓶中加入一定浓度的乙醇,在设定的实验条件下(微波时间、微波功率、液料比和乙醇浓度等),采用连续微波辅助提取法提取杜仲叶中总黄酮。提取结束后,提取液先经过滤分离,滤液再低速离心20min,取上清液,置于旋转蒸发仪40℃减压浓缩,再定容于1L的容量瓶中。经0.45μm微孔滤膜过滤,备用。精密吸取各供试品溶液20μL,按上述给定的色谱条件测定峰面积,以回归方程计算含量。
1.2.3 响应面分析 在单因素实验结果的基础上,选取料液比(X1)微波时间(X2)、微波功率(X3)和乙醇浓度(X4)四个对杜仲叶总黄酮得率影响较大的因素,根据Box-Beknhen实验设计原理,设计了4因素三水平的响应面实验表,总计进行29次。实验安排见表1和表2。

表1 响应面法优化杜仲叶中总黄酮的微波辅助提取工艺实验因素水平表Table 1 Coded values and corresponding actual values of the independent variables involved in response surface analysis
1.2.4 DPPH自由基清除率的测定[14]1,1-二苯基-2-三硝基苯肼(DPPH)是一种很稳定的自由基,乙醇溶液中呈深紫色,在517nm处有最大吸收峰,遇到自由基清除剂时其颜色变浅,褪色程度与清除剂的清除能力及数量正相关。因此可用分光光度法评价物质的抗氧化能力。
分别吸取不同浓度待测样品的乙醇溶液2mL,加入2×10-4mol/L的DPPH乙醇溶液2mL,摇匀后,在室温下黑暗处放置30min。以无水乙醇调零,测定517nm处的吸光度A样。同时,测定样品溶液2.0mL与乙醇2.0mL混合液在517nm处的吸光度A参比,再测定2.0mL DPPH溶液与2.0mL乙醇在517nm处的吸光度A空白。同一实验重复3次,并按下式计算清除率。以抗坏血酸为对照品。

1.2.5 超氧阴离子自由基清除率的测定[15]超氧阴离子自由基是生命代谢过程中产生的一种自由基,具有很强的氧化能力。邻苯三酚在弱碱性条件下会发生自氧化反应生成超氧自由基,从而在λ=320nm处产生吸收。加入的自由基清除剂能够抑制超氧自由基的生成,从而降低所产生的吸光度。
取4.7mL Tris-HCl(pH=8.0)置于10mL试管中,于25℃水浴中预热20min,分别加入不同浓度待测品0.1mL后均加入0.2mL邻苯三酚,混匀,水浴4min后取样,并加入10mol/L盐酸1滴终止反应,在320nm处测定所取样品吸光度A样,实验重复3次。用甲醇代替样品,测得空白对照吸光度A空白。并按下式计算清除率。以抗坏血酸为对照品。
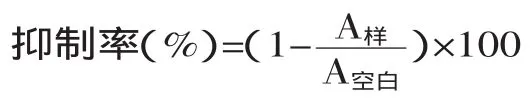
1.2.6 羟基自由基清除率的测定[16]利用H2O2和Fe2+混合发生Fenton反应,生成具有很高反应活性的·OH,在体系内加入水杨酸与·OH反应生成有色物质,在510nm下有最大吸收。若加入具有清除自由基作用的物质,便会与水杨酸竞争,从而使有色产物生成量减少。
试管中依次加入6mmol/L FeSO4溶液2mL不同浓度样品溶液2mL,6mmol/L H2O2溶液2mL,摇匀,静置10min,再加入6mmol/L水杨酸溶液2mL,摇匀,静置30min后于510nm处测得不同样品浓度下的吸光度A样,用水代替水杨酸时测得某浓度样品浓度下的吸光度A参比,用水代替抗氧化剂时测得空白对照吸光度A空白。清除率按下式计算。以抗坏血酸为对照品。

2 结果与分析
2.1 分析检测结果
以标准品色谱峰面积(Y)对进样量(X)进行回归,得出柚皮苷和橙皮苷的回归方程。柚皮苷和橙皮苷的回归方程分别为Y=1006.1X+217.05(r=0.9992)和Y=196.49X-12.86(r=0.9996),这表明在上述溶液浓度区间内,吸收峰面积与柚皮苷和橙皮苷的含量具有良好的线性对应关系。标准品与杜仲叶提取物的HPLC色谱图见图1。
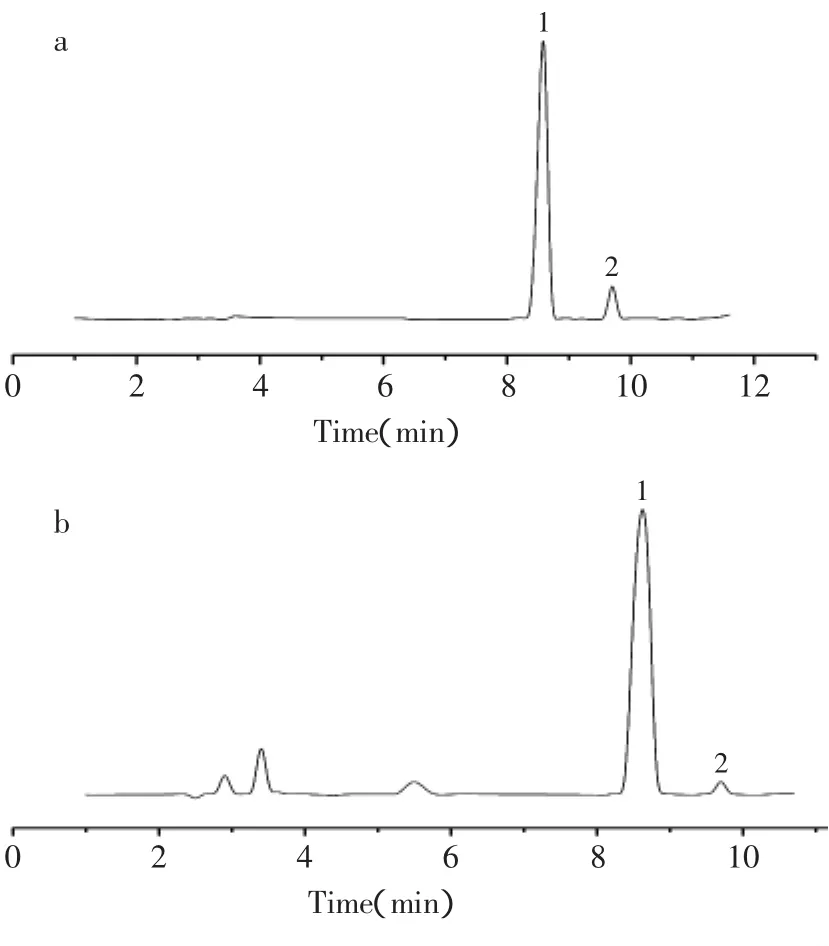
图1 标准品(a)和杜仲叶提取物(b)的HPLC图Fig.1 HPLC chromatograms of a mixture of naringin and hesperidin standard(a)and total flavonoids extractive(b)from Eucommia ulmoides leaf
2.2 单因素实验
设定样品粉末颗粒度为80目、料液比为100∶1(mL/g)、微波时间5min、微波功率800W、乙醇浓度(v/v)60%为通用提取条件,分别在固定样品目数、料液比、微波时间、微波功率和乙醇浓度条件下,逐一考察上述因素对杜仲叶柚皮苷、橙皮苷得率的影响。实验结果见图2。

图2 样品粉末颗粒度对柚皮苷、橙皮苷得率的影响Fig.2 Effect of samples powder size on the yield of naringin and hesperidin
2.2.1 样品粉末颗粒度对杜仲叶柚皮苷、橙皮苷得率的影响 从上述实验结果可知,随着样品粉碎粒度的提高,总黄酮得率也相应提高,但考虑到颗粒过细,后续过滤工序耗时较长,故选定样品最佳粉碎粒度为100目。
2.2.2 料液比对杜仲叶柚皮苷、橙皮苷得率的影响从实验结果可知,提高料液比有利于总黄酮得率的提高。考虑到后续浓缩工艺及经济性,选定实验最佳料液比为80∶1。

图3 料液比对柚皮苷、橙皮苷得率的影响Fig.3 Effect of solid to liquid ratio on the yield ofnaringin and hesperidin
2.2.3 微波时间对杜仲叶柚皮苷、橙皮苷得率的影响 从实验结果可知,微波时间为5min时,总黄酮得率最高,随着微波时间的继续增加,总黄酮得率反而出现明显下降,这是由于总黄酮在高温下不稳定容易分解。因此选定最佳微波时间为5min。
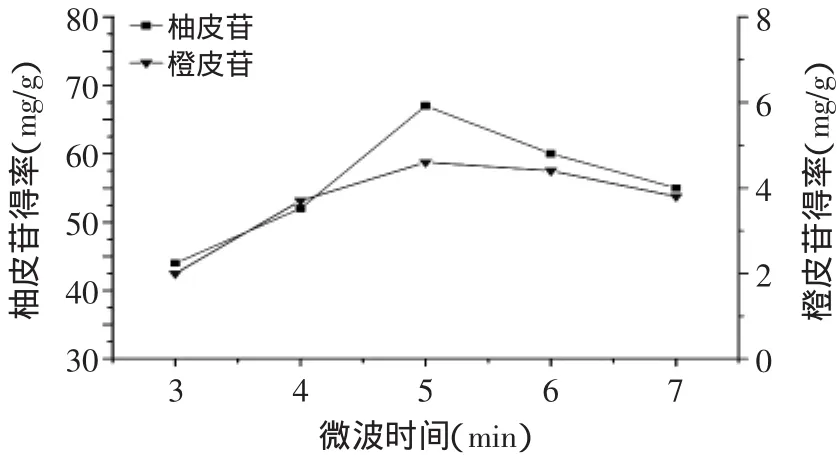
图4 微波时间对柚皮苷、橙皮苷得率的影响Fig.4 Effect of extraction time on the yield of naringin and hesperidin
2.2.4 微波功率对杜仲叶柚皮苷、橙皮苷得率的影响 从实验结果可知,微波功率为800W时,总黄酮得率最高,随着微波功率的继续增加,总黄酮得率反而出现下降,这是由于总黄酮的高温下不稳定,容易分解。因此选定最佳微波功率为800W。

图5 微波功率对柚皮苷、橙皮苷得率的影响Fig.5 Effect of microwave power on the yield of naringin and hesperidin
2.2.5 乙醇浓度对杜仲叶柚皮苷、橙皮苷得率的影响 从实验结果可知,当提取剂乙醇浓度为60%时,总黄酮得率最高。增大或减小提取剂的极性,均不利于总黄酮的提取。因此选定最佳乙醇浓度60%(v/v)。
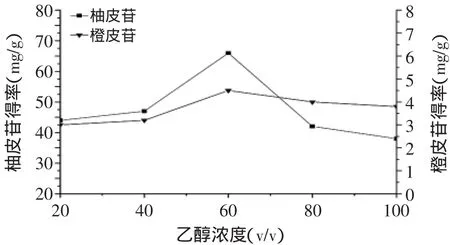
图6 乙醇浓度对柚皮苷、橙皮苷得率的影响Fig.6 Effect of ethanol concentration on the yield of naringin and hesperidin
通过分析上述单因素实验结果,可以初步确定杜仲叶中总黄酮的提取工艺条件为:样品粉末颗粒度为100目,料液比为80∶1,微波时间为5min,微波功率为800W,乙醇浓度为60%(v/v)。在此基础上,采用响应面曲线法对上述提取工艺进行进一步优化。
2.3 响应面曲线法优化杜仲叶黄酮提取工艺
2.3.1 工艺评价指标 杜仲叶总黄酮是一类成分复杂的混合物,柚皮苷和橙皮苷是其中的主要成分,尤其是柚皮苷作用更加显著,因此在本实验中,以柚皮苷和橙皮苷的得率作为评价指标,根据总黄酮中两者的含量,设定柚皮苷的权重系数为0.9366,橙皮苷的权重系数为0.0676。提取工艺优化过程中,分别测定两者的含量,再通过给出的统计权重计算出工艺评价参数,对优化工艺进行评价。工艺评价参数的计算如下式所示:


2.3.2 响应面分析 根据响应面实验表进行实验,实验结果见表2。
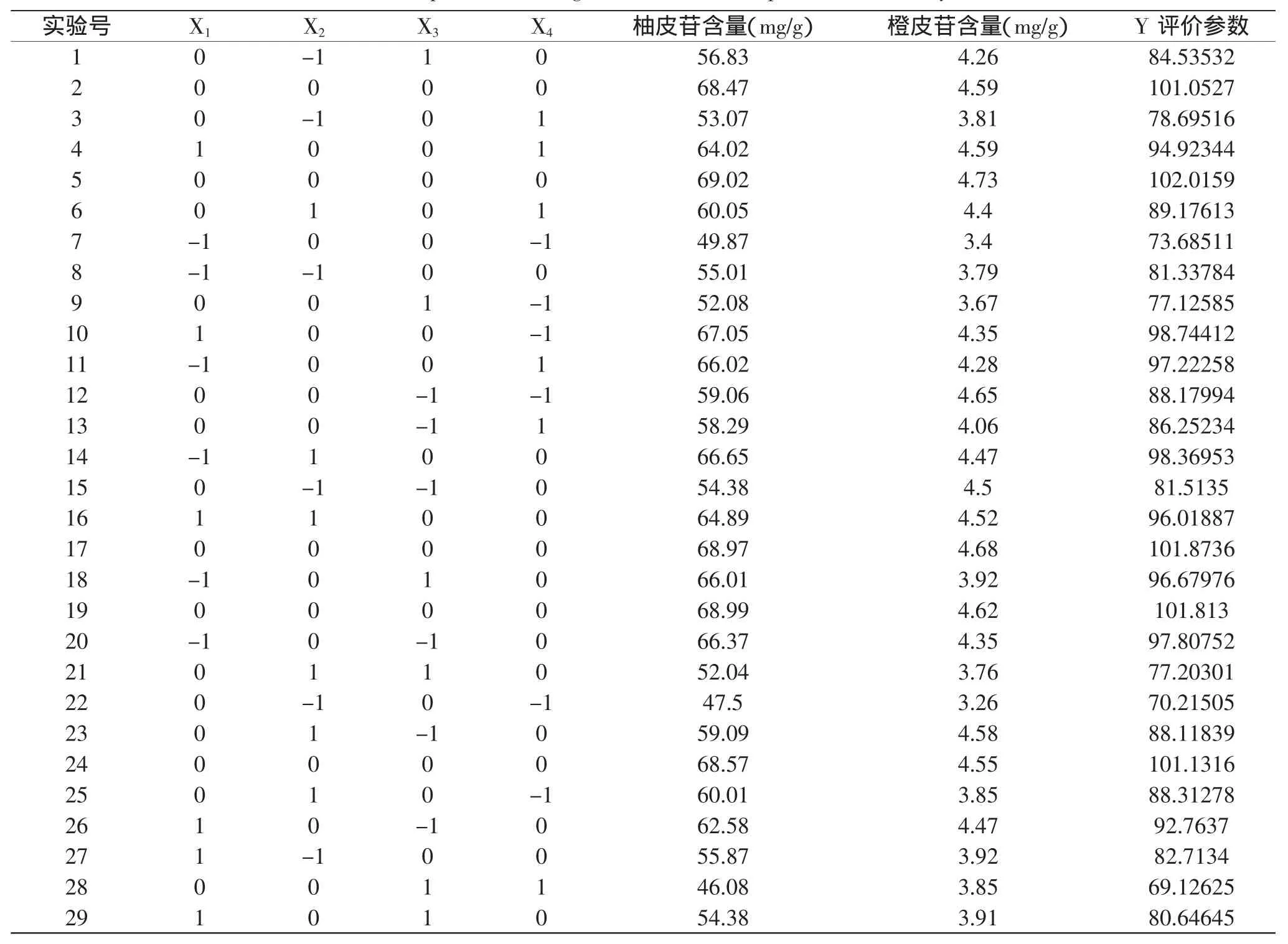
表2 响应面法优化杜仲叶中总黄酮的微波提取工艺的实验设计及结果Table 2 Experimental design and results for response surface analysis
2.3.3 模型的建立及其显著性分析 本实验使用了Design-Expert 8.0软件对表2试验数据进行二次多项式逐步回归拟合,得到回归方程为:Y(评价参数)=101.16+0.059X1+4.85X2-4.11X3+1.59X4-0.93X1X2-2.75X1X3-6.84X1X4-3.84X2X3-1.90X2X4-1.52X3X4-0.65X12-9.86X22-9.40X32-10.43X42。
分析表3中的数据可知,该模型的p值<0.0001,说明此模型是高度显著的,该实验方法是可靠的。表3的数据还说明,项X2、X3、X1X4、X22、X32、X42(p<0.05)对实验结果影响显著,去掉不显著项得到回归方程为:Y(评价参数)=101.16+4.85X2-4.11X3-6.84X1X4-9.86X22-9.40X32-10.43X42。

表3 回归方程各项的方差分析Table 3 Analysis of variance for the fitted regression model
由回归方程各项方差分析可以看出,方程的失拟误差(p<0.0001)显著,表明失拟平方和中除还有试验误差外,还含有其他条件因素及其交互作用的影响,总黄酮得率与各单因素之间不仅存在一次或者二次关系,可能还存在高层次的关系,这有待今后继续深入研究。
回归模型预测的杜仲叶中总黄酮的微波辅助提取最佳工艺条件为:料液比60∶1(mL/g)、提取时间为5.25min、微波功率为756.16W、乙醇浓度为66.55%。在最佳条件下,杜仲叶中总黄酮提取效率评价参数可达103.323。
2.4 杜仲叶中总黄酮最优提取工艺的验证
将杜仲叶粉碎,过100目筛,在料液比为60∶1(mL/g)、提取时间5.3min、微波功率757W、乙醇浓度为67%(v/v)的条件下提取杜仲叶中总黄酮。平行实验3次,进行重复验证。柚皮苷、橙皮苷的提取量平均值分别达到69.02、4.96mg/g,综合指标为102.354,与理论预测值103.323基本吻合,说明采用响应面法优化得到的微波提取条件参数准确可靠,能够指导实际生产。
2.5 杜仲叶黄酮体外抗氧化活性
从上述实验可知,杜仲叶总黄酮中,以柚皮苷的含量最大,为计算方便,在体外抗氧化活性实验中,以柚皮苷浓度代替总黄酮含量。
2.5.1 杜仲叶黄酮对DPPH自由基的清除作用 由图7可知,在选定的浓度范围内,杜仲叶黄酮对DPPH自由基具有良好的清除能力,而且随着杜仲叶黄酮的浓度提高,其对DPPH自由基的清除作用增强,呈现量效关系。根据线性回归方程计算得到杜仲叶黄酮的IC50=157.38μg/mL,而VC的IC50=198.47μg/mL,这说明杜仲叶黄酮具有比VC更强的DPPH自由基清除能力。
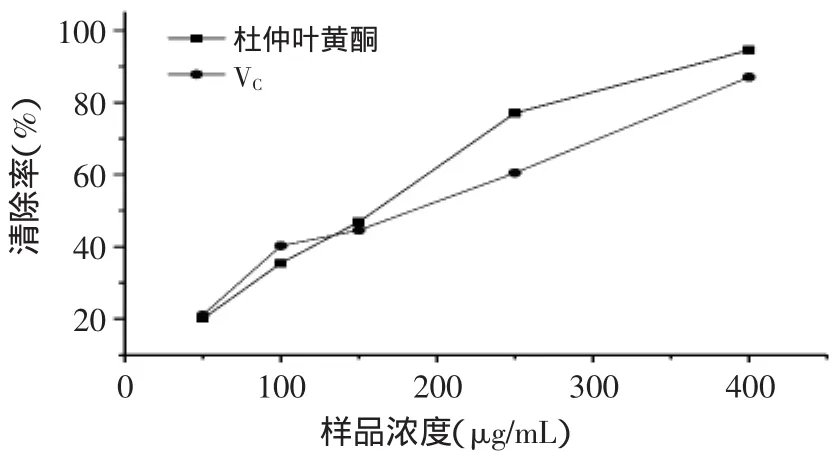
图7 杜仲叶黄酮对DPPH自由基的清除作用Fig.7 Scavenging effect of Eucommia ulmoides leaf flavonoids on DPPH radicals
2.5.2 杜仲叶黄酮对超氧阴离子自由基的清除作用
从图8可知,在选定的浓度范围内,杜仲叶黄酮对超氧阴离子自由基具有一定的清除能力,通过线性回归方程得到的杜仲叶黄酮的IC50=261.67μg/mL,而VC的IC50=108.81μg/mL,这说明杜仲叶黄酮超氧阴离子自由基的清除作用弱于VC。

图8 杜仲叶黄酮对超氧阴离子自由基的清除作用Fig.8 Scavenging effect of Eucommia ulmoides leaf flavonoids on superoxide anion free radicals
2.5.3 杜仲叶黄酮对羟基自由基的清除作用 从图9可知,在选定的浓度范围内,杜仲叶黄酮表现出了明显的清除羟基自由基的能力,且作用效果随着浓度的提高而增强,通过线性回归方程计算得到的杜仲叶黄酮的IC50=178.44μg/mL,而VC的IC50=241.31μg/mL,这说明杜仲叶黄酮具有的羟基自由基清除作用强于VC。
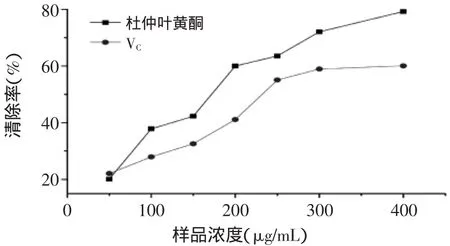
图9 杜仲叶黄酮对羟基自由基的清除作用Fig.9 Scavenging effect of Eucommia ulmoides leaf flavonoids on hydroxyl free radicals
3 结论
3.1 利用响应面法优化微波辅助提取杜仲叶中黄酮工艺,得到的最佳工艺条件为:料液比60∶1(mL/g)、提取时间为5.3min、微波功率为757W、乙醇浓度为67%。在此条件下,柚皮苷、橙皮苷的提取量平均值分别达到69.02mg/g和4.96mg/g,与理论预测值(103.323)基本吻合,这说明,本实验的模型拟合程度高,准确有效,可用于杜仲叶黄酮提取工艺的优化筛选。
3.2 体外抗氧化活性表明,杜仲叶黄酮具有较强的抗氧化能力,与相同浓度的VC比较,杜仲叶黄酮清除DPPH自由基和羟基自由基的能力明显高于VC,且随着浓度的增大,其清除能力增强,显示出了较好的量效关系;但杜仲叶黄酮清除超氧阴离子自由基的能力要弱于VC。实验中所用的杜仲叶黄酮未经进一步纯化,可以预见,经纯化后,其抗氧化IC50值会进一步降低。由此可见,杜仲叶黄酮作为天然抗氧化剂具有广阔的开发前景。
[1]张军民,高振川,张琪,等.杜仲叶及提取物营养价值和药用成分研究[J].氨基酸和生物资源,2002(1):1-2.
[2]李欣,刘严,朱文学,等.杜仲的化学成分及药理作用研究进展[J].食品工业科技,2012(10):378-381.
[3]COOK N C,SAMMAN S.Flavonoids-chemistry,metabolism,cardio protective effects,and dietary sources[J].Nutritional Biochemistry,1996(7):66-67.
[4]封家福,谯时文,张知贵,等.天然抗氧剂研究的进展[J].北方药学,2012,9(5):37-38.
[5]刘莉华,宛晓春,李大祥.黄酮类化合物抗氧化活性构效关系的研究进展[J].安徽农业大学学报,2002,29(3):265-270.
[6]成军,赵玉英,崔育新,等.杜仲叶黄酮类化合物的研究[J].中国中药杂志,2000(5):284-285.
[7]陈春霞,秦建华.杜仲以叶代皮的研究概况[J].上海铁道大学学报:医科版,1995(3):186-187.
[8]高梦祥,吴守程.微波技术提取竹叶多糖的研究[J].陕西农业科学,2006(3):22-24.
[9]DENG Chunhui, LIU Ning, GAO Mingxia, et al.Recent developments in sample preparation techniques for chromatography analysis of traditional Chinese medicines[J].J Chromatogr A,2007(12):90-96.
[10]张明霞,呼秀智,庞建光,等.微波辅助玉米芯酸水解提取木糖条件优化[J].食品科学,2012,33(2):39-42.
[11]D Bas,I H Boyac.Modeling and optimization Ⅰ:usability of response surface methodology[J].Journal of Food Engineering,2007,78(3):836-845.
[12]邹建国,刘飞,刘燕燕,等.响应面法优化微波辅助提取枳壳中总黄酮工艺[J].食品科学,2012,33(2):24-26.
[13]李秀玲,李龙,肖红斌,等.高效液相色谱法测定枳实、枳壳中橙皮苷和柚皮苷的含量[J].色谱,2002,20(6):585-586.
[14]张泽生,乌兰.金银花中绿原酸的体外抑菌和抗氧化性的研究[J].天津科技大学学报,2005,20(2):5-8.
[15]Mark L S,Mark L G.Involvement of the superoxide anion radical in the antioxidation of pyrogallal and convenient assay for superoxide dismutase[J].European Journal of Biochemistry,1974,47:469-474.
[16]Smironef N,Cumbes Q J.Hydroxyl radical scavenging activity ofcompatible solutes[J].Phytochemistry,Polysaccharidesto Hydroxyl Radieals,1989,28:1057-1060.
