肝素-壳聚糖亲和层析纯化猪凝血酶研究
2013-12-06何晓梅韦传宝张业峰
何晓梅,韦传宝,张业峰
(1.皖西学院生物与制药工程学院,安徽六安 237012;2.皖西学院安徽省植物生物技术实验实训中心,安徽六安237012)
凝血酶(thrombin)是一种由凝血酶前体形成的多功能丝氨酸蛋白水解酶,催化血纤维蛋白原变成血纤维蛋白而促使血液凝固。在临床上,凝血酶适用于结扎止血困难的小血管、毛细血管以及实质性脏器出血的止血等。我国的猪血资源丰富,从中提纯凝血酶有很大的经济效益。目前,对凝血酶的分离纯化主要采用离子交换层析、凝胶过滤和亲和层析,与其他生化分离方法相比,亲和层析技术具有高收率、高纯度、能保持生物大分子天然状态等优点。目前亲和层析使用的载体如(琼脂糖)存在价格昂贵,机械强度低,易压床,配基的偶联条件激烈,配基与载体结合力不强易脱落等缺点[1]。壳聚糖是一种天然多糖衍生物,具有良好的生物亲和性、生物可降解性,其分子链上丰富的氨基和羟基使其容易进行化学修饰而赋予多种功能,已在医药、农业、轻纺、日化等领域得到广泛应用[2-7]。但是由于天然状态的壳聚糖大部分为粉末状,作为吸附载体,则使载体和吸附物都难以回收,从而限制其使用[8]。将壳聚糖制备成几何形态、分散性、溶胀性、机械强度均良好的高分子球珠,使壳聚糖和高分子球珠的功能相复合,可使其在生物工程、医药化工等领域得到更大的应用[9-12]。本文采取以壳聚糖为原料,液体石蜡为有机分散介质,乙酸乙醋为致孔剂,甲醛、戊二醛为交联剂,运用反相悬浮交联法,通过单因素实验,优化制珠条件并获得最优方案,利用化学方法成功的将分子量范围在6ku左右的肝素,连接到在强碱条件下经环氧氯丙烷、二甲亚砜活化后并在EDC存在的环境条件下的壳聚糖球珠上,制成了亲和吸附剂,取得了十分良好的效果,且大大缩短了纯化时间和减少了洗脱液的用量。使用天然廉价的壳聚糖作为载体,大大降低了操作成本,对于今后大规模制备高纯度的凝血酶有较好的参考价值。
1 材料与方法
1.1 材料与仪器
新鲜猪血 取自西商食品有限公司屠宰场,加入3.8%的柠檬酸钠作为抗凝剂,-20℃冷藏;壳聚糖,液体石蜡,DMSO(二甲基亚砜),ECH(环氧氯丙烷),EDC(1-乙基-3-二甲氨丙基-碳二亚胺),肝素,甲醛,戊二醛,司盘80,PEG8000等。
76-1型玻璃恒温水浴,JJ100型电子天平,2XZ-2X型旋片真空泵,索氏提取器,HH-4型数码显示水浴锅,CHA-S恒温振荡器,通风柜系统,YC-1型冷冻层析柜,高速台式离心机,磁力搅拌器,SHZ-Ⅲ型循环水真空泵,722型分光光度计。
1.2 实验方法
1.2.1 壳聚糖球珠的制备 称取5.0g壳聚糖溶于100mL 3%冰醋酸溶液中,用玻璃棒搅拌至无明显粉末状时停止,静置过夜使其充分溶解。向装有搅拌器和温度计的250mL三口烧瓶中依次加入66.7mL液体石蜡,15mL乙酸乙酯,8滴Span80,搅拌30min,加入溶解好的壳聚糖溶液,启动水浴锅加热至三口瓶内温度达50℃,搅拌60min,用注射器缓慢加入适量甲醛溶液,升温至55℃,反应30min,再使用注射器缓慢加入适量戊二醛溶液,升温至60℃,用1mol/L NaOH溶液调pH至9.0,反应2.0h,迅速用真空泵抽滤,蒸馏水反复洗涤,将球珠放入索氏提取装置中分别先后用石油醚、无水乙醇抽提至少12h,最后放入真空干燥箱中60℃干燥至恒重,用研钵轻研至均匀球珠。
1.2.2 肝素-壳聚糖亲和吸附剂的制备
1.2.2.1 壳聚糖球珠的活化 取5g干壳聚糖球珠,双蒸水充分溶胀24h,真空抽干,然后依次加入12mL DMSO、6mL ECH和12mL 2mol/L NaOH溶液,壳聚糖球珠的悬浮液于恒温空气浴摇床上170r/min、40℃振荡反应2h。反应结束后,用去离子水洗去未反应的试剂。
1.2.2.2 壳聚糖球珠的偶联 向活化的球珠中加入肝素(168g/L),用0.1mol/L HCl调pH至4.75[13],缓慢加入3%EDC,4℃下缓慢搅拌过夜,结束后用0.1mol/L NaOH溶液和去离子水交替洗涤至中性,即得壳聚糖亲和吸附剂[14]。
1.2.3 猪凝血酶粗品的制备 -20℃冷藏8%柠檬酸钠抗凝的新鲜猪血浆,4℃恒温溶解,用蒸馏水将其稀释10倍后,用0.2mol/L冰醋酸调节pH为5.3,于4℃下放置过夜,通过虹吸去除上清液,3400r/min离心15min收集凝血酶原沉淀,沉淀物溶于含0.075%草酸钾的0.9%NaCl溶液,于磁力搅拌器上搅拌溶解1h,3400r/min离心15min,收集上清液,向上清液中加入终浓度为0.1mol/L CaCl2溶液,25℃下激活2h,即得猪凝血酶粗酶液[15]。
1.2.4 猪凝血酶的亲和层析 肝素-壳聚糖亲和吸附剂经蒸馏水充分溶胀装柱(1m×15cm),用0.05mol/L,pH7.5 Tris-HCl缓冲液平衡柱床,将凝血酶粗酶液上样,控制流速为12mL/h,然后用同样的缓冲液进行洗涤至无蛋白质流出为止,依次换用含0.5mol/L和3.0mol/L NaCl的缓冲液洗脱,分别收集相对应的洗脱液,做好标记。
1.2.5 凝血酶活性检测
1.2.5.1 凝血酶活性的定性检测 用0.05mol/L,pH7.5 Tris-HCl溶液稀释粗凝血酶液至1∶1、1∶2、1∶3、1∶4、1∶5,然后分别加入等量的新鲜猪血浆,并迅速放入37℃恒温箱中,1~1.5h后观察凝固情况。
1.2.5.2 凝血酶活性的定量测定 活性测定采用中国药典介绍的方法[16],凝血酶标准品用0.9%NaCl溶液分别制成每毫升中含5.0单位、6.4单位、8.0单位、10.0单位的标准品溶液。取内径1cm、长10cm的试管4支,各精密加入含0.1%可凝物的纤维蛋白原溶液0.9mL,置于(37±0.2)℃水浴中保温5min,再分别精密量取上述4种浓度的标准品溶液各0.1mL,迅速加入上述各试管中,摇匀、立即计时,在(37±0.2)℃水浴中,观察并记录纤维蛋白原的初凝时间,每种浓度测5次,求平均值。标准品溶液的浓度应控制凝结时间在14~60s之间为宜。在双对数坐标纸上,以每管中标准品实际单位数(U)为横坐标,凝结时间(s)为纵坐标,绘制标准曲线,求得回归方程。样品测定方法同上,通过回归方程求得样品中凝血酶的活力。
1.2.5.3 蛋白质浓度测定 采用Lowry法[17]。
2 结果与分析
2.1 壳聚糖球珠制备的条件优化
2.1.1 壳聚糖溶液浓度与球珠的关系 保持壳聚糖溶液与液体石蜡的体积比1.5∶1不变,甲醛10mL、戊二醛2mL、乙酸乙酯15mL、Span80 8滴,其他条件不变,改变壳聚糖溶液的浓度分别为1.5%、2.5%、3.5%、5.0%、6.5%进行实验,结果如表1所示。

表1 壳聚糖溶液浓度与球珠的关系Table 1 Relationship between chitosan concentration and bead features
由表1可以看出,随着壳聚糖溶液浓度的增大,球珠的颜色加深、粒度增大,成球性与均匀性逐步提高,但是壳聚糖溶液浓度过大则出现块状物(如图1a所示)。由于浓度增大,水相粘度提高,互相聚集不宜分散导致球珠粒度增大。同时由于球珠的表面积越小,单位表面积交联的甲醛、戊二醛就越多,导致球珠颜色越深。经观察若想获得粒度均匀、单分散性好的球珠(如图1b所示),最佳壳聚糖浓度控制在5.0%左右。

图1 不同壳聚糖浓度制备的壳聚糖球珠结构(生物显微镜放大100倍)Fig.1 Structure of chitosan beads prepared with different chitosan concentration(100×)

图2 不同搅拌速度制备的壳聚糖球珠结构(生物显微镜放大100倍)Fig.2 Structure of chitosan beads prepared with different stirring speeds(100×)
2.1.2 搅拌速度与球珠的关系 保持壳聚糖溶液与液体石蜡的体积比1.5∶1不变,甲醛10mL、戊二醛2mL、乙酸乙酯15mL、Span80 8滴,壳聚糖溶液浓度为5.0%,其他条件不变,改变搅拌速度进行实验,结果如表2所示。
由表2可以看出,随着搅拌速度的增加,球珠的粒度逐步减小,但过高的搅拌速度造成粒度过小(如图2a所示)。经观察欲获得粒度均匀、单分散性好的球珠(如图2b所示),搅拌速度控制在2500r/min左右。

表2 搅拌速度与球珠的关系Table 2 Relationship between stirring speeds and bead features
2.1.3 交联剂与壳聚糖球珠的关系 保持壳聚糖溶液与液体石蜡的体积比1.5∶1不变,乙酸乙酯15mL、Span80 8滴、壳聚糖溶液浓度5%、转速2500r/min,其他条件不变,改变交联剂甲醛和戊二醛用量进行实验,结果如表3所示。
由表3可以看出固化交联剂甲醛和戊二醛的用量对球珠的粒度和色泽都有一定影响。戊二醛用量增大,产物颜色加深,而戊二醛用量增大也使产物相互粘着严重,甚至出现“块状”现象(如图3a所示)。甲醛用量的变化对产物特性影响较小。经观察欲获得粒度均匀、单分散性好的球珠(如图3b所示),最佳甲醛与戊二醛用量比例为5∶1。

表3 交联剂用量与壳聚糖球珠的关系Table 3 Relationship between cross-linker doses and bead features

图3 不同交联剂用量制备的壳聚糖球珠结构(生物显微镜放大100倍)Fig.3 Structure of chitosan beads prepared with different cross-linker doses(100×)
2.1.4 溶胀时间与壳聚糖球珠多孔性的关系 称取一定量制备好的球珠放入ddH2O中,进行溶胀,分别在5、15、24、36h时取出放在生物显微镜下观察球珠的多孔性,结果如表4所示。
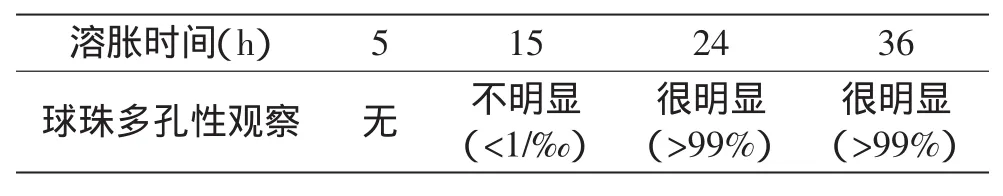
表4 溶胀时间与球珠多孔性的关系Table 4 Relationship between swelling time and bead porosity
由表4可以看出,随着溶胀时间的延长,球珠的多孔性逐步显现出来,用ddH2O溶胀15h只能看到极少的球珠呈现多孔性(见图4a)。随着溶胀时间的延长,球珠的多孔性越来越明显。经观察欲使球珠完全溶胀即多孔性完全呈现(>99%),则至少控制溶胀时间在24h(见图4b)。

图4 不同溶胀时间与壳聚糖球珠多孔性的关系(生物显微镜放大400倍)Fig.4 Relationship between swelling time and bead porosity(400×)
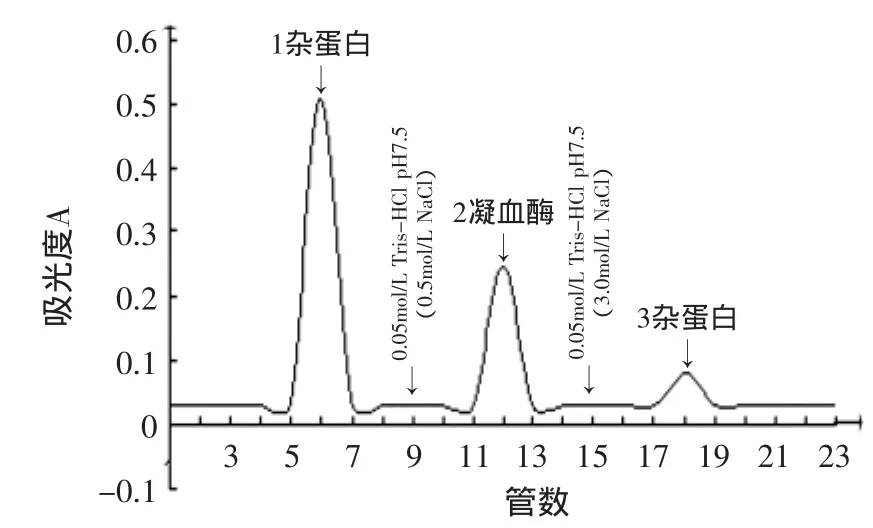
图5 肝素-壳聚糖球珠亲和吸附猪凝血酶洗脱曲线Fig.5 Elution curve of porcine thrombin by affinity chromatography of heparin-chitosan beads
2.2 猪粗凝血酶的亲和层析纯化
2.2.1 壳聚糖亲和吸附剂性能检测 在4℃条件下,取适量的亲和层析树脂和激活好的粗凝血酶,放入500mL烧杯中,在磁力搅拌器上缓慢搅拌,使二者充分吸附,3h后停止搅拌,静置一段时间,取上层溶液适量,与血浆混匀,对照组取等量粗凝血酶与血浆混匀,二者迅速放入37℃恒温水浴中,1~1.5h后观察。实验组血浆不凝固,对照组血浆凝固,初步表明壳聚糖亲和吸附剂对猪凝血酶具有特异性吸附作用。
2.2.2 粗凝血酶的亲和层析纯化 将凝血酶粗品上样到事先用pH7.5 0.05mol/l Tris-HCl缓冲液平衡好的柱(1m×15cm)上,控制流速为12mL/h,至无蛋白流出为止,然后分别换用含0.5mol/L和3.0mol/L NaCl的pH7.5 0.05mol/L Tris-HCl洗脱,洗脱曲线如图5所示。分别按起始方向依次取第1、2、3峰收集液一定量,加入新鲜猪血混匀,37℃保温1h,观察是否凝集。结果表明,第1、3峰收集液不能使猪血浆凝固,确定为杂蛋白,第2个洗脱峰收集液能使猪血浆凝固,确定为凝血酶。将凝血酶收集液用PEG8000浓缩,真空冷冻干燥,即得凝血酶制品。从表5可知,粗凝血酶经肝素-壳聚糖球珠亲和层析纯化得到凝血酶制品具有较高的比活,达到1801.9U/mg,回收率可达81%,纯化倍数为11.37。
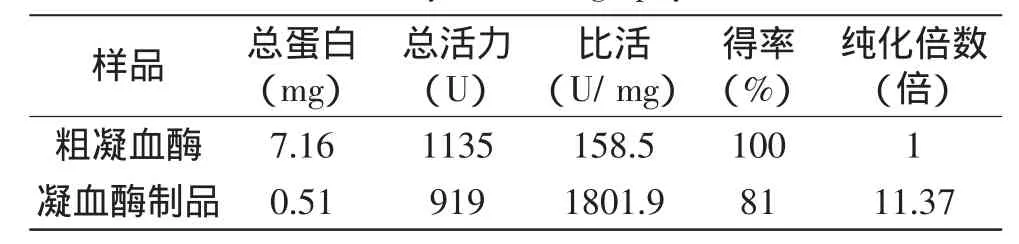
表5 猪凝血酶的亲和层析Table 5 Purification of thrombin by heparin-Chitosan beads affinity chromatography
2.3 肝素-壳聚糖亲和吸附剂的重复使用性能
收集吸附过凝血酶的壳聚糖球珠,用1.0mol/L NaOH为洗脱剂,洗到上清液中检测不到蛋白质为止,再以3~6倍柱床体积的0.5mol·L-1NaCl/0.1mol·L-1Tris-HCl(pH8.5)和0.5mol·L-1NaCl/0.1mol·L-1NaAc(pH4.5)依次反复冲洗3~4次,进行再生后,用0.05mol/L pH7.5 Tris-HCl缓冲液充分平衡,然后在相同实验条件下进行凝血酶吸附实验。实验表明,壳聚糖球珠对凝血酶的吸附量几乎可以完全恢复,表明此壳聚糖球珠的重复使用性能良好。
3 结论
3.1 通过采用液体石蜡作为有机分散介质,乙酸乙酯作为制孔剂,Span80为乳化剂,甲醛、戊二醛为交联剂,利用反相悬液交联法制备壳聚糖球珠。单因素实验结果表明,制备比较理想的微米级壳聚糖球珠的最佳条件是:5%壳聚糖溶液112.5mL、液体石蜡75mL、乙酸乙酯15mL、甲醛10mL、戊二醛2mL、Span80 8滴、转速2500r/min。在此实验条件下制得的壳聚糖球珠呈淡黄色、大小均匀、分散性好。用ddH2O溶胀24h,具有明显的多孔性。
3.2 将制得的壳聚糖球珠经环氧氯丙烷活化,在EDC存在条件下偶联上小分子量的肝素制备的亲和吸附剂,能够吸附猪凝血酶,并且易于洗脱,保持了凝血酶活性。该吸附剂具有易于活化,无毒,无明显压床,价格低廉的优点。
3.3 本实验定性研究了肝素-壳聚糖亲和吸附剂纯化猪凝血酶,为今后大规模工业化生产高纯度猪凝血酶提供理论依据。
[1]肖丽霞,姜涌明.两种不同的亲和吸附剂对猪凝血酶纯化效果的比较[J].扬州大学学报,2001(8):55-57.
[2]将挺大.壳聚糖[M].北京:化学工业出版社,2003(3):256-258.
[3]李学斌,祝华.壳聚糖微球的制备方法研究[J].药学进展,2005,29(4):166-169.
[4]丁明,施建军,皇甫立霞,等.壳聚糖球珠的制备研究[J].化学世界,1998(12):636-640.
[5]丁世敏,封享华.交联壳聚糖多孔微球对染料的吸附平衡及吸附动力学分析[J].分析科学学报,2005,21(2):127-130.
[6]李志洲,刘军强,刘军海.多孔壳聚糖球珠的制备及其在污水处理中的应用[J].化工科技,2008,16(1):27-31.
[7]王芳,韩德艳,张海丽.壳聚糖磁性微球的制备及其对牛血清白蛋白的吸附性能研究[J].化学与生物工程,2007,24(8):41-44.
[8]李志洲,刘军强.多孔壳聚糖球珠的制备研究[J].淮阴师范学院学报,2007(8):246-249.
[9]葛亚芳,李明春,辛梅华,等.壳聚糖固载环糊精球珠的制备及吸附硝基酚[J].化工进展,2010(2):233-237.
[10]丁明,孙虹,康玲,等.壳聚糖微球的制备研究[J].合肥联合大学学报,1999(2):7-11.
[11]Zhao K S,Asami K,Lei J P.Dielectric analysis of chitosan microsphere suspensions:study on its ion adsorption[J].Colloid Polymer Sci,2002,280:1038-1044.
[12]Xu J H,Li S W,Tostado C,et al.Preparation of Monodispersed Chitosan Microspheres and in situ Encapsulation of BSA in a Co-axial Microfluidic Device[J].Biomed Microdevices,2008,11(1):243-249.
[13]Matsumoto I,Mizuno Y,Seno N.Activation of sepharose with epichlorohydrin and subsequent immobilization of ligand for affinity adsorbent[J].J Biochem,1979,85(4):1091-1098.
[14]李梅基,李昭华,胡建成,等.用壳聚糖亲和磁性球珠纯化血浆凝血酶的研究[J].生物化学与生物物理进展,2010,37(4):433-440.
[15]南雪梅,董文宾.猪血凝血酶制备工艺[J].食品科技,2010,35(8):167-170.
[16]中华人民共和国卫生部药典委员会.中华人民共和国药典[J].第二部.北京:化学工业出版社,1995:1128-1129.
[17]Lowry O H.Protein measurement with the folin phenol reagent[J].J Biol Chem,1951,193:265-275.
