槐角黄酮的体外抗氧化活性研究
2013-12-06陈明珠申艳艳何杰宇
陈明珠,申艳艳,赵 越,秦 伟,何杰宇,许 茜
(东南大学公共卫生学院,江苏南京 210009)
中药槐角系豆科植物槐(Sophora jonica L.)的干燥成熟果实,荚果,圆柱形,有时弯曲,形状似角,故谓之“角”[1]。槐角具有清热泻火、凉血止血的功效,为《中华人民共和国药典》历版收载品种。槐角中含有多种多样的化学成分,如黄酮类化合物、生物碱、三萜皂苷类化合物、磷脂类化合物及多种氨基酸等,其中以黄酮类化合物含量尤其突出,是槐角的主要活性成分[2]。自由基能够攻击细胞组织中的脂质、蛋白质、糖类和DNA等物质,造成脂质和糖类的氧化、蛋白质的变性、酶的失活、DNA的变性等多种改变,从而导致细胞膜、遗传因子等的损伤,进而引发多种疾病、癌变和老化等[3-5]。传统合成抗氧化剂BHT、BHA、PG虽具有很好的抗氧化性,但其安全性受到质疑。因此开发利用天然抗氧化剂的要求日益迫切。我国传统中药材富含天然抗氧化剂,不同药材中所含的抗氧化活性成分不同,抗氧化的作用情况也不尽相同。其中黄酮类化合物已被证实具有较强的清除氧自由基的能力,是一类极具开发前景的天然有效抗氧化剂[6-8]。槐角中黄酮类化合物多与糖结合以苷类形式存在。目前从槐角中分离得到的黄酮化合物包括七种苷元:山柰酚、槲皮素、异鼠李素、杨梅素、芹菜素、木犀草素和三粒小麦黄酮。其中前两种含量最多,是槐角的主要药理成分[9]。然而,遗憾的是,槐角中黄酮化合物的抗氧化功效研究尚未见报道。本文以VC作为阳性对照,研究槐角黄酮对DPPH·、O2-·和·OH等三种自由基的清除能力,并研究其抗氧化作用,以期为槐角的保健功能和开发利用提供参考。
1 材料与方法
1.1 材料与设备
槐角 徐州天力生化制品有限公司提供,粉碎后备用;抗坏血酸、三羟甲基氨基甲烷、1,1-二苯基-2-三硝基苯肼、邻菲罗啉、邻苯三酚、双氧水、硫酸亚铁、甲醇、乙醇、乙腈、磷酸、盐酸 均为分析纯;水 重蒸水。
AL204电子天平 瑞士梅特勒;UV-2550紫外分光光度计 日本岛津;高速万能粉碎机 天津华鑫;HH-4数显恒温水浴锅 金坛荣华;SB-50D超声波清洗机 宁波新芝;PHS-25数显PH计 合肥远中。
1.2 实验方法
1.2.1 槐角黄酮的制备 选用传统的回流提取法对槐角中黄酮类化合物进行提取。根据前期响应面分析法确定槐角黄酮的提取条件为:乙醇浓度74%,液料比18mL/g,提取时间为2h,提取温度为90℃。
将槐角粉碎,准确称取5.0g槐角粉末于150mL具塞锥形瓶中,加入90mL 74%乙醇,90℃加热回流提取2h后,得槐角黄酮提取液。测得提取液中槐角黄酮的提取率为10.461%,根据提取液体积换算成槐角黄酮的质量浓度,以水稀释制得黄酮含量约为1mg/mL的溶液供试。
1.2.2 清除DPPH自由基能力的测定[10]分别吸取一定体积VC(1mg/mL)、槐角黄酮至10mL容量瓶中,用无水乙醇稀释至刻度,在10mL比色管中加入DPPH溶液(0.2mmol/L)2mL,各浓度样液2mL,摇匀,室温避光静置30min,在517nm处测量吸光度Ai;用2mL无水乙醇代替样液,在517nm处测得吸光度A0;用2mL无水乙醇代替DPPH·溶液,在517nm处测得吸光度Aj。每一吸光度平行测定3次,取平均值。测出A0、Ai、Aj所表示样品的吸光度值,清除率按公式(1)计算。
清除率S(%)=(A0-Ai+Aj)/A0×100 式(1)
1.2.3 超清除氧阴离子能力的测定[11]邻苯三酚自氧化速率的测定:取4.5mL pH=8.2的50mmol/L Tris-HCl缓冲液,4.2mL蒸馏水,混匀后在25℃恒温水浴中温育20min,取出迅速冷却后立即加入在25℃预热过的3mmol/L邻苯三酚溶液0.3mL,空白管用10mmol/L HCl。每隔0.5min在325nm处测定溶液的吸光度,计算线性范围内每分钟吸光度的增加值△A0。
加入样品后邻苯三酚自氧化速率测定:加入邻苯三酚前,先分别加入不同浓度的样品(槐角黄酮和VC)溶液lmL,蒸馏水3.2mL,然后按上文的方法操作,计算线性范围内每分钟吸光度的增加值△A。清除率的计算如公式(2)所示。
清除率(%)=[(△A0-△A)/△A0]×100 式(2)
式中,△A0——邻苯三酚自氧化速率;△A——加入样品后邻苯三酚的自氧化速率。
1.2.4 清除羟基自由基(·OH)能力的测定[12]取0.75mmol·L-1邻二氮菲溶液1mL,PBS溶液2mL和蒸馏水1mL,充分混匀后,加0.75mmol/L硫酸亚铁1mL混匀,加0.01%的过氧化氢1mL,于37℃水浴温育60min后在536nm处测其吸光度,所得数据为损伤管的吸光值A(损);1mL蒸馏水代替1mL过氧化氢,于536nm处测得吸光度为A(未);用试样(槐角黄酮提取液和VC)1mL代替lmL蒸馏水,于536nm处测得吸光度为A(样),计算方法如公式(3)所示。
·OH清除率(%)=[A(样)-A(损)]/[A(未)-A(损)]×100式(3)
2 结果与讨论
2.1 清除DPPH自由基能力
槐角黄酮和VC对DPPH自由基的清除作用分别如图1、图2所示。结果表明,槐角黄酮与VC在一定的浓度范围内对DPPH呈现出良好的量效关系,在抗氧化剂浓度较低时,清除率迅速上升,抗氧化剂浓度与清除率之间接近线性关系;当清除率接近极大值时,继续提高抗氧化剂浓度,其清除率上升十分缓慢。槐角黄酮、VC浓度与清除率之间线性方程分别为:槐角黄酮:Y=2268X+6.089(R2=0.989),线性范围:0.001~0.040mg/mL;VC:Y=9934X+0.379(R2=0.997),线性范围:0.001~0.080mg/mL。
样品清除自由基能力以半数抑制浓度(IC50)来比较,其定义为:使自由基数目减少50%时所需要样品的浓度。经计算,槐角黄酮、VC的IC50分别为0.0192、0.005mg/mL,即,槐角黄酮对DPPH自由基的清除能力弱于VC。

图1 槐角黄酮对DPPH自由基的清除作用Fig.1 The scavenging effect of the flavonoids fromfructus sophorae on DPPH·
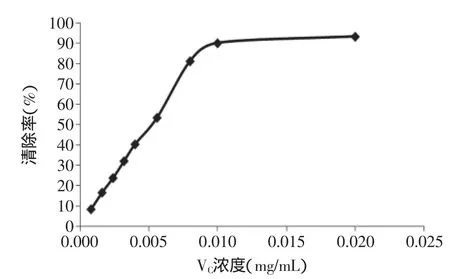
图2 VC对DPPH自由基的清除作用Fig.2 The scavenging effect of VCon DPPH·
2.2 清除超氧阴离子自由基能力
以邻苯三酚反应体系的吸光度A值对反应时间t所作的线性关系图,由此得到邻苯三酚自氧化速率△A0=0.063(即线性图中的斜率)。同样方法得到加入不同浓度抗氧化剂的氧化速率,从而计算出各自的清除率。槐角黄酮、VC对超氧阴离子自由基的清除作用分别如图3、图4所示。由图3、图4中可见,槐角黄酮、VC对邻苯三酚自氧化体系产生的超氧阴离子自由基均有较强的清除能力。随着样品浓度的升高,清除率迅速上升,在一定浓度范围内抗氧化剂浓度与清除率之间接近线性关系。清除作用的线性方程分别表示如下:槐角黄酮:Y=2392X+19.64(R2=0.987),线性范围:0.003~0.030mg/mL;VC:Y=1877X+1.285(R2=0.990),线性范围:0.005~0.050mg/mL。计算得槐角黄酮和VC的IC50分别为0.0127、0.0260mg/mL,因此与VC相比,槐角黄酮清除超氧阴离子自由基的能力更强。

图3 槐角黄酮对超氧阴离子自由基的清除作用Fig.3 The scavenging effect of the flavonoids from fructus sophorae on O2-·
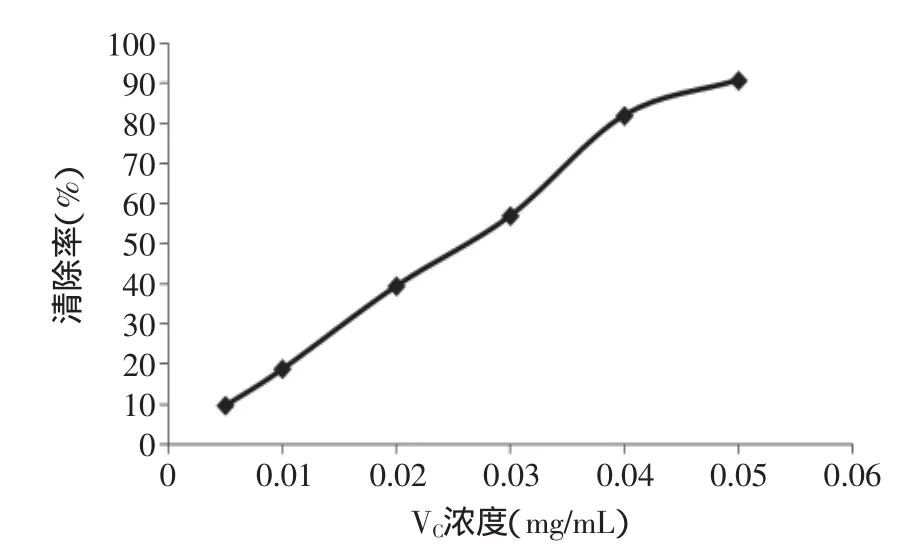
图4 VC对超氧阴离子自由基的清除作用Fig.4 The scavenging effect of VCon O2-·
2.3 清除羟基自由基能力
槐角黄酮、VC对·OH的清除作用如图5、图6所示。由图可知,同样,随着样品浓度的升高,清除率迅速上升,抗氧化剂浓度与清除率之间接近线性关系。对·OH清除作用的线性方程分别表示如下,槐角黄酮:Y=3158X-0.763(R2=0.998),线性范围:0.0025~0.0275mg/mL;VC:Y=1451X+1.956(R2=0.996),线性范围:0.005~0.060mg/mL。槐角黄酮和VC的半数抑制浓度(IC50)分别为0.0160、0.0332mg/mL,可见槐角黄酮对羟基自由基的清除能力比VC更强。

图5 槐角黄酮对羟基自由基的清除作用Fig.5 The scavenging effect of the flavonoids from fructus sophorae on·OH
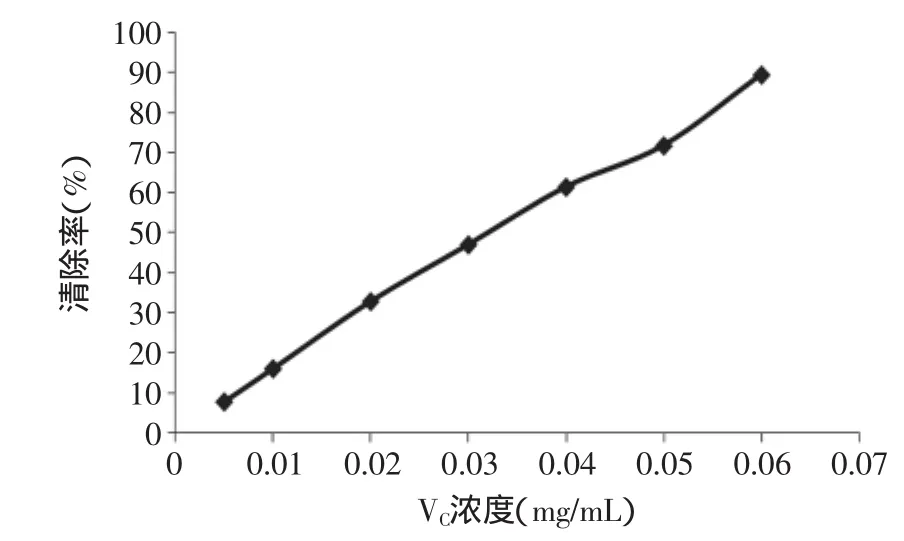
图6 VC对羟基自由基的清除作用Fig.6 The scavenging effect of VCon·OH
3 结论
考察槐角提取液中的黄酮对DPPH自由基、超氧阴离子自由基、羟基自由基等的清除能力,是研究其抗氧化性能的一种简便有效的方法。研究结果均表明,在一定槐角黄酮剂量范围内,清除自由基能力与剂量存在量效关系。随着添加黄酮量的增加,对自由基的清除能力也在逐渐增强。VC作为经常使用的抗氧化剂,已经被广泛使用。槐角提取物中的黄酮类化合物对超氧阴离子自由基、羟基自由基的清除能力均比VC强,提示槐角黄酮是一种极具潜力的天然抗氧化剂。
[1]张鞍灵,高锦明,王姝清.黄酮类化合物的分布和利用[J].西北林学院学报,2000,15(1):69-74.
[2]Davis BD,Brodbelt JS.Determination of the glycosylation site of flavonoid monoglucosides by metal complexation and tandem mass spectrometry[J].Journal of the American Society for Mass,2004,15(9):1287-1299.
[3]马磊,楼凤昌.槐角中的抗癌活性成分[J].中国天然药物,2006,4(2):151-153.
[4]Bobe G,Sansbury LB,Albert PS,et al.Dietary flavonoids and colorectal adenoma recurrence in the polyp preventiontrial[J].Cancer Epidemiol Biomarkers Prev,2008,17(6):1344-1353.
[5]Labbe D,Provencal M,Lamy S,et al.The flavonols quercetin,kaempferol,and myricetin inhibit hepatocyte growth factorinduced medulloblastoma cellmigration[J].Journal of Nutrition,2009,139(4):646-652.
[6]Valenzuela A, Sanhueza J, Nieto S.Natural antioxidants in functional foods:from food safety to health benefits[J].Grasas Yaceutes,2003,54(3):295-303.
[7]Beutner S,Bloedorn B,Frixel S.Quantitative assessment of antioxidant properties of natural colorants and phytochemicals:carotenoids,flavonoids,phenols and indigoids—The role of sscarotene in antioxidant functions[J].Journal of the Science of Food and Agriculture,2001,81(6):559-568.
[8]Simona DM,Carmen F,Franco Z,et al.Antioxidant activity of phenolic and phenylethanoid glycosides from Teucrium polium L[J].Food Chemistry,2012,133(1):21-28.
[9]Geoffrey C Kite,Nigel C Veitch.Flavonol tetraglycosides from fruits of Styphnolobium japonicum(Leguminosae) and the authentication ofFructusSophome and FlosSophorae[J].Phytochemistry,2009(7):7857-7894.
[10]王丽.几种黄酮类化合物清除DPPH自由基微量模型的建立[D].郑州:河南大学,2009.
[11]郭雪峰,岳永德,汤峰,等.用清除超氧阴离子自由基法评价竹叶提取物抗氧化能力[J].光谱学与光谱分析,2008(8):1823-1826.
[12]高丽威.紫心甘薯黄酮类化合物的提取纯化及抗氧化活性研究[D].杭州:浙江大学,2010.
