原发性ITP患儿外周血血小板相关抗体和淋巴细胞亚群的变化及临床意义
2013-12-05常涛涛郝国平
常涛涛 郝国平
原发性免疫性血小板减少症,过去也称为特发性血小板减少性紫癜是一种获得性自身免疫性疾病,以没有明显原因的单纯性血小板减少(血小板计数<100×109/L)为特征[1]。目前研究普遍认为,原发性ITP发病机制不仅与抗血小板抗体所介导的血小板破坏有关,同时血小板生成减少、T细胞的介导影响也发挥了重要作用[2],但确切机制仍未完全明确。本文就血小板相关抗体、淋巴细胞亚群与原发性ITP发生的关系及其临床意义进行探讨。
1 资料与方法
1.1 一般资料 89例原发性ITP患儿均为2011年9月-2012年8月本院收治的住院患儿,诊断符合文献诊断标准[3]。其中男54例,女35例,年龄2个月~14岁,平均(4.69±2.79)岁,均为初次发病。新诊断组(诊断后3个月以内血小板减少)66例,持续性组(诊断后3~12个月血小板持续减少)23例。选择25例体检健康儿童作对照组,男15例,女10例,年龄9个月~12岁,平均(5.07±2.12)岁。两组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。
1.2 主要试剂与仪器 单克隆抗体CD41-PE、FITC标记的羊F(ab’)2抗 IgG(阴性对照)、羊 F(ab’)2抗人 IgG(γ)FITC、羊F(ab’)2抗人IgM(μ)FITC、羊F(ab’)2抗人IgA(α)FITC单克隆抗体均为Coulter公司产品。CD4-FITC/CD8-PE/CD3-PC5、CD3-FITC/CD(16+56)-PE、CD19-PC5及溶血素均为Coulter公司产品。FC500型流式细胞仪为美国Coulter公司。
1.3 方法
1.3.1 流式细胞术检测血小板相关抗体 将EDTA抗凝全血经低速离心富集、洗涤血小板后,以CD41-PE进行荧光标记处理,然后分别以FITC标记的羊F(ab’)2抗IgG(阴性对照)、羊F(ab’)2抗人IgG(γ)FITC、羊F(ab’)2抗人IgM(μ)FIT、羊F(ab’)2抗人IgA(α)FITC标记血小板,洗涤后上机测定。
1.3.2 流式细胞术检测淋巴细胞亚群 采集空腹静脉血2ml(EDTA抗凝)取2支流式细胞仪专用试管分别标记1、2,管1加5μl CD4-FITC/CD8-PE/CD3-PC5,管2分别加5μl CD3-FITC/CD(16+56)-PE、CD19-PC5,在每支试管中再加入20 μl抗凝全血,充分混匀,室温避光孵育30 min后,加入溶血素100 μl使红细胞溶解,1200 r/min离心5 min,弃上清液,PBS洗涤1次,最后以500 μl PBS缓冲液悬浮,上机测定。
1.4 统计学处理 使用SPSS 17.0统计软件进行分析,计量资料以(±s)表示,首先对检测数据采用非参数Kruskal-Wallis检验,组间比较采用秩变换分析,P<0.05为差异有统计学意义。
2 结果
2.1 原发性ITP患者外周血PAIg检测结果 新诊断组与持续性组PAIg(G、M)水平显著高于对照组,比较差异有统计学意义(P<0.001);新诊断组与持续性组间血小板抗体水平比较,差异无统计学意义(P>0.05)。见表1。
2.2 原发性ITP患者外周血淋巴细胞亚群检测结果 新诊断性ITP组与持续性ITP组和对照组比较,CD3+T细胞、CD4+/CD8+T细胞比值、CD3-CD(16+56)+NK细胞降低,CD3+CD8+T细胞、CD19+B细胞升高,比较差异均有统计学意义(P<0.05);新诊断性ITP组与持续性ITP组比较,组间CD3+T细胞、CD3+CD4+T细胞、CD4+/CD8+T细胞比值、CD19+T细胞、CD3+CD8+T细胞差异均有统计学意义(P<0.05),两组CD3-CD(16+56)+NK细胞比较差异无统计学意义(P>0.05)。见表2。
表1 原发性ITP患儿与对照组血小板抗体检测结果比较(±s)%
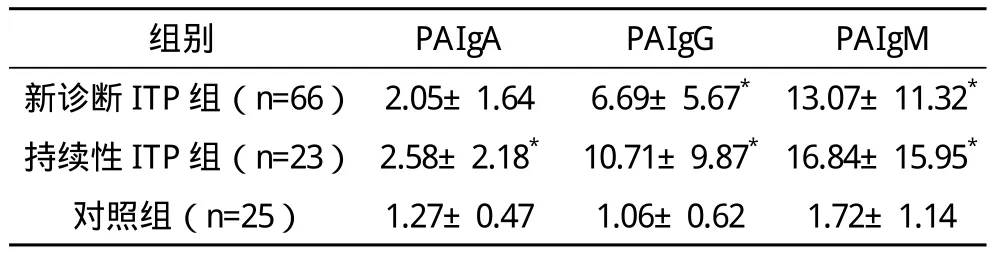
表1 原发性ITP患儿与对照组血小板抗体检测结果比较(±s)%
*与对照组比较,P<0.01
表2 原发性ITP患儿淋巴细胞亚群水平与对照组比较(±s) %
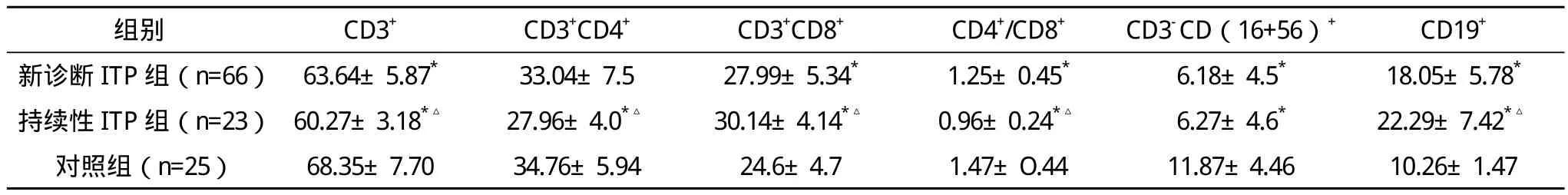
表2 原发性ITP患儿淋巴细胞亚群水平与对照组比较(±s) %
*与对照组比较,P<0.05,△与新诊断组比较,P<0.05
3 讨论
原发性ITP是儿童期好发的一种自身免疫性出血性疾病,以自身抗体产生导致血小板破坏增多而致外周血血小板减少。关于ITP的发病机制复杂多样,其中单核-巨噬细胞系统中自身抗体介导的血小板破坏增加、骨髓巨核细胞损伤或功能异常使血小板生成减少,被认为是经典的ITP发病机制[4]。这些抗体主要表现为IgG增高,有时表现为IgM或IgA增高[5]。本文实验结果显示,新诊断组与持续性组PAIgG、PAIgM和对照组相比显著增高(P<0.001),而持续性组PAIg水平与新诊断组相比差异无统计学意义(P>0.05),这与文献[6]报道基本一致,提示PAIg检测无法鉴别新诊断ITP与持续性ITP,但可作为ITP诊断的辅助指标。
近年来随着研究的深入,发现ITP患者体内存在着多种T淋巴细胞异常,Cines D B等[7]认为T细胞异常导致B细胞激活可能才是ITP真正的发病机制。本文结果显示,新诊断组与持续性组CD3+T细胞、CD4+/CD8+T细胞比值细胞明显低于正常儿童,CD3+CD8+T细胞、CD19+B细胞明显高于正常儿童,比较差异均有统计学意义(P<0.05);持续性组与新诊断组比较,除NK细胞差异无统计学意义(P>0.05)外,其他淋巴细胞亚群差异均有统计学意义(P<0.05)。NK细胞对B细胞分化有抑制作用,能调节吞噬作用和抗体依赖细胞介导的细胞毒作用。研究发现激活的NK细胞能够抑制ITP的自身免疫反应[8]。ITP患儿NK细胞数量和对照组相比显著降低(P<0.05)提示其对B细胞激活、增殖、分化和抗体应答抑制能力下降,从而使B细胞异常活化,体液免疫过强而发病。
综上所述,细胞免疫与体液免疫在ITP发病中起了重要作用,血小板相关抗体和淋巴细胞亚群水平检测的联合使用对ITP的诊断及疗效观察有较好的实用价值,在治疗上要注意纠正免疫失衡,运用免疫调节手段治疗ITP。
[1]Rodeghiere F, Stasi R, Gernsheimer T, et al. Standardization of terminology, definitions and outcome criteria in immune thrombocytopenic purpura of adults and children: report form an international working group[J]. Blood,2009,113(11):2386-2393.
[2]Zhang F, Chu X, Wang L, et al. Cell-mediated lysis of autologous platelets in chronic idiopathic thrombocytopenic purpura[J]. Eur J Haematol,2006,76(5):427-431.
[3]张之南.血液病诊断及疗效标准[M].第3版.北京:科学出版社,2008:172-175.
[4]孟美丽,黄瑞滨.特发性血小板减少性紫癜患者血小板特异性抗体的表达、意义及检测[J].江西医药,2009,44(3):279-282.
[5]Chong B H, Ho S J. Autoimmune thrombocytopenia[J]. Thromb Haemost,2005,3:1763-1772.
[6]尹亚飞,罗自勉.血小板相关抗体在特发性血小板减少性紫癜诊治中的临床意义[J].临床医学,2012,32(1):4-5.
[7]Cines D B, McMillan R. Pathogenesis of chronic immune thrombocytopenic Purpura[J]. Curropin Hematol,2007,14(5):511-514.
[8]Johasson U, Macey M G, Kenny D, et al. The role of natural killer T cells in immune thrombocytopenia: is strong in vitro NKT cell activity related to the development of remission[J]. Br J Haematol,2005,129(4):564-565.
