耐高温耐酸耐酒精酵母的筛选与鉴定
2013-12-01娜日苏苏亚拉图高凤芹
娜日苏,苏亚拉图,高凤芹
(1.内蒙古师范大学生命科学与技术学院,内蒙古 呼和浩特 010022; 2.中国农业科学院草原研究所,内蒙古 呼和浩特 010010; 3.农业部草原资源与生态重点开放试验室,内蒙古 呼和浩特 010010)
后生物生产层
耐高温耐酸耐酒精酵母的筛选与鉴定
娜日苏1,2,苏亚拉图1,高凤芹2,3
(1.内蒙古师范大学生命科学与技术学院,内蒙古 呼和浩特 010022; 2.中国农业科学院草原研究所,内蒙古 呼和浩特 010010; 3.农业部草原资源与生态重点开放试验室,内蒙古 呼和浩特 010010)
从不同样品中经富集、分离、纯化和筛选,得到对高温、酸度、酒精耐受性较好的4株酵母菌,分别编号为JM-1、JM-2、JM-3和JM-4。对4株酵母菌进行形态学和生理学特征鉴定以及26S rDNA序列分析后得出,4个菌株的最适五碳糖浓度为12 g·L-1,最适生长酒精度为14%(体积分数),最适生长pH在2.5~3.0,最适生长温度为37 ℃;经26S rDNA序列分析鉴定出菌株JM-1、JM-2、JM-4属于Meyerozyma属,而菌株JM-3属于Pichia属;以上筛选到的菌种在耐高温、耐酸和耐酒精度中表现出良好的生长性能,具有一定的研究意义。
酵母菌;筛选;鉴定
近年来,随着能源安全和环境污染问题的日益加重,生物燃料乙醇以其燃烧更安全、CO2排放量低、具可持续性等优良特性,被誉为21世纪的“绿色能源”,它的开发利用受到了世界各国的普遍关注和重视。目前,解决世界能源危机的一条理想的途径是将甘蔗(Saccharumofficinarum)、玉米(Zeamays)、木薯(Manihotesculenta)和纤维类废弃物等转化为燃料乙醇,而提高燃料乙醇转化效率的关键在于筛选到优良菌种。微生物发酵生产乙醇时,菌株(一般为酵母)耐高温、耐乙醇和耐酸等特性的高低直接影响生产效率和原料利用率[1]。高温通常会引起酵母细胞内的脂肪酸、磷脂、麦角固醇等成分的变化,从而影响细胞本身正常生理活动[2]。而高浓度乙醇对酵母生长繁殖有延滞作用,会抑制酵母菌的发酵活性。因此,酵母的发酵能力在很大程度上取决于它们自身对乙醇耐受力的大小[3]。同时乙醇发酵也容易被一些不耐酸微生物污染,造成重大经济损失。因此,生产中需要加强耐高温耐酸耐酒精酵母的筛选。除此之外发酵菌种对五碳糖的利用和发酵能力也非常重要,因为纤维素原料经最终的降解得到的可发酵糖的成分是纤维素和半纤维素,而最终获得的单体糖类有五碳糖和六碳糖,其中五碳糖主要有阿拉伯糖和木糖,六碳糖主要有甘露糖和葡萄糖[4]。纤维素类物质中大多含有木质素和半纤维素,在一般情况下,原料预处理过程中绝大部分都会被除去,但半纤维素中降解的木糖等戊糖仍存留在反应液中,且当浓度达到5%时,木糖对纤维素酶的抑制率就可达10%[5]。如要消除木糖抑制,最好的办法是利用能转化木糖为乙醇的酵母菌株,例如:管囊酵母(Pachysolentannophilus),假丝酵母 (Candidatropicalis)等[6-7],而且将能利用葡萄糖发酵乙醇的酵母和利用木糖发酵乙醇的酵母进行混合发酵可提高乙醇产率30%~38%[5]。本试验从土壤、污水和微腐烂水果等不同样品中筛选分离到具有较强耐高温耐酸的酵母菌,并以这几个菌为出发菌株,初步研究了一些发酵特性,为下一步的相关研究提供有效依据。
1 材料与方法
1.1试验材料
1.1.1样品来源 样品采集于内蒙古自治区包头市酒厂酒槽废液及就近地的土壤、临河市药厂废弃液及就近地的土壤和呼和浩特市蔬菜市场的微腐烂水果。
1.1.2培养基
富集培养基:YPD液体培养基,酵母提取物10 g、蛋白胨20 g、葡萄糖20 g、蒸馏水1 000 mL,自然pH。
平板分离培养基:YPD琼脂;YPX培养基,酵母提取物10 g、蛋白胨20 g、木糖20 g、蒸馏水1 000 mL,自然pH。
初选培养基:2,3,5-氯化三苯基四氮唑(TTC)上层培养基,TTC 0.5 g、蒸馏水1 000 mL、葡萄糖5 g、琼脂18 g;TTC下层培养基,葡萄糖10 g、蛋白胨2 g、KH2PO41 g、酵母膏1.5 g、MgSO4·7H2O 0.4 g、琼脂30 g、蒸馏水1 000 mL,pH值5.5~5.7;保存液为脱脂奶粉10 g、蔗糖1 g、100 mL蒸馏水。
1.2试验方法
1.2.1酵母菌的分离和纯化
土壤样品:称取土壤样品5 g加入到45 mL无菌水中,在37 ℃ 、130 r·min-1下, 震荡30 min。取不同稀释度的悬液20 μL,涂布于分离纯化培养基中,在37 ℃下培养48 h。待长出菌落后,挑选具有典型酵母菌菌落特征的菌落进行镜检,确认为酵母菌后进一步进行划线分离,直至得到纯种。
污水样品:取5 mL污水样品加到45 mL无菌水中,在37 ℃ 、130 r·min-1下, 震荡30 min。其余处理步骤同土壤样品。
水果样品:称取微腐烂水果表面果肉样品5 g 样品加入到45 mL 已灭菌的富集培养基中,置于37 ℃ 培养箱中培养48 h。其余处理步骤同土壤样品。
1.2.2菌株的筛选
第1步:将分离到的酵母菌株分别涂布于YPX平板,在45 ℃下,培养48 h。选出生长相对较快、菌落较大的酵母菌进行下一步筛选。
第2步:将上一步分离得到的酵母菌株分别接种到将pH已调为2.0的液体YPD培养基里,37 ℃培养72 h,选出生长相对较快、菌落较大的酵母菌。
第3步:将以上两步筛选到的菌株在YPD固体培养基上37 ℃培养48 h后转接到TTC下层培养基上,等长出菌落后覆盖上一层TTC显色剂,TTC显现不同颜色,产乙醇能力强的酵母菌会显现深红色,次之显粉红色,微红色或者不显色的为野生酵母菌[8]。
第4步:采用杜氏管发酵法,将筛选到的酵母菌接种于液体YPD培养基中,置于28 ℃恒温培养箱中培养72 h后,测定酵母菌株产气泡的快慢及在规定时间内产气泡的多少,比较各株酵母菌的起酵能力及发酵能力,从而筛选出发酵性能优良的酵母菌[9]。
1.2.3发酵特性的测定
高温试验:经复选出的酵母接入液体YPD培养基中,分别置于20、25、30、35、40和45 ℃恒温培养48 h,以初始培养基为对照,测不同温度下酵母菌的OD600与发酵力。
耐酒精试验:将复选出的酵母菌接种到酒精浓度已分别调为8%、10%、12%、14%、16%、18% (体积比)的液体YPD培养基中,37 ℃ 培养72 h,测不同酒精度下酵母菌的OD600和发酵力。
耐酸试验:将筛选到的酵母菌接种到pH已分别调为1.5、2.0、2.5、3.0和3.5的液体YPD培养基中,37 ℃ 培养72 d,测定不同pH条件下的酵母菌OD600和发酵力。
耐五碳糖试验:将筛选到的酵母菌接种到不同五碳糖浓度(4、8、12、16和20 g·L-1)的液体YPD培养基中,即37 ℃ 培养48 h后测值。
1.2.4发酵速度的测定 采用杜氏管发酵法将活化后的酵母菌接到液体YPD培养基,于30 ℃,130 r·min-1摇床培养,每隔2 h观察记录气泡的产生时间和大小,最后记录下气泡充满小管的时间[10]。
1.2.5生长曲线测定 将活化好的酵母菌接种于液体YPD培养基中,在一定温度下,200 r·min-1摇床培养,每隔2 h取样一次,用未接种的液体YPD作空白对照,于600 nm测OD值,以培养时间为横坐标,绘制生长曲线[11]。
1.2.6菌株分子生物学鉴定 利用酵母菌基因组DNA提取试剂盒(北京天根生物科技公司)提取酵母菌的DNA,对酵母菌26S rDNA基因片段进行PCR扩增。扩增产物利用琼脂糖凝胶电泳检测后,送至上海尼桑生物科技有限公司进行测序。测序结果用BLAST软件与GenBank中相关种属的26S rDNA序列进行比对, 用DNAMANV4.0软件的Multiple Sequence Alignment进行26S rDNA同源性分析,并构建系统发育树。以同源性大于99%为种的分界阈值将待测的菌株鉴定到种[12]。
引物序列为NL1:5′-GCATATCAATAAGCGGAGGAAAAG-3′和NL4:5′-GGTCCGTGTTTCAAGA-CGG-3′[13](由上海尼桑生物科技有限公司合成)。PCR反应体系(50 μL)为:2×Tap PCR MasterMix(购自天根生化科技有限公司)25 μL,引物NL1和NL4各3 μL,加入酵母菌DNA模板2 μL于反应体系中混合,加ddH2O补足至50 μL。PCR 扩增条件[14]为: 94 ℃预变性10 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,33个循环,72 ℃延伸10 min。
2 结果与分析
2.1酵母菌的分离、纯化与筛选 通过分离和纯化,从不同样品中初步分离得到128株酵母菌。再通过第1步的筛选得到82株酵母菌,即这些酵母菌可在45 ℃下,在五碳糖培养基上生长;经第2步筛选得到24株酵母菌,即这些酵母菌可在pH为2.0的情况下生长;通过第3步筛选得到14株酵母菌,即这些菌在TTC培养基上显深红色;再经后一步筛选得到了综合性能最好的4株酵母菌,即这些菌的耐高温耐酸产酒精能力较好,其形态特征如表1和图1所示。

表1 耐高温耐酸酵母菌的初选结果Table 1 The primary election results of high temperature resistant acid yeast
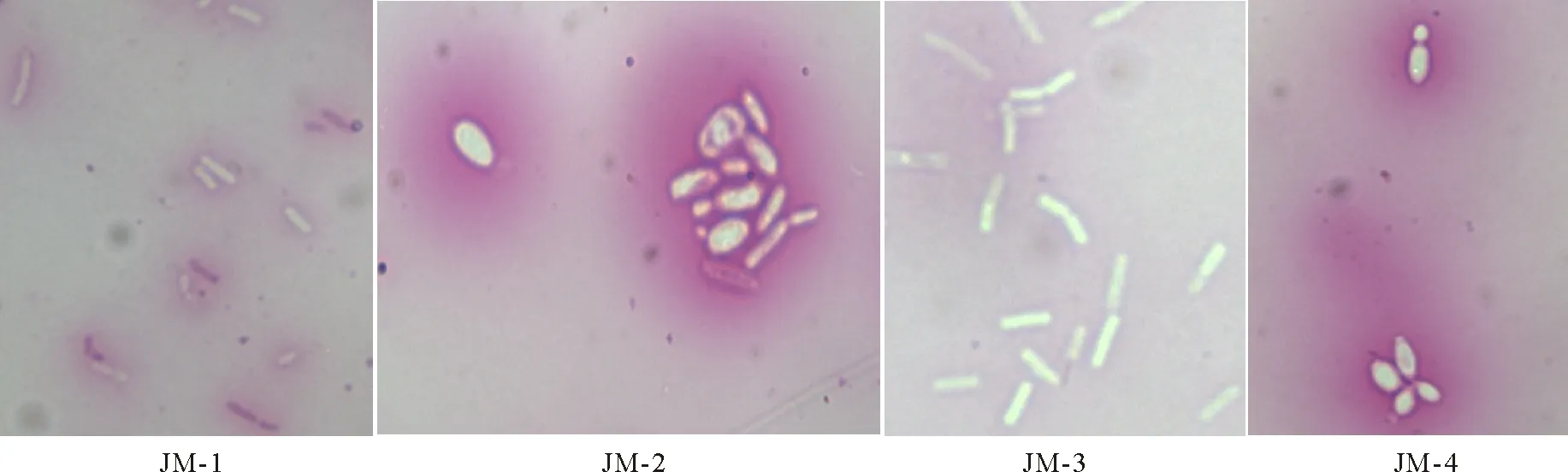
图1 菌株的显微照片Fig.1 The microphotograph of four strains
2.2酵母菌发酵特性的测定 通过分离、纯化和筛选,最终得到4株耐高温耐酸产酒精且发酵力较好的酵母菌。鉴于酵母菌的耐酸性、耐高温性和对酒精的耐受性等特性对实际的纤维素发酵产乙醇等不同行业中的重要影响,进一步测定了筛选到的4个菌株的相关发酵特性(图2-图5)。
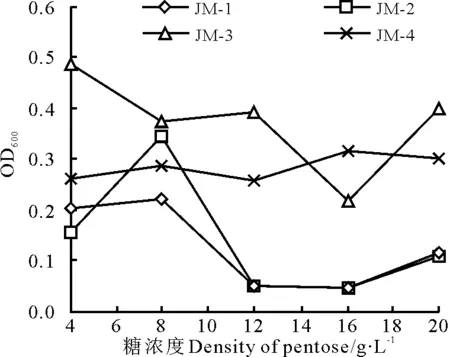
图2 五碳糖对酵母菌的影响 Fig.2 Effects of five-carbon sugar on cell growth

图3 酒精对酵母菌的影响 Fig.3 Effects of alcohol on cell growth
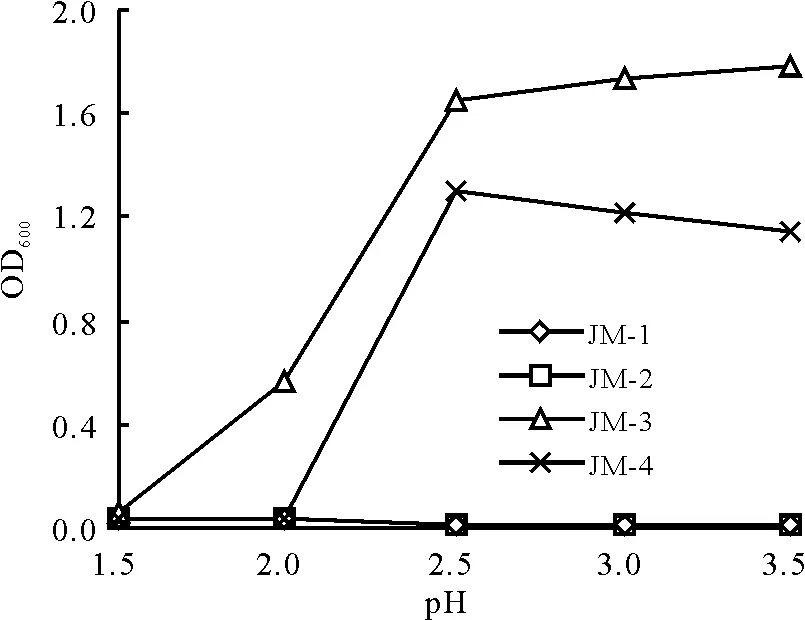
图4 pH值对酵母菌的影响Fig.4 Effects of pH on cell growth
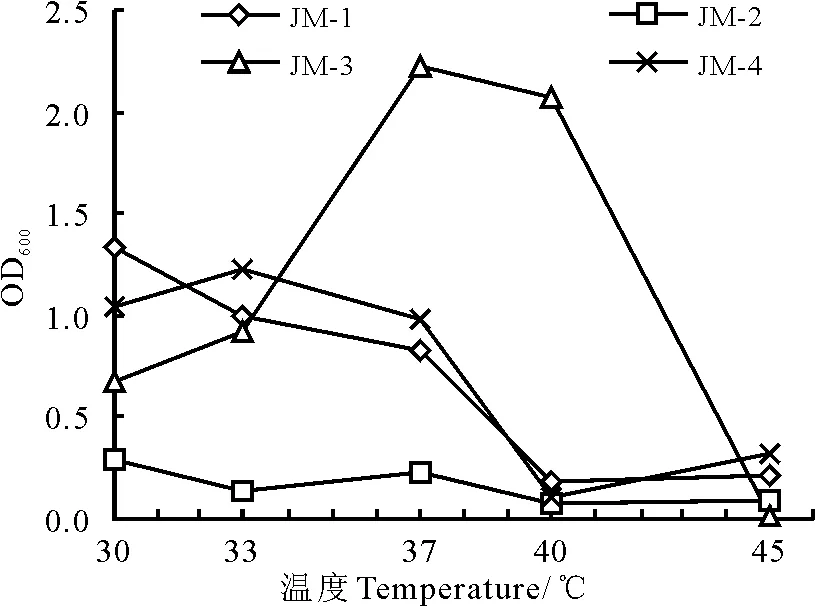
图5 温度对酵母菌的影响Fig.5 Effects of temperature on cell growth
2.2.1初始糖浓度对酵母生长的影响 提高纤维素物质转化为乙醇的效率对半纤维素的利用是十分重要的[15-17]。半纤维素水解后的主要成分为木糖,一般的酒精酵母都不能直接发酵木糖生成酒精,但自然界中有包括酵母菌在内的许多微生物可以代谢木糖生成酒精,且利用基因工程技术对酒精酵母进行遗传改造后使其同时具备发酵葡萄糖和木糖生成酒精的研究也已取得了重要进展[18]。所以本研究首先将酵母菌接种到五碳糖YPX培养基中,其生长情况如图2所示,即将酵母菌接种到含不同木糖浓度(4~20 g·L-1) 的液体YPX培养基中后,菌JM-4的生长受不同糖浓度的影响最小,耐糖性相对较好,而菌JM-1和菌JM-2在糖浓度高于8 g·L-1的情况下生长受到明显的影响,生长有明显的下降趋势;菌JM-4随糖浓度增高,OD600值增大,但是,当糖浓度在16 g·L-1以上时出现抑制作用。这是因为高糖浓度下,渗透压大,对酵母造成伤害。菌JM-1和菌JM-2初始糖浓度在12 g·L-1时生长明显受抑制,4个菌株中菌JM-3在糖浓度12 g·L-1时耐糖性相对最好。
2.2.2酒精度对酵母菌生长的影响 将酵母菌接种到含不同酒精度(8%~16%)的YPD培养基中后(图3),4个菌株的最适生长酒精度为14%,酒精度大于14%时4个菌株的生长都受到明显的抑制,酒精对酵母菌本身具有一定的毒性,当达到一定的浓度时,就会抑制酵母菌的生长、细胞发育和酒精发酵的能力[19]。在酒精度大于14%时,生长明显受到抑制的菌株为菌JM-3,酒精度小于14%时,在不同酒精度下生长情况最好的为JM-3,其次为菌JM-1和菌JM-4,菌JM-2生长情况最差。
2.2.3pH值对酵母菌生长的影响 酵母菌的正常生长pH值在4.5~5.5,但是较低的pH值可抑制杂菌的生长,因此筛选到耐酸的菌种对于发酵工艺来讲有很大的意义[20]。出于此考虑将酵母菌接种到不同酸度(1.5~3.5) 的YPD培养基中后(图4),菌JM-3和菌JM-4的耐酸性较好,而菌JM-1和菌JM-2的耐酸性较差。菌JM-3和菌JM-4在pH小于2.0时生长情况很差,pH大于2.0后生长有明显改善,而菌JM-1和菌JM-2在pH为2.5~3.5时生长情况一直很差。
2.2.4高温对酵母菌生长的影响 在低温范围内,温度越高,酶反应越快,酵母菌的生长代谢加快,乙醇会提前生成。当温度升高到一定程度时,继续升温则酶失活增快,表现出酵母菌易衰老、发酵周期变短,从而影响发酵乙醇的产量[21]。将酵母菌接种到YPD培养基中,在不同温度的处理下,4个菌株的最适生长温度在37 ℃左右,高于37 ℃ 4个菌株的生长都有所降低,且除了菌JM-3其他3个菌的生长都明显降低,所以菌JM-3的耐高温性相对最好,菌JM-2的耐高温性最差(图5)。
2.2.5菌株的发酵速率 菌JM-1,接种后20 h开始发酵,27 h后气泡充满整个杜氏管;菌JM-2,接种后26 h开始发酵,38 h后气泡充满整个杜氏管;菌JM-3,接种后16 h开始发酵,22 h后气泡充满整个杜氏管;菌JM-4,接种后14 h开始发酵,27 h后气泡充满整个杜氏管;从以上分析可初步得出,菌JM-2发酵性能相对最差,发酵周期最短的菌为JM-3,其次是菌JM-1,分别为4 h和7 h。
2.2.6菌株的生长曲线测定 菌JM-1的细胞繁殖速度较快,有明显的对数生长期,且生长旺盛(图6);菌株JM-4虽有对数生长期,22 h时OD值最大,即菌体数最多,但22 h后OD值下降。而菌JM-2和菌JM-3的生长曲线呈现出不规律性,菌体细胞的繁殖速度不均匀。因此,菌株JM-1生长较快,繁殖力较强,使得酵母菌接入发酵料后能迅速增殖,很快能达到主发酵期,从而迅速发酵,缩短发酵时间,减少被杂菌感染的机率。
2.3菌株的分子鉴定 对4株酵母菌基因组DNA提取和26S rDNA PCR 扩增,目的片段长度约600 bp。从琼脂糖电泳检测图片的相应亮度的条带可看出菌株JM-3和JM-4有比较亮的目的条带,菌株JM-1的目的条带较模糊,而菌株JM-2除了一个较模糊的目的条带外还有两条较模糊的特异性条带(图7)。将PCR目的片段回收送上海尼桑生物科技有限公司测序,使用NCBI网站Blast在线软件程序分析相似性,最终鉴定出目的菌株(表2)。
采用软件Mega4.0构建了包括4株试验菌与相关菌种模式菌株在内的26S rDNA序列系统发育树(图8),系统发育树Caenorhabditiselegans菌株26S rDNA 序列为外群。基于26S rDNA基因序列的系统发育树(图8)表明, JM-3以较高的置信度与P.kudriavzevii聚为一类,为同一物种; JM-1、JM-2和JM-4与M.guilliermondii和M.caribbica以较高的置信度聚为一类,其同源性都为100%,所以可能为M.guilliermondii或者M.caribbica。对于菌株JM-1、JM-2和JM-4的鉴定,需要更为细致的区分。
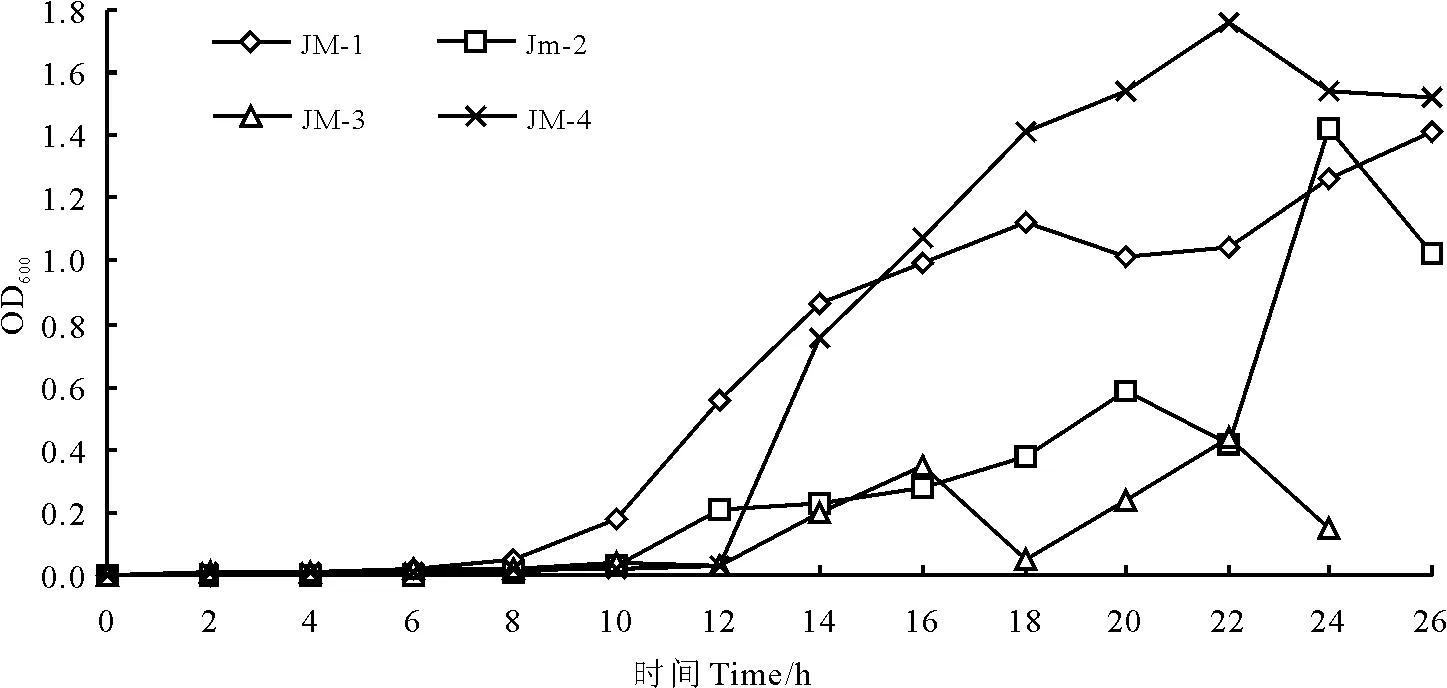
图6 4个菌株的生长曲线图Fig.6 The growth curve of four strains

图7 胶回收前电泳图Fig.7 Electrophoretogram before gel reclamation

编号Code序列长度Size/bp参考菌株Therelatedmembersofthefamilyyeast最大同源性Identity/%序列注册号GeneBankNo.JM-1615Meyerozymaguilliermondii;Meyerozymacaribbica100FJ432597JM-2615Meyerozymaguilliermondii;Meyerozymacaribbica100FJ432597JM-3600Pichiakudriavzevii100FJ919397JM-4616Meyerozymaguilliermondii;Meyerozymacaribbica99FJ432597

图8 分离菌株26S rDNA序列系统进化树Fig.8 Phylogenetic tree of 26S rDNA sequences of four strains
3 讨论
3.1酵母菌的筛选与鉴定 本试验初步分离到128株酵母菌,其中从土壤中分离到89株酵母菌,从污水中分离到33 株酵母菌,从微腐烂水果中分离到酵母菌6株。考虑到发酵工业用的发酵菌株的耐高温耐酸性的重要性,本试验是在45 ℃下,耐五碳糖培养基上初步筛选得到了82株菌株,又进一步在低酸(pH=2.0)环境下筛得选到27株酵母菌,最终通过产酒精能力和发酵力的比较筛选出了较好的4个菌株,即菌株JM-1、JM-2、JM-3和JM-4;通过26S rDNA序列测定和系统发育分析后,对以上4个菌株进行了分子生物学鉴定,其结果是,菌株JM-1、JM-2和JM-4属于Meyerozyma属,而菌株JM-3属于Pichia属。
3.2酵母菌的发酵特性研究 传统的酿酒酵母乙醇发酵最适温度范围在28~33 ℃,一般不会超过36 ℃,应用耐高温酵母生产乙醇可节约能源、提高出酒率、缩短发酵周期和提高设备的利用率并维持夏季正常生产[22]。本试验筛选出的4个菌株的最适生长温度为37 ℃,都高于一般酵母菌的最适生长温度。
研究表明,当培养基中积累的酸性物质使pH≤4.5后,酵母菌的生理代谢活动就会逐渐受到抑制,从而原料的发酵能力逐渐下降,甚至停止[23]。本试验中4个菌的最适pH为2.5,即它们在低酸环境下可以正常生长和发酵,说明其对酸的耐受性较好,用于生产可以有效避免杂菌污染,提高得率。
在工业生产中起酵速度决定整个生产周期的长短。起酵速度快,能够大大缩短生产周期,满足工业生产需要。且菌株生长周期中如没有延滞期,说明该菌株生命力旺盛,适应环境能力强,从发酵速率试验可看出,起酵时间最短的菌株为菌JM-4,为14 h。其次是菌JM-3,为16 h;从起酵到完成发酵利用时间最短的菌株为菌JM-3,为4 h;其次为菌JM-1,为7 h;筛选到的这4个菌,无论从延滞期的长短还是从起酵时间的长短看,都不是投到生产中理想的菌株,要投入到生产中,还需要进一步对菌种进行驯化和改良。
4 结论
本试验中初步分离到128株酵母菌,其中从土壤中分离到89株,从污水中分离到酵母菌33株,从微腐烂水果中分离到酵母菌6株。
通过常规分类鉴定、26S rDNA序列测定和系统发育分析后,初步鉴定出菌株JM-1、JM-2和JM-4属于Meyerozyma属,而菌JM-3属于毕赤酵母属Pichia。
通过酵母菌的生长特性试验发现,耐糖性最好的菌株为菌JM-3,在不同酒精度下生长情况最好的菌株为菌株JM-1,耐酸性好的菌株为菌株JM-3和JM-4,耐高温最好的菌株为菌株JM-3,发酵周期最短的菌株也为菌株JM-3,所以综合考虑菌株JM-3各方面的生长特性最好。
[1] 苏艳秋,朱卫华,吴鹏,等.耐高温、耐酸产酒精酵母的筛选与鉴定[J].微生物学杂志,2009,29(2):42-47.
[2] 王灏,王航,孟春,等.基因组改组技术选育耐高温、耐高乙醇酿酒酵母菌株的研究[J].微生物学通报,2007,34(4):705-708.
[3] Pina C,Antonio J,Hogg T.Inferring ethanol tolerance ofSaccharomycesand non-Saccharomycesyeasts by progressive inactivation[J].Biotechnology Letters,2004,26(19):1521-1527.
[4] 李炳志.酵母对纤维素乙醇生产中的抑制剂响应的系统生物学研究[D].天津:天津大学,2010.
[5] 邓良伟.纤维素类物质生产燃料酒精研究进展[J].食品与发酵工业,1995,21(5):69-72.
[6] Delgenes J P,Moletta R,Navarro J M.Effects of lignocellulose degradation products on ethanol fermentations of glucose and xylose bySaccharomycescerevisiae,Zymomonasmobilis,Pichiastipitis,andCandidashehatae[J].Enzyme and Microbial Technology,1996,19(3):220-225.
[7] Alexander M A,Chapman T W,Jeffries T W.Continuous ethanol production from D-xylose byCandidashehatae[J].Biotechnology and Bioengineering,1987,30(5):685-691.
[8] 王敏,朱会霞,孙金旭,等.高温酵母的分离及其特性研究[J].中国酿造,2006(11):38-41.
[9] 郭勇.酶工程[M].北京:科学出版社,2009.
[10] 单艺,张兰威,崔宏斌.传统法酿造糯米酒中酵母菌的筛选及发酵特性研究[J].食品工业科技,2007,28(8):88-93.
[11] 宋丹,喻子牛,蔡皓.耐高温产乙醇酿酒酵母菌S-13的特性研究[J].化学与生物工程,2011,28(6):63-67.
[12] Thompson J D,Higgins D G,Gibson T J.CLUSTAL W:Improving the sensitivity of progressive multiple sequence alignment through sequence weighting,position-specific gap penalties and weight matrix choice[J]. Nucleic Acids Research,1994,22(22):4673-4680.
[13] Fell J W,Boekhout T,Fonseca A,etal. Biodiversity and systematics of basidiomycetous yeasts as determined by large-subunit rDNA D1/D2 domain sequence analysis[J]. International Journal of Systematic and Evolutionary Microbiology,2000,50(3):1351-1371.
[14] 张亮,池振明.株产纤维素酶海洋酵母菌的筛选、鉴定及发酵条件优化[J].中国海洋大学学报(自然科学版),2007(37):101-108.
[15] Wyman C E.Biomass ethanol:Technical progress,opportunities,and commercial challenges[J].Annual Review of Energy and the Environment,1999,24(1):189-226.
[16] Thomson J A.Molecular biology of xylan degradation[J].FEMS Microbiology Letters,1993,104(1-2):65-82.
[17] 缪礼鸿,李湛,黄瑞.利用木糖的耐高温产酒精酵母菌的筛选[J].武汉工业学院学报,2006,25(1):37-38.
[18] Ho N W Y,Chen Z D,Brainard A P.Genetically engineeredSaccharomycesyeast capable of effective cofermentation of glucose and xylose[J].Applied and Environmental Microbiology,1998,64(5):1852-1859.
[19] 易弋,伍时华.酒精耐受性酵母菌的筛选[J].广西工学院学报,2008,19(3):42-46.
[20] 刘畅,王涛,石翠芳.耐高温酵母菌的筛选及特性研究[J].酿酒,2007,34(2):52-54.
[21] 程殿林.微生物工程技术原理[M].北京:化学工业出版社,2007:114-124.
[22] 柯涛,朱昌雄,余华顺,等.酿酒酵母菌耐热性快速鉴别的方法研究[J].生物技术,2006,16(4):33-35.
[23] 罗惠波,李光辉.耐酸酵母菌的筛选研究[J].四川理工学院学报(自然科学版),2004,17(3):151-154.
Screeningandidentificationofyeastfortolerancetohightemperature,alcoholandlowacid
Narisu1,2, Suyalatu1, GAO Feng-qin2,3
(1.Inner Mongolia Normal University, Huhhot 010022, China;2.Grassland Research Institute, Chinese Academy of Agricultural Sciences, Huhhot 010010, China;3.Key Laboratory of Grassland Resources and Ecology, Ministry of Agriculture, Huhhot 010010, China)
Yeast from the different samples such as the polluted water, soil and slightly rot fruit and so on was enriched, separated, purified and selected, and 4 yeast strains for tolerance to high temperatures, low acid and alcohol, named JM-1,JM-2,JM-3 and JM-4, were obtained. The results showed that the best suitable to five-carbon sugar concentration, alcohol, acidity and temperature of 4 yeast strains were 12 g·L-1, 14% (volume ratio), between 2.5 to 3.0 as well as 37 ℃ by morphological and physiological characterization respectively. The results indicated that strains JM-1, JM-2 and JM-4 belonged to the genusMeyerozyma, and strain JM-3 belongedPichiausing sequence analysis of 26S rDNA D1/D2 region. Selected yeast strains expressed good quality and performance on behalf of tolerance to high temperature, alcohol, low acid, and had some research significance.
yeast; select; identify
GAO Feng-qin E-mail:gaofq1211@126.com
TS261.1+1
A
1001-0629(2013)10-1625-08
2013-01-24 接受日期:2013-07-16
中央级公益性科研院所基本科研业务费专项资金(1610332012204)作者简介:娜日苏(1988-),女(蒙古族), 内蒙古赤峰人,在读硕士生,主要从酿酒酵母菌种的筛选技术研究。E-mail:tenarisu@163.com
高凤芹(1978-),女,黑龙江龙江人,助理研究员,在读博士生,主要从事生物质能源转化技术研究。E-mail:gaofq1211@126.com
