NaCl对匍匐剪股颖组织培养及 幼苗抗氧化酶的影响
2013-12-01邓志瑞
钱 凯,邓志瑞,陈 沁
(上海大学生命科学学院,上海 200444)
植物生产层
NaCl对匍匐剪股颖组织培养及幼苗抗氧化酶的影响
钱 凯,邓志瑞,陈 沁
(上海大学生命科学学院,上海 200444)
以匍匐剪股颖(Agrostissoionifera)种子为材料,研究不同浓度(0、17、51、85、136、204和272 mmol·L-1)NaCl对匍匐剪股颖种子萌发率,愈伤组织诱导、生长、再生及再生幼苗过氧化物酶(POD)和超氧化物歧化酶(SOD)活性的影响。结果表明,随着盐浓度的升高,匍匐剪股颖种子发芽率,愈伤组织诱导率和分化率及幼苗再生率随之下降,当NaCl溶液浓度高达272 mmol·L-1时,完全抑制种子萌发;NaCl溶液浓度在204 mmol·L-1时,愈伤组织无法生长。在不同浓度NaCl处理下,匍匐剪股颖再生幼苗SOD活性先上升,达到最大值(83 U·g-1)之后降低;POD的活性变化与SOD相似,也是先上升,达到最大值(3 896 U·g-1)之后缓慢下降。
NaCl;匍匐剪股颖;愈伤组织;过氧化物酶;超氧化物歧化酶
盐胁迫是指环境与生物之间由于渗透势的不平衡而形成的对生物的一种胁迫。盐渍除产生渗透胁迫外,还对植物产生离子胁迫,即离子毒害作用[1]。匍匐剪股颖(Agrostissoionifera)属冷季型草坪草,草质柔软、细嫩,生长迅速,草坪优美,观赏性强,常用于高尔夫球场球道、发球区和果岭等高品质高强度管理的草坪[2],但其抗病虫害能力差且耐盐性不理想。土壤盐渍化是人类面临的生态危机之一,盐胁迫已成为影响农业生产最重要的环境胁迫因子。孙天国和沙伟[3]以甜瓜(Cucumismelo)为材料,发现随着盐浓度的增大,甜瓜种子发芽率呈下降趋势。在不同浓度的盐胁迫处理下,甜瓜幼苗超氧化物歧化酶(SOD)活性先下降再升高,之后降低;过氧化物酶(POD)的活性先上升,之后缓慢下降。盐浓度超过幼苗自身的忍耐程度时,会导致POD和SOD的活性均下降。蔡小东等[4]的研究表明,随着盐浓度的升高,柑橘(Citrusreticulata)愈伤组织生长量显著下降,可溶性蛋白含量表现出先增加后减少的趋势,可溶性糖和游离脯氨酸的含量显著增加,而SOD和过氧化氢酶(CAT)活性均表现出先增强后减弱的变化趋势。
目前关于匍匐剪股颖盐胁迫效应方面的研究较少,而研究盐胁迫下匍匐剪股颖种子发芽率、愈伤组织诱导和分化及幼苗的再生情况,了解匍匐剪股颖抵御盐胁迫的生理机制,对于培育耐盐品种及建立匍匐剪股颖转基因平台具有重要的理论和实践意义。鉴于此,本研究以匍匐剪股颖种子为材料,研究了盐胁迫对匍匐剪股颖种子萌发特性以及愈伤组织发生、幼苗保护酶活性的影响,试图在组织水平上探讨匍匐剪股颖抵御盐胁迫的生理机制。
1 材料与方法
1.1试验材料 以匍匐剪股颖成熟种子为材料进行愈伤组织诱导试验。
1.2试验方法
1.2.1NaCl对匍匐剪股颖种子发芽率的影响 用70%的乙醇浸泡种子5 min,无菌水清洗3次,再用体积分数10%的次氯酸钠灭菌90 min,无菌水清洗5次。将种子接种于添加了不同浓度NaCl溶液(0、17、51、85、136、204和272 mmol·L-1)的培养基上,每皿接种40~50粒于25 ℃条件下暗培养。
1.2.2NaCl对匍匐剪股颖愈伤组织诱导的影响 以1.2.1中的方法处理得到的对照组(0 mmol·L-1)萌发幼苗为材料,切取1 cm长的胚轴作外植体接种于上述不同浓度NaCl的诱导培养基上,每两周继代一次,统计愈伤组织诱导频率。
1.2.3NaCl对匍匐剪股颖愈伤组织分化及再生的影响 愈伤组织经两次继代后,将状态良好的胚性愈伤组织转接到含1.0 mg·L-16-BA 和相应浓度NaCl溶液的分化培养基上,于25 ℃光照条件下培养。待植株长至5 cm后,炼苗,并移栽至营养土中。
1.2.4NaCl对幼苗POD、SOD活性的影响 取不同盐浓度下再生幼苗的鲜叶0.25 g,加入2.5 mL的0.2 mol·L-1磷酸缓冲液于冰上研磨成匀浆,15 000 r·min-1离心10 min,取上清备用。SOD活性测定参照邹琦[5]方法,以每分钟抑制NBT光还原50%为1个酶活单位。POD活性参照克热木·伊力等[6]的方法测定,以ΔOD470(mg·min)表示。
1.3数据统计分析 试验结果均为3次测定的平均值(n=3),采用SPSS软件进行方差分析(one-way ANOVA)和Duncan多重比较检验,并以平均值±标准差表示,采用Excel 2003作图。
2 结果与分析
2.1NaCl对匍匐剪股颖种子发芽的影响 NaCl对匍匐剪股颖种子的萌发有抑制作用(图1)。低浓度(17、51 mmol·L-1)盐对匍匐剪股颖的发芽影响较小,而高浓度(136、204 mmol·L-1)盐会延缓或抑制匍匐剪股颖种子的萌发,当NaCl溶液浓度达到272 mmol·L-1时,完全抑制种子萌发。匍匐剪股颖种子的发芽结果表明,用17 mmol·L-1的NaCl处理时发芽率为57.1%,约为对照的70%;用204 mmol·L-1的NaCl处理时发芽率为2.0%,约为对照的2.5%(图2)。

图1 氯化钠对匍匐剪股颖种子萌发的影响(15 d)Fig.1 Effect of NaCl on seed germination of creeping bentgrass(15 d)
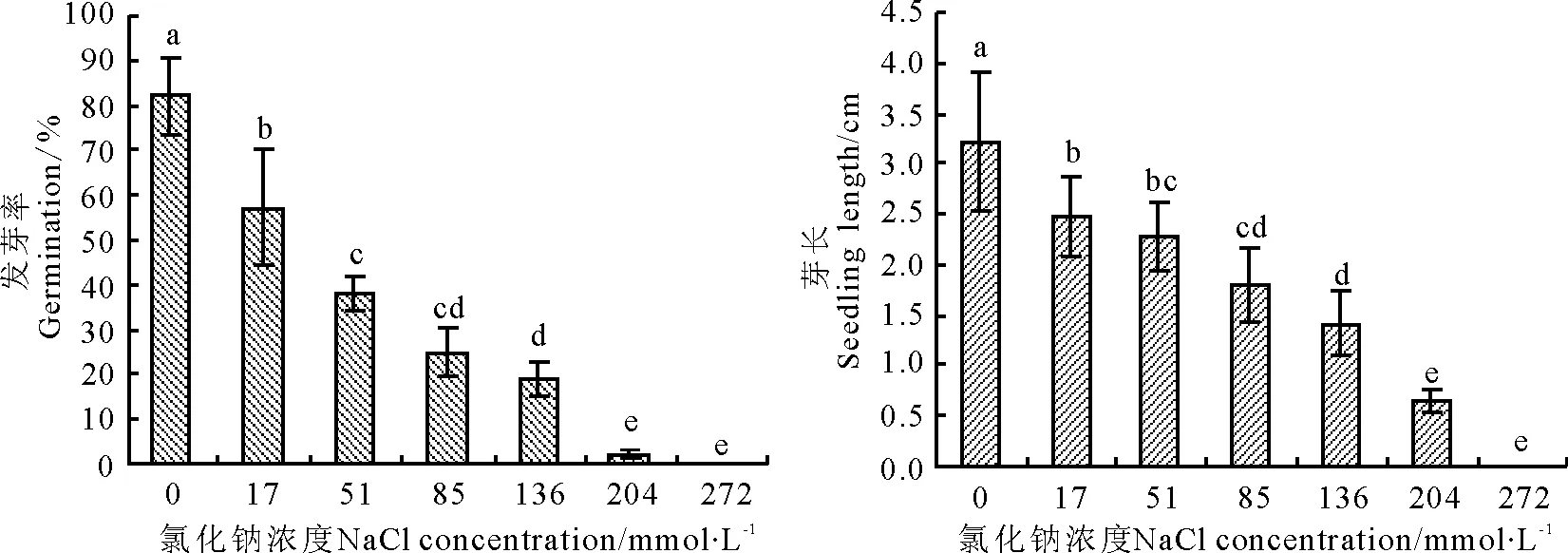
图2 氯化钠对匍匐剪股颖种子发芽的影响Fig.2 Effect of NaCl on seed germination of creeping bentgrass
注:不同小写字母表示处理间差异显著(Plt;0.05)。下同。
Note:Different lower case letters indicate significant difference among different treatments at 0.05 level.The same below.
对照发芽最早且幼苗生长最快,用17 mmol·L-1的NaCl处理时芽长平均值为2.48 cm,约为对照的75%;用204 mmol·L-1的NaCl处理时平均芽长仅有0.64 cm,不到对照的20%。
由此可知,匍匐剪股颖发芽率和芽长随着NaCl浓度的升高而显著下降(Plt;0.05)。
2.2NaCl对匍匐剪股颖愈伤组织诱导的影响 萌发的幼苗接种于不同浓度NaCl的诱导培养基上,愈伤组织生长情况表明,不同浓度盐对愈伤组织的形成有抑制作用(图3)。盐浓度愈高,抑制作用愈明显。同一盐浓度诱导培养25 d后的愈伤组织比15 d前有一定的增长,低盐浓度(17、51 mmol·L-1)下愈伤组织有明显的生长,高盐浓度(85、136 mmol·L-1)下愈伤组织生长缓慢,当盐浓度为204 mmol·L-1时,愈伤组织几乎不生长。
愈伤组织培养25 d后,统计不同盐浓度下匍匐剪股颖愈伤组织的诱导情况和组织块的大小,结果表明,盐对愈伤组织的诱导和生长均有抑制作用(图4)。用17 mmol·L-1的NaCl处理时,愈伤组织诱导率为34%,约为对照的60%。当NaCl浓度大于85 mmol·L-1时诱导率明显降低,至204 mmol·L-1时到最低值(1%),仅为对照的2%。可知,匍匐剪股颖愈伤组织的诱导频率随着盐浓度的升高而显著下降。
用17 mmol·L-1的NaCl处理时愈伤组织平均直径最大为0.875 cm,相当于对照的80%,用204 mmol·L-1的NaCl处理时平均直径仅为0.3 cm,约是对照的25%。可知,随着盐浓度的升高,愈伤组织生长呈下降趋势。
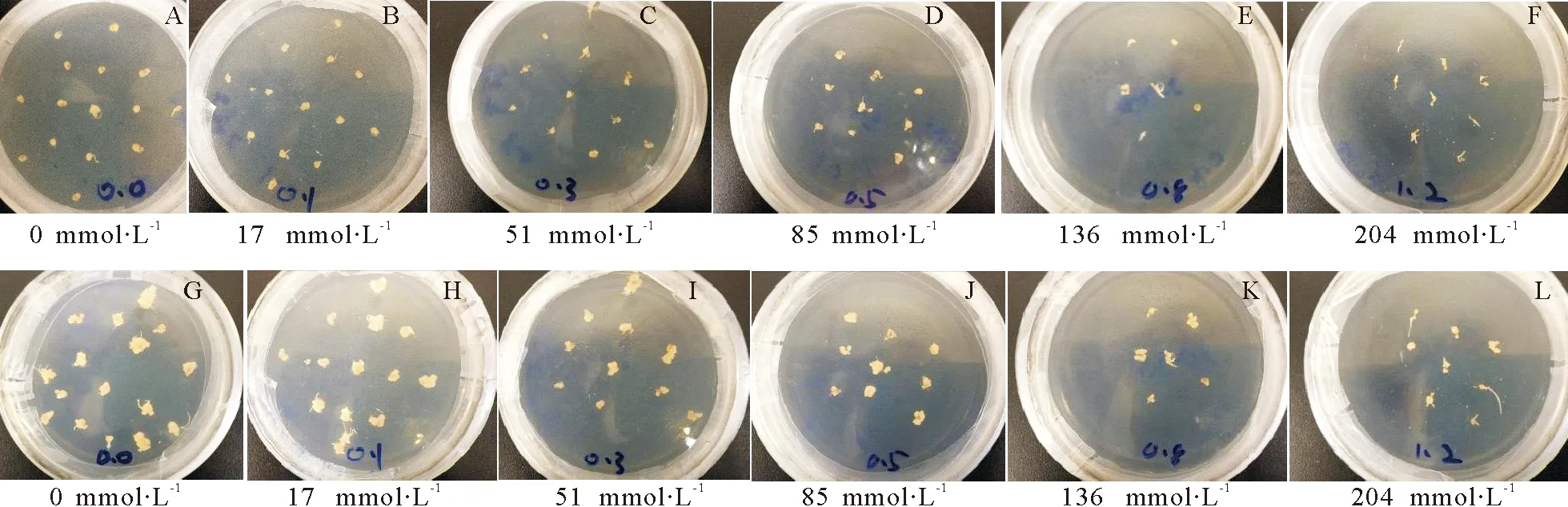
图3 氯化钠对愈伤组织诱导的影响Fig.3 Effect of NaCl on callus induction
注:A、B、C、D、E、F为培养15 d;G、H、I、J、K、L为培养25 d。
Note:A,B,C,D,E and F are cultured 15 days;G,H,I,J,K and L are cultured 25 days.

图4 氯化钠对愈伤组织诱导率和愈伤组织直径的影响Fig.4 Effect of NaCl on callus induction rate and callus diameter
2.3NaCl对愈伤组织分化的影响 将上述愈伤组织继代到含不同浓度NaCl的分化培养基上可知,NaCl在愈伤组织的分化过程中起抑制作用(图5),盐浓度愈高抑制作用越明显。对照愈伤组织分化速度最快,低浓度盐(17、51 mmol·L-1)条件下的愈伤组织分化速度次之,高浓度盐(85、136 mmol·L-1)条件下的愈伤组织分化速度较慢,当NaCl浓度为204 mmol·L-1时愈伤组织不再分化。
2.4NaCl对愈伤组织再生的影响 将分化的愈伤组织分别移栽到含相应浓度NaCl的营养土里,绝大多数能再生出绿苗,形态正常,生长状态良好,且能形成大量丛生苗,其中对照尤为明显(图6)。随着盐浓度的升高,愈伤组织再生率不断下降。NaCl浓度达到204 mmol·L-1时再生失败,无绿色新苗长出。说明NaCl使愈伤组织的再生能力下降。
对不同盐浓度条件下的愈伤组织再生率进行统计分析,结果表明,随着NaCl浓度的升高,愈伤组织再生率呈下降趋势(图7)。对照组再生率最大,为90%,用136 mmol·L-1的NaCl处理时再生率为30%,是最大值的1/3。盐浓度为204 mmol·L-1时,愈伤组织无法再生幼苗。
2.5NaCl对幼苗POD、SOD活性的影响 不同盐浓度下生长的再生幼苗叶片POD活性的变化整体过程是先上升后下降,用51 mmol·L-1的NaCl溶液处理时POD活性达到最大值(3 896 U·g-1)(图8)。说明低浓度盐胁迫可提高POD的活性,随着处理浓度的增加,POD活力下降。不同浓度盐溶液对SOD活性的影响与POD相似,活性的变化过程整体上是先上升后急剧下降,在NaCl溶液浓度为17 mmol·L-1时SOD活性达到最大值(83 U·g-1)。

图5 氯化钠对愈伤组织分化的影响Fig.5 Effect of NaCl on callus differentiation
注:A、B、C、D、E、F为培养5 d;G、H、I、J、K、L为培养15 d;M、N、O、P、Q、R为培养20 d。
Note:A,B,C,D,E and F are cultured 5 days;G,H,I,J,K and L are cultured 15 days;M,N,O,P,Q and R are cultured 20 days.

图6 氯化钠对愈伤组织再生的影响Fig.6 Effect of NaCl on callus regenerations
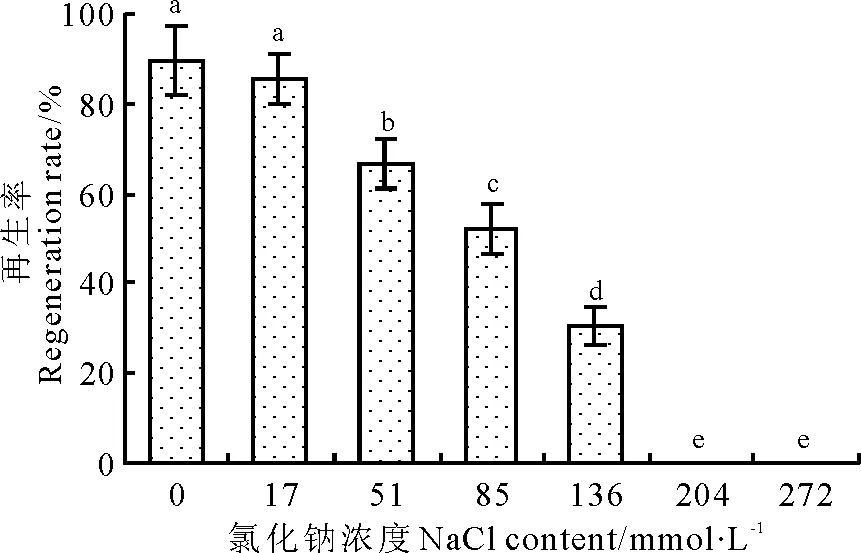
图7 氯化钠对植株再生率的影响Fig.7 Effect of NaCl on callus regeneration rate
3 讨论与小结
盐胁迫对匍匐剪股颖种子的发芽率和发芽势有抑制作用,且随着盐浓度的升高抑制作用逐渐加强。这一试验结果与孙天国和沙伟[3]对甜瓜幼苗的研究的结果相似。可能的原因是高浓度的Na+胁迫可使植物产生次级伤害,不仅抑制细胞呼吸,还能导致细胞生理性缺水[7],而水分是种子萌发不可缺少的要素之一。毛秀红等[8]认为,盐不仅产生渗透胁迫,而且能产生离子胁迫即单盐毒害。Na+过多会造成培养基水势降低,使种子吸收水分困难,细胞水分亏缺,呼吸受阻,并且容易造成生理缺水干旱,影响种子的萌发和幼苗的生长。

图8 氯化钠对幼苗POD和SOD活性的影响Fig.8 Effect of NaCl on POD and SOD activity
本试验结果表明,盐胁迫对匍匐剪股颖愈伤组织的诱导和分化均有抑制作用,随着盐浓度的升高抑制作用逐渐加强。推测可能的原因是植物在盐胁迫条件下,各种氨基酸、可溶性蛋白质、离子和脯氨酸等含量发生了显著的变化[9],从而影响了细胞的正常新陈代谢,使愈伤组织的诱导受到抑制。而且Na+的胁迫会破坏渗透平衡和细胞质膜的完整性,导致细胞膜选择透过性下降甚至丧失,细胞内离子失调,引发一系列代谢紊乱,从而阻止细胞分裂、增殖以及分化,使愈伤组织在盐胁迫下由于渗透胁迫和离子毒害而生长减缓[10]。
盐胁迫对匍匐剪股颖愈伤组织的再生也有抑制作用,随着NaCl浓度的升高,愈伤组织再生率呈下降趋势。可能是因为过量的Na+、Cl-渗入植物细胞内,破坏了离子平衡并瓦解膜电势,使细胞原生质凝集,同时破坏蛋白质合成,加快蛋白质水解,使蛋白质含量降低,而蛋白质合成是器官发生所必须的[11]。
Kalir和Poliakoff-Mayber[12]证明盐害与自由基伤害有关。本试验的结果表明,不同盐浓度处理使POD和SOD活性先上升后下降,高浓度盐胁迫超过了愈伤组织自身的忍耐程度时,POD和SOD的活性下降。这一试验结果与克热木·伊力等[6]对阿月浑子(Pistaciavera)的研究结果相似。分析其中的原因可能是盐胁迫引发细胞内活性氧的过量生产、积累而打破了平衡。 许多有关盐胁迫对植物伤害的研究结果表明,活性氧介导了膜脂的过氧化作用[13-16],从而使细胞结构和功能都受到破坏。植物对胁迫的响应之一就是保护酶活性的变化,而植物体内的POD、SOD 在消除超氧化物自由基、减轻脂质过氧化作用和膜伤害方面起着重要作用[17]。在盐胁迫下虽然保护酶活性加强,但其调节能力也是有限的[18],当逆境胁迫严重时,将导致植物死亡[19]。综上所述,盐胁迫不仅抑制种子萌发,愈伤组织诱导、分化和再生,而且影响幼苗SOD、POD的活性。
[1] 余叔文,汤章城.植物生理与分子生物学[M].第2版.北京:科学出版社,2001:739.
[2] 王贵元,徐娟,夏仁学.植物的番茄红素及影响其形成的生理因素[J].植物生理学通讯,2004,40(4):511-515.
[3] 孙天国,沙伟.盐胁迫对甜瓜种子萌发及幼苗SOD,POD活性的影响[J].安徽农业科学,2009,37(24):11509-11510,11513.
[4] 蔡小东,黄颖,曹文娟.盐胁迫对柑橘愈伤组织生理效应的影响[J].湖北农业科学,2012,51(12):2493- 2495,2501.
[5] 邹琦.植物生理学[M].北京:中国农业出版社,2000:163-166.
[6] 克热木·伊力,袁琳,齐曼·尤努斯,等.盐胁迫对阿月浑子SOD、CAT、POD活性的影响[J].新疆农业科学,2004,41(3):129-134.
[7] Silberbush M,Ben-Asher J.Simulation study of nutrient uptake by plants from soiless cultures as affected by salinity buildup and transpiration [J].Plant and Soil,2001,233:59-69.
[8] 毛秀红,刘翠兰,燕丽萍,等.植物盐害机理及其应对盐胁迫的策略[J].山东林业科学,2010(4):128-130.
[9] 刘慧,杨军,王立强,等.苦马豆抗盐愈伤组织突变系的筛选[J].中国农学通报,2009,25(20):58-62.
[10] 陆卫,贾敬芬.谷子胚性愈伤组织耐盐系的选择及其生理生化特性分析[J].作物学报,1994,20(2):241-247.
[11] 陈云昭,王玉国.在盐胁迫下获得的大豆愈伤组织及再生植株的生化反应[J].大豆科学,1992,11(1):70-73.
[12] Kalir A,Poliakoff-Mayber A.Changes in activity of malate dehydrogenase,catalase,peroxidase and superoxide dismutase in leaves ofHalimioncprotulacoidesexposed to high sodium chloride concentration[J].Annals of Botany,1981,47:75-81.
[13] 杨立飞,朱月林,胡春梅,等.NaCl胁迫对嫁接黄瓜膜脂过氧化、渗透调节物质含量及光合特性的影响[J].西北植物学报,2006,26(6):1195-1200.
[14] 胡学俭,孙明高,夏阳,等.NaCl胁迫对无花果与海棠膜脂过氧化作用及保护酶活性的影响[J].西北植物学报,2005,25(5):937-943.
[15] 张亚冰,刘崇怀,潘兴,等.盐胁迫下不同耐盐性葡萄砧木丙二醛和脯氨酸含量的变化[J].河南农业科学,2006(4):84-86.
[16] 李琼,刘国道,郇树乾,等.盐胁迫下六种禾本科牧草幼苗叶片膜脂过氧化作用及其与耐盐性的关系[J].家畜生态学报,2005,26(5):63-67.
[17] 柳展基,于翠梅,张月杰,等.不同盐浓度下水稻胚性愈伤组织生理生化指标分析[J].山东农业科学,2000(3):22-23.
[18] 李海燕,丁雪梅,周婵,等.盐胁迫对三种盐生禾草种子萌发及其胚生长的影响[J].草地学报,2004,12(1):47-50.
[19] Liang Y C,Hu F,Yang M C,etal.Antioxidative defenses and water deficit-induced oxidative damage in rice growing on non-flooded paddy soils with ground mulching [J].Plant and Soil,2003,257:407-416.
EffectsofNaclonthetissuecultureofcreepingbentgrassandantioxidantenzymeactivities
QIAN Kai, DENG Zhi-rui, CHEN Qin
(College of Life science, Shanghai University, Shanghai 200444, China)
Effects of different NaCl concentration(0,17,51,85,136,204 and 272 mmol·L-1)on creeping bentgrass (Agrostissoionifera) seed germination rate, callus formation, growth, plantlet regeneration and POD and SOD activities of regenerated seedlings were studied using creeping bentgrass seeds. The results showed that creeping bentgrass germination rate, callus induction rate and differentiation rate and seedling regeneration rate decreased with NaCl concentration increasing gradually. When NaCl concentration was above 272 mmol·L-1,seed germination was inhibited completely. When NaCl concentration was 204 mmol·L-1, calluses were not able to grow at all. Under salt stress, SOD activity of creeping bentgrass regenerated seedlings rose to the maximum value of 83 U·g-1and then declined. Changes of POD activity were similar to SOD activity.
NaCl; creeping bentgrasses; callus; POD; SOD
CHEN Qin E-mail:chenqincc@staff.shu.edu.cn
S540.1;Q944.6
A
1001-0629(2013)10-1548-07
2013-01-16 接受日期:2013-03-07
上海市教育委员会科研创新项目暨上海大学创新基金(A.10-0112-10-004) 作者简介:钱凯(1990-),男,浙江湖州人,在读硕士生,主要从事逆境生理研究。E-mail:731784508@qq.com
陈沁(1970-),女,江苏江都人,教授,博士,主要从事分子生物学研究。E-mail:chenqincc@staff.shu.edu.cn
