光强和温度对罗勒幼苗叶片叶绿素荧光的影响
2013-12-01郑桂英张会慧孙广玉
田 野,郑桂英,张会慧,许 楠,王 娟,孙广玉
(东北林业大学生命科学学院,黑龙江 哈尔滨 150040)
光强和温度对罗勒幼苗叶片叶绿素荧光的影响
田 野,郑桂英,张会慧,许 楠,王 娟,孙广玉
(东北林业大学生命科学学院,黑龙江 哈尔滨 150040)
以花色素苷含量不同的紫罗勒(Ocimumbasilicum‘Purple Ruffles’)和丁香罗勒(O.gratissimum)为研究对象,将其低温(4 ℃)暗处理3 h后,分别转换到弱光(200 μmolom-2·s-1)和强光(1 000 μmolom-2·s-1)下,研究花色素苷对叶片叶绿素荧光特性及光合能量分配的影响。结果表明,弱光下,丁香罗勒幼苗叶片叶绿素荧光参数较常温均无显著变化(Pgt;0.05),但弱光导致低温处理后的紫罗勒幼苗叶片光化学反应的量子产额(YPSⅡ)低于高光处理,而依赖于类囊体膜两侧质子梯度和叶黄素循环的量子产额(YNPQ)较高。说明紫罗勒和丁香罗勒对弱光的响应不同,弱光有利于促进丁香罗勒幼苗叶片胁迫解除后的恢复,却导致紫罗勒幼苗叶片恢复的时间延长。低温处理后,高光使丁香罗勒幼苗叶片Fv/Fm降低,发生光抑制,而紫罗勒幼苗可能由于叶片中花色素苷含量较高,发挥其光衰减和过滤作用,导致低温预处理紫罗勒幼苗叶片并没有发生光抑制。低温处理后,高光下丁香罗勒幼苗叶片YPSⅡ降低,失活PSⅡ反应中心的热耗散量子产额(YNF)明显升高,而高光下,紫罗勒幼苗叶片YPSⅡ升高,YNPQ降低,而进一步说明了花色素苷可能在光破坏防御上发挥了作用。
花色素苷;低温;叶绿素荧光;光抑制
罗勒(Ocimumbasilicum)为唇形科罗勒属一年生草本植物,可食用,气味芳香,其提取物具有药用价值[1]。罗勒品种繁多,其中紫罗勒(O.basilicum‘Purple Ruffles’),又称紫叶九层塔,是罗勒的变种之一,其叶片富含大量的花色素苷,花色素苷在食品、药品和化妆品行业有广泛应用价值[2]。在我国北方地区,尤其是黑龙江省,紫罗勒主要作为城市绿化和观赏植物,其培育方式多采用温室育苗后移栽大田。由于温室内温度高、光强低,移栽到大田后,植物必然受到低温和高光强的胁迫。在对紫罗勒的管理中发现,育苗移栽后的低温高光强下,富含花色素苷的紫罗勒比绿色叶片的罗勒生长势强,受逆境的危害程度小。由于二者之间花色素苷含量差异较大,因此,叶片中的花色素苷可能在逆境下发挥了作用。花色素苷是广泛分布于植物体中的水溶性天然色素,也是某些植物叶片、果实以及其他器官主要的呈色物质[3]。花色素苷能作为抗氧化剂防止高光氧化造成的伤害[4-5],并且可以抵御UV-B辐射[6]、低温[7]和同化二氧化碳[8]等造成的伤害。花色素苷的形成对减轻光抑制或者光氧化伤害具有重要作用[9]。Hughes等[10]研究发现处于冬季高光条件下的常绿草本植物Galaxurceolata叶片会累积花色素苷,叶片颜色由绿转红,这为花色素苷具有光衰减和抗氧化功能提供了有利证据。Pietrini等[11]研究证明,玉米(Zeamays)叶片中的花色素苷能够保护叶绿体,防止低温光抑制产生,从而提高光合效率。目前,有关低温和光强胁迫对植物叶片影响的研究都集中于黄瓜(Cucumissativusvar.sativus)[12]、辣椒(Capsicumannuumvar.annuum)[13]、矮嵩草(Artemisialancea)和垂穗披碱草(Elymusnutans)等[14]花色素苷含量较少的常绿植物。但是,在低温高光条件下,紫罗勒叶片中的花色素苷在保护叶绿体,防止高光和低温光抑制等方面是否具有作用,鲜见报道。为此,本试验以富含花色素苷的紫罗勒为研究对象,以花色素苷较少的丁香罗勒(O.gratissimum)为对照试验材料,利用叶绿素荧光技术研究低温胁迫后不同光强下罗勒幼苗叶片花色素苷含量与叶片光能吸收和分配等的关系,旨在阐明紫罗勒叶片的花色素苷对低温高光强下光破坏的防御作用,以期为罗勒的栽培管理和园林绿化提供参考。
1 材料与方法
1.1试验材料 试验于2012年1月在东北林业大学植物生理学实验室进行。供试品种为紫罗勒(R)和丁香罗勒(G),其中紫罗勒叶片均为紫色,丁香罗勒叶片为绿色。于1月初播种,将种子种植在直径12 cm、高15 cm的培养钵中,每钵5粒,采用草炭土与蛭石(体积比为2∶1)的混合物为培养基 。在光照强度200 μmol·m-2·s-1、日温23~27 ℃、夜温17~22 ℃、相对湿度75%左右的温室中培养,定期浇水和苗期管理。待幼苗出土长至约10 cm时进行间苗处理,每钵保留生长相对一致的幼苗1株。
1.2处理和测定方法 模拟黑龙江省春季室外低温环境(一般夜间温度4~6 ℃,白天温度20~25 ℃,最大光照强度1 000 μmol·m-2·s-1)和移栽前大棚环境,设置4个处理(表1)。随机选取生长在温室中的长势一致的紫罗勒和丁香罗勒幼苗各40盆进行试验,每处理10盆。选取从上向下的第1片完全展开的成熟叶片测定各种生理指标,活体测定叶绿素荧光指标后,继续检测其它生理指标,每处理重复3次。

表1 温度、光照强度的处理组合Table 1 Temperature and light intensity combinations
利用无水乙醇法[15]测定叶绿素总量(Chl)、叶绿素a (Chl a)和叶绿素b (Chl b)含量,并计算叶绿素a和b的比值(Chl a/Chl b)。按照Pirie和Mullins[16]的方法测定叶片中花色素苷(Ant)的含量,并计算花色素苷和叶绿素的比值(Ant/Chl)。
叶绿素荧光参数参照Hu等[17]的方法测定。取从上向下的第1片成熟叶片经过0.5 h暗适应,利用便携式脉冲调制荧光仪FMS-2 (Hansatch公司,英国)测定叶片的初始荧光(Fo)、最大荧光(Fm)、PSⅡ最大光化学效率(Fv/Fm)和潜在光化学效率(Fv/Fo),并测定不同光强下(约200和1 000 μmol·m-2·s-1)叶片的电子传递速率(ETR)和实际光化学效率(ФPSⅡ)。按张会慧等[18]的方法分别计算出PSⅡ反应中心吸收光能的去向,即用于光化学反应的光量子产额(YPSⅡ)、依赖于类囊体膜两侧质子梯度和叶黄素循环的光量子产额(YNPQ)、基本的荧光量子产额和热耗散的能量产额(Yf,D)以及失活PSⅡ反应中心的热耗散能量产额(YNF)。
1.3数据处理 运用Excel和DPS软件对测定数据进行统计分析,图中数据为平均值±标准差(SE),并采用双因素方差分析(Two-way ANOVA)比较不同数据的组间差异。
2 结果与分析
2.1罗勒幼苗叶片叶绿素和花色素苷含量的差异 品种之间比较,紫罗勒和丁香罗勒幼苗叶片中的总叶绿素、叶绿素a和叶绿素b含量差异不显著 (Pgt;0.05)。但紫罗勒幼苗叶片花色素苷含量是丁香罗勒的29.63倍,两者之间差异显著(Plt;0.05),且紫罗勒幼苗叶片花色素苷/叶绿素比值也显著高于丁香罗勒,是丁香罗勒的21.12倍(表2)。
2.2低温处理后不同光强对罗勒幼苗叶片生长表型的影响 与未经过低温处理的两种罗勒相比,低温处理3 h后的两种罗勒幼苗叶片均出现了不同程度的伤害,其中丁香罗勒幼苗叶片受害更为严重。在弱光下,低温处理后的两种罗勒幼苗成熟叶片边缘出现水渍状,叶片表现出冷害症状。低温处理后,在高光下,丁香罗勒幼苗幼叶出现水渍状,较老叶片均变淡并逐渐发黄,叶片边缘逐渐失绿,且从叶柄开始表现冷害症状,但是,紫罗勒幼苗幼叶表现正常(图1)。
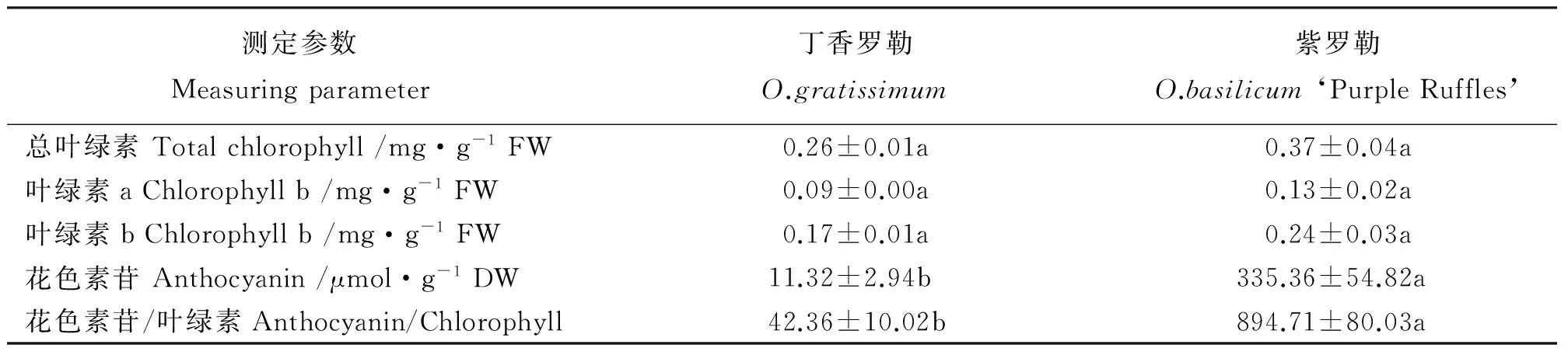
表2 罗勒幼苗叶片叶绿素和花色素苷含量Table 2 Chlorophyll and anthocyanin content in leaves of Ocimum basilicum seedlings
注:表中数据为均值±标准误。同行不同小写字母表示两个种间差异显著(Plt;0.05)。
Note: Data in the table are mean±SE. Different lower case letters within the same row indicate significant differences between two species at 0.05 levels.

图1 低温处理后不同光强对罗勒幼苗生长表型的影响Fig.1 Effects of different light intensities on leaves of Ocimum seedlings after low temperature treatment
注:CK1为常温弱光,CK2为常温高光;TL-LL为低温弱光,TL-LH为低温高光。下图同。
Note:CK1, CK2, TL-LL, TL-LH are treatments of normal temperature and low hight,normal temperature and high light,low temperature and low light,and low termperature and high light,respectively.The same below.
2.3低温处理后不同光强对罗勒幼苗叶片Fo和Fm的影响 紫罗勒幼苗叶片Fo和Fm均显著低于丁香罗勒幼苗叶片。低温处理后,在弱光下,两种罗勒幼苗叶片Fo和Fm均降低,而在低温处理后高光下,丁香罗勒幼苗叶片Fo和Fm较常温高光处理降低14.81%和53.93%,但紫罗勒幼苗叶片Fo和Fm均升高,尤其是紫罗勒幼苗叶片,Fm较常温高光处理升高35.31%(图2)。
2.4低温处理后不同光强对罗勒幼苗叶片Fv/Fm和Fv/Fo的影响 紫罗勒幼苗叶片Fv/Fm和Fv/Fo低于丁香罗勒幼苗叶片。低温处理后,弱光没有改变两种罗勒幼苗叶片的Fv/Fm和Fv/Fo(Pgt;0.05),但高光强却明显降低了丁香罗勒幼苗叶片Fv/Fm和Fv/Fo,比CK1分别降低了18.22%和55.56%(Plt;0.05),而强光对紫罗勒幼苗叶片Fv/Fm和Fv/Fo影响不大(图3)。
2.5低温处理后不同光强对罗勒幼苗叶片qP和qNP的影响 与CK1和CK2比较,低温处理后,弱光降低了两种罗勒幼苗叶片qP,紫罗勒叶片qP降低的更为明显。与CK1比较,高光使紫罗勒幼苗叶片qP显著升高了12.6%(Plt;0.05),而丁香罗勒幼苗叶片qP略有降低,与CK1比较差异不显著(图4)。低温处理后,弱光对两种罗勒幼苗叶片qNP影响不大,与CK1比较差异不显著(Pgt;0.05),而高光却明显降低了两种罗勒幼苗叶片qNP,且紫罗勒幼苗叶片qNP与CK1比较差异显著(Plt;0.05)。

图2 低温处理后不同光强对罗勒幼苗叶片Fo和Fm的影响Fig.2 Effects of different light intensities on Fo and Fm in leaves of Ocimumseedlings after low temperature treatment
注:同一种不同小写字母表示处理间差异显著(Plt;0.05)。下同。
Note:Different lower case letters for the same species show significant difference among four treatments at 0.05 level.The same below.

图3 低温处理后不同光强对罗勒幼苗叶片Fv/Fm和Fv/Fo的影响Fig.3 Effects of different light intensities on Fv/Fm and Fv/Fo in leaves of Ocimumseedlings after low temperature treatment
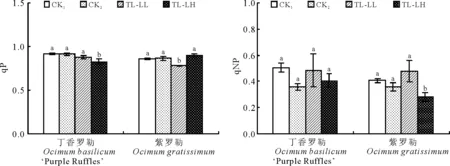
图4 低温处理后不同光强对罗勒幼苗叶片qP和qNP的影响Fig.4 Effects of different light intensities on qP and qNP in leaves of Ocimumseedlings after low temperature treatment
2.6低温处理后不同光强对罗勒幼苗叶片ФPSⅡ和ETR的影响 低温处理后,弱光下两种罗勒幼苗叶片ФPSⅡ和ETR较CK1均无显著变化,高光下两种罗勒幼苗叶片ФPSⅡ较CK1分别降低了20.11%和11.77%,差异显著(Plt;0.05)。但是,无论常温还是低温,高光下丁香罗勒和紫罗勒幼苗叶片ETR较CK1显著增加,分别是低温弱光处理罗勒幼苗叶片的3.99倍和4.41倍,且差异显著(Plt;0.05) (图5)。

图5 低温处理后不同光强对罗勒幼苗叶片ФPSⅡ和ETR的影响Fig.5 Effects of different light intensities on ФPSⅡ and ETR in leaves of Ocimumseedlings after low temperature treatment
2.7低温处理后不同光强对罗勒幼苗叶片PSⅡ反应中心光能分配的影响 丁香罗勒幼苗叶片YPSⅡ低于富含花色素苷的紫罗勒幼苗叶片,但YNPQ则高于紫罗勒幼苗叶片。低温处理后,弱光下两种罗勒幼苗叶片YPSⅡ较CK1低,高光下丁香罗勒幼苗叶片YPSⅡ和YNPQ均比CK1降低,幼苗叶片Yf,D和YNF较常温处理则明显升高,其中丁香罗勒幼苗叶片YNF是常温弱光处理的3.32倍。低温处理后,在高光下,紫罗勒叶片YPSⅡ较低温弱光处理明显升高18.08%,而叶片YNPQ和YNF较低温弱光处理分别降低59.81%和45.75%,Yf,D则无明显变化(图6)。

图6 低温处理后不同光强对罗勒幼苗叶片PSⅡ反应中心吸收光能分配参数的变化Fig.6 Effects of different light intensities on the PSⅡenergy allocation pathways in leaves of Ocimum seedlings after low temperature treatment
3 讨论
植物在逆境条件下叶片光能利用能力下降[19],叶片吸收的光能不能完全利用,出现光能过剩,如果不能通过热耗散等途径将过剩光能耗散掉,则会对光合机构产生伤害[20],尤其是在低温阴暗处生长的植物,突然转移到高光下会引起植物光抑制和光伤害的发生。逆境条件下,Fv/Fm降低指示植物叶片发生了光抑制[21],Fo降低是由于PSⅡ反应中心的热耗散增加[22],而Fo升高表示PSⅡ反应中心受到破坏或可逆失活[23]。本研究中,低温处理后的高光导致了丁香罗勒幼苗叶片Fo、Fv/Fm、Fv/Fo和ФPSⅡ显著降低,而弱光下无明显变化,同时,丁香罗勒幼苗叶片PSⅡ反应中心的热耗散增加,而潜在光化学效率降低,说明低温高光导致了丁香罗勒幼苗叶片受到光抑制,而低温弱光下丁香罗勒并未发生光抑制。低温处理后的弱光还是强光下,紫罗勒幼苗叶片Fo和Fv/Fm均无显著差异,可见低温处理后的强光并未使紫罗勒幼苗叶片发生光抑制。但低温处理后的弱光下,紫罗勒幼苗叶片吸收的光能分配给PSⅡ反应中心的光能减少,光化学淬灭系数qP显著降低,用于光化学反应的量子产额(YPSⅡ)明显减少,这可能是由于紫罗勒幼苗叶片富含花青素而降低了光能的吸收。两个品种在低温处理后的高光下,紫罗勒幼苗叶片qP较丁香罗勒幼苗显著升高,可能是高光使叶片吸收过剩的光能导致丁香罗勒幼苗叶片PSⅡ反应中心失活或者不可逆破坏,而紫罗勒幼苗叶片中富含大量的花色素苷吸收多余蓝绿光以保护叶肉细胞,从而减少光能的吸收,紫罗勒幼苗叶片未产生过剩光能或者过剩光能相对少,进而保护PSⅡ反应中心进行正常的光化学反应,这也是紫罗勒幼苗叶片Fo均低于丁香罗勒幼苗叶片的重要原因之一。两种罗勒幼苗叶片ФPSⅡ和ETR是低温处理后在不同光强下测得的,ФPSⅡ和ETR的变化情况可以间接说明植物对低温胁迫恢复的快慢程度。本研究表明,高光使低温处理后两种罗勒幼苗叶片ФPSⅡ和ETR较常温处理降低,且丁香罗勒幼苗叶片ФPSⅡ和ETR较紫罗勒幼苗降低幅度显著,但在低温处理后弱光下,两种罗勒幼苗叶片ФPSⅡ和ETR无明显影响。可见高光使两种罗勒幼苗叶片受低温胁迫后的恢复速率不同,且高光对丁香罗勒幼苗叶片的恢复速率影响较大,甚至有可能破坏了丁香罗勒幼苗叶片,造成不可逆的损害。因此,在低温恢复过程中,高光使丁香罗勒幼苗叶片原初光化学效率和潜在光化学活性降低,电子传递速率减慢,而低温处理后在高光下紫罗勒幼苗叶片恢复速率相对较快。由于紫罗勒含有较高含量的花色素苷,减缓了叶片对光能的吸收,降低了过剩光能的积累,从而表现出较强的抗低温抗高光能力。
从植物吸收光能的分配去向来分析低温处理后不同光强下两个品种罗勒的响应情况,低温处理后弱光下两种罗勒幼苗叶片各能量分配变化基本一致,但在高光下,可能由于紫罗勒幼苗叶片中花色素苷的存在,YPSⅡ高于丁香罗勒幼苗和未经低温预处理的紫罗勒幼苗,而低温处理的丁香罗勒幼苗叶片YNF均明显高于紫罗勒幼苗和未经低温处理的丁香罗勒幼苗,可见低温处理过程中高光对紫罗勒幼苗叶片吸收能量分配影响不大,紫罗勒幼苗叶片PSⅡ反应中心失活反应中心较少[18],而高光导致丁香罗勒幼苗叶片吸收的光能较多,叶片PSⅡ反应中心失活数量剧增,从而产生光抑制或者氧化伤害。植物对光抑制破坏的防御有很多种方式,其中利用热耗散是其中一种防御方式。本研究中,低温处理后高光下,丁香罗勒幼苗主要通过增加依赖于类囊体膜两侧质子梯度和叶黄素循环、基本的荧光量子产额和热耗散以及失活PSⅡ反应中心的热耗散等方式来保护叶片,其中最为显著的是失活PSⅡ反应中心的热耗散。有研究表明,PSⅡ反应中心失活过程消耗能量,以减轻剩余有活性PSⅡ反应中心的压力[21],反之,有活性的PSⅡ反应中心随后能激活这些失活PSⅡ反应中心[24]。有研究表明,弱光对低温伤害恢复的促进作用,在弱光下便达到饱和[25],因此弱光下,丁香罗勒幼苗叶片PSⅡ活性恢复速率较快,使叶片对光能的吸收和利用达到平衡。但在高光下,低温处理的紫罗勒幼苗叶片PSⅡ反应中心并未受到光抑制的破坏,在弱光下,紫罗勒幼苗叶片YPSⅡ明显降低,而YNPQ升高,Yf,D和YNF变化不明显,可见弱光不利于紫罗勒幼苗叶片PSⅡ反应中心活性恢复,使紫罗勒幼苗叶片恢复到对照水平的时间延长,但并未影响紫罗勒的PSⅡ反应中心正常的生理功能,而高光有利于紫罗勒幼苗叶片PSⅡ反应中心活性恢复较快较好。
4 结论
低温高光引起丁香罗勒幼苗叶片光抑制,表现PSⅡ光化学活性和电子传递速率降低,而紫罗勒幼苗叶片由于花色素苷的保护作用,并未发生光抑制。弱光有利于丁香罗勒幼苗叶片PSⅡ活性恢复,却延长了紫罗勒幼苗叶片的恢复时间。适当的遮阴有利于低温胁迫的丁香罗勒幼苗叶片恢复正常,以避免叶片再受高光胁迫,而富含花色素苷的紫罗勒幼苗叶片即使高光也未受到光抑制,可能是花色素苷在植物恢复过程中保护紫罗勒幼苗叶片免受高光胁迫。
[1] 祝丽香.罗勒的研究与开发应用[J].北方园艺,2005,1(5):15-16.
[2] 孙丽华,江月仙,王巧能.天然抗氧化剂原花青素的保健功能及其应用[J].食品研究与开发,2004,25(2):109-112.
[3] 王石川,高亦珂,张秀海,等.植物花青素生物合成相关基因的研究及应用[J].植物研究,2011,31(5):633-640.
[4] Gould K S,McKelvie J,Markham K R.Do anthocyanins function as antioxidants in leaves? Imaging of H2O2in red and green leaves after mechanical injury[J].Plant, Cell and Environment,2002,25:1261-1269.
[5] Samuel O N,Kevin S G.Anthocyanins in leaves:Light attenuators or antioxidants[J].Functional Plant Biology,2003,30(8):865-873.
[6] Paulina G M,Matthew O,Eleni V,etal.Changes in the flavonoid and phenolic acid contents and antioxidant activity of red leaf lettuce (LolloRosso) due to cultivation under plastic films varying in ultraviolet transparency[J].Journal of agricultural and food chemistry,2007,55(25):10168-10172.
[7] Hughes N M,Neufeld H S,Burkey K O.Functional role of anthocyanins in high-light winter leaves of the evergreen herbGalaxurceolata[J].New Phytologist,2005,168:575-587.
[8] Arnold T,Appel H,Patel V,etal.Carbohydrate translocation determines the phenolic content of Populus foliage:a test of the sink-source of plant defense[J].New Phytologist,2004,164:157-164.
[9] van den Berg A K,Perkins T D.Contribution of anthocyanins to the antioxidant capacity of juvenile and senescing sugar maple (Acersaccharum) leaves[J].Functional Plant Biology,2007,34(8):714-719.
[10] Hughes N M,Morley C B,Smith W K.Coordination of anthocyanin decline and photosynthetic maturation in juvenile leaves of three deciduous tree species[J].New Phytologist,2007,175:675-685.
[11] Pietrini F,Iannelli M A,Massacci A.Anthocyanin accumulation in the illuminated surface of maize leaves enhances protection from photo-inhibitory risks at low temperature,without further limitation to photosynthesis[J].Plant,Cell and Environment,2002,25:1251-1259.
[12] 张子山,杨程,高辉远,等.低温光抑制恢复过程中黄瓜叶片PSⅡ活性及其电子传递对PSⅠ的影响[J].应用生态学报,2010,23(4):1049-1054.
[13] 张志刚,尚庆茂.低温、弱光及盐胁迫下辣椒叶片的光合特性[J].中国农业科学,2010,43(1):123-131.
[14] 孙英,陈建纲,张德罡,等.放牧对高寒草地4种草光响应和荧光特性的影响[J].草业科学,2012,29(4):577-585.
[15] 占丽平,鲁剑巍,杨娟,等.施肥对黑麦草生长和产量的影响[J].草业科学,2011,28(2):260-265.
[16] Pirie A,Mullins M G.Changes in anthocyanin and phenolics content of grapevine leaf and fruit tissues treated with sucrose,nitrate,and sbscisic acid[J].Plant Physiology,1976,58(4):468-472.
[17] Hu Y B,Sun G Y,Wang X C.Induction characteristics and response of photosynthetic quantum conversion to changes in irradiance in mulberry plants[J].Journal of Plant Physiology,2007,164(8):959-968.
[18] 张会慧,张秀丽,胡彦波,等.碱性盐胁迫对桑树幼苗叶片叶绿素荧光和激发能分配的影响[J].经济林研究,2012,30(1):6-12.
[19] 张子山,杨程,高辉远,等.低温光抑制恢复过程中黄瓜叶片PSⅡ活性及其电子传递对PSⅠ的影响[J].应用生态学报,2012,23(4):1049-1054.
[20] 胡文海,闫小红,袁丽芳,等.光强在低温弱光胁迫后番茄叶片光合作用恢复中的作用[J].植物研究,2011,31(2):164-168.
[21] Ji B,Jiao D.Relationships between sensitivities to chilling and high light and unsaturation of thylakoid membrane lipids in indica and japonica rice (OryzasativaL.) [J].Acta Botanica Scinca,2002,44(2):139-146.
[22] Demmig-Adams B,Adams W W III.Photoprotection and other responses of plants to high light stress[J].Annual Review of Plant Physiology and Plant Molecular Biology,1992,43:599-626.
[23] 李天来,刘玉凤,宋礼毓.夜间亚低温处理及其恢复对番茄叶片光抑制的影响[J].园艺学报,2008,35(7):1003-1010.
[24] Shizue M,Wah S C.Populations of photoinactivated photosystem II reaction centers characterized by chlorophyll a fluorescence lifetime in vivo[J].National Acad Sciences,2004,101(52):18234-18239.
[25] 许大全,张玉忠,张荣铣,等.植物光合作用的光抑制[J].植物生理学通讯,1992,28(4):237-243.
Effectsoflightintensityandtemperatureonchlorophyllfluorescenceinleavesofbasilseedlings
TIAN Ye, ZHENG Gui-ying, ZHANG Hui-hui, XU Nan, WANG Juan, SUN Guang-yu
(College of Life Science, Northeast Forest University, Harbin 150040, China)
In this paper, takingOcimumbasilicum‘purple ruffles’ andO.cimungratissimumseedlings at different anthocyanin contents in leaves of two varieties as test material, effects of anthocyanin in leaves on chlorophyll fluorescence and light energy distribution in leaves ofO.basilicumseedlings exposed to low (200 μmol·m-2·s-1) and high (1 000 μmol·m-2·s-1) light intensity after low temperature at 4 ℃ in dark for 3 hours were studied. The results showed that fluorescence parameters in leaves ofO.gratissimumseedlings at low temperature were essentially unchanged under low light. The quantum yield of photochemistry (YPSⅡ) in leaves ofO.basilicum‘purple ruffles’ seedlings under low light after low temperature was lower than that under high light. However, the quantum yield of trans-thylakoid pH gradient and xanthophyll-regulated thermal energy dissipation (YNPQ) was higher than that of high light. It indicated that responses ofO.basilicum‘purple ruffles’ andO.gratissimumseedlings to low light were different. The low light was beneficial to promote recovery in leaves ofO.gratissimumseedlings after releasing low temperature stress, and low light led toO.basilicum‘purple ruffles’ seedlings to extend recovery time from low temperature. The Fv/Fmin leaves ofO.gratissimumseedlings was decreased under high light after low temperature, and photoinhibition in leaves ofO.gratissimumseedlings was occurred. Photoinhibition in leaves ofO.basilicum‘purple ruffles’ seedlings was not occurred under high light because of the high content of anthocyanins in leaves, which played the role of the light attenuation and filtration. The high light decreased of YPSⅡand increased quantum yield of thermal dissipation associated with the presence of non-functional PSⅡ (YNF) in leaves ofO.gratissimumseedlings after low temperature, while high light resulted in the increase of YPSⅡand the decrease of YNPQin leaves ofO.basilicum‘purple ruffles’ seedlings after low temperature pretreatment. It concluded that anthocyanin in leaves ofO.basilicum‘purple ruffles’ played a role in plant photoprotective mechanisms.
anthocyanin; low temperature; chlorophyll fluorescence; photoinhibition
SUN Guang-yu E-mail:sungy@vip.sina.com
Q945.11
A
1001-0629(2013)10-1561-08
2013-01-29 接受日期:2013-03-20
国家科技支撑项目(2011BAD08B02-3);国家自然科学基金面上项目(31070307、30771746);黑龙江省自然科学基金重点项目(ZD201105) 作者简介:田野(1988-),女,辽宁兴城人,在读硕士生,主要从事植物生理生态学研究。E-mail:2012tianye@gmail.com
孙广玉(1963-),男,黑龙江巴彦人,教授,博导,主要从事植物生理生态学研究。E-mail:sungy@vip.sina.com
