1-(2-芳氧基吡啶-3-甲酰基)-2-羧基四氢吡咯的合成研究
2013-12-01仝浩胜刘永鹏左双全
仝浩胜,刘永鹏,杨 慧,左双全
叶 茂,彭龙斌,龚银香 (长江大学化学与环境工程学院,湖北 荆州434023)
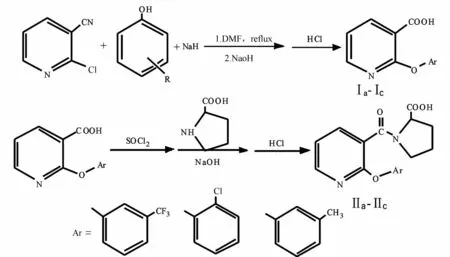
类胡萝卜素生物合成需要多种酶的参与。类胡萝卜素生物合成抑制剂通过抑制这些酶而起到杀死植物的作用。经类胡萝卜素生物合成抑制剂处理后的植物最明显的症状是产生白化叶片。目前,研究最为透彻的作用点是八氢番茄红素去饱和酶 (phytoene desaturase,PD酶)[1-5]。吡氟酰草胺 (diflufenican)是已商品化的除草剂,其以PD酶为靶标,非竞争性地抑制PD酶,从而导致植株内的八氢番茄红素大量积累,植物死亡[6-7]。以类胡萝卜素生物合成为作用点,确保了动植物之间的选择毒性,具有高效、低毒的特点,成为新型除草剂开发的热点。下面,笔者以吡氟酰草胺为先导化合物,在芳氧烟酰基结构上引入氨基酸结构,希望因此而增加药物在植物体内的传导能力,从而获得性能更为优异的除草剂候选品种。研究合成了3个未见文献报道的含取代氨基酸的芳氧烟酰胺类化合物,其合成路线如下:
1 试验部分
1.1 仪器与试剂
美国Brucker AV 300型核磁共振仪 (TMS为内标,CDCl3为溶剂);美国NICOLET670FTIR锗镜面红外光谱仪;WRS-1A/B熔点仪;3氰基-2-氯吡啶 (工业品,购自青州市奥星化工有限公司,未纯化);NaH (60%);其他所用药品均为分析纯或化学纯。
1.2 芳氧烟酸的合成
在100ml干燥三口烧瓶中加入45ml DMF,再将2.4g(60%,0.06mol)NaH加入到烧瓶中,搅拌成均相。再分次将6.0ml(0.05mol)间三氟甲基苯酚缓慢地加入烧瓶,有气泡生成,搅拌均匀后再加入7.0g(0.05mol)的3-氰基-2-氯吡啶,在90~100℃反应4h。停止加热,冷却后加入200ml水,有大量白色絮状固体生成,搅拌30min后静置,抽滤,水洗干燥得8.4g 2-间三氟甲基苯氧基烟腈,产率为64%。
称取5.3g(0.02mol)上述制备的2-间三氟甲基苯氧基烟腈放入100ml三口烧瓶中,同时加入20ml浓度为2mol/L NaOH溶液,加热回流4h,停止反应,冷却旋转脱溶,用盐酸酸化到pH=2~3,且无更多沉淀生成为止。抽滤,水洗,得白色固体,用乙醇重结晶得纯品Ⅰa,熔点164~166℃,收率88%,备用。
用类似的方法制备其他芳氧烟酸Ⅰb和Ⅰc,其熔点分别为158~160℃和155~157℃。
1.3 氨基酸的碱化
将0.012mol脯氨酸置于50ml圆底烧瓶中,加入5ml二氯甲烷,再加入0.03mol/L NaOH溶液,至pH=9~10,搅拌0.5h,待用。
1.4 目标化合物的合成
将2.8g(0.01mol)芳氧基烟酸置于干燥的50ml圆底烧瓶中,加入20ml二氯亚砜,电磁搅拌回流2h,减压蒸出过量的二氯亚砜,得淡黄色芳氧基烟酰氯固体。芳氧基烟酰氯固体不经纯化,直接用20ml二氯甲烷溶解,备用。将酰氯以1~2滴/s的速度滴加到已碱化的氨基酸溶液中,先常温搅拌30min,再加热回流1h,反应过程中,不断补加稀氢氧化钠溶液,始终保持体系的pH=9~10。反应毕,再将溶液用盐酸酸化到pH=2~3,析出大量黄色絮状物。减压抽滤,水洗粗产品,再用乙醇/水重结晶,得芳氧烟酰胺纯品Ⅱa。同法制得目标化合物Ⅱb和Ⅱc。目标化合物可溶于乙醇、DMF及乙酸乙酯等有机溶剂中。

表1 目标化合物的理化常数
目标化合物的物理性质见表1,红外及核磁共振氢谱见表2和表3。

表2 目标化合物的IR测试数据

表3 目标化合物的1 HNMR数据
2 结果与讨论
2.1 目标化合物的波谱分析
目标化合物的红外谱图中,特征基团均有明显吸收。1611~1630cm-1之间的强吸收峰是酰胺键中CO的伸缩振动吸收峰,该CO因为与吡啶环相连而使吸收峰向低波数方向移动。羧基中CO的伸缩振动吸收峰在1710~1734cm-1之间,而其O—H在3050cm-1附近 (2954~2986)呈现出一宽而散的吸收峰。1420cm-1附近 (1412~1423)出现的强峰为吡啶环的特征吸收峰。芳氧基中醚键的伸缩振动吸收频率在1235~1262cm-1之间。
核磁共振氢谱中,吡啶环上各氢原子的共振吸收位于低场。而对于四氢吡咯环1号位连有氮原子和羧基的次甲基因为诱导效应的影响,其氢原子的共振吸收向低场移动,其他2、3、4号位的氢也都有不同程度的向低场位移。羧基结构中的活泼氢在1HNMR谱图中未见明显吸收峰,这可能是因为形成分子内或分子间的氢键使氢原子位置不确定的缘故。这种情况与有关文献的报道一致[8-9]。
2.2 关于中间体芳氧烟酸的制备
笔者曾参照文献 [10],以2-氯烟酸和酚为原料,在DMF作溶剂,碱性条件下合成芳氧基烟酸。但该反应中因羧基负离子吸电子能力不强,且苯氧负离子有较大的空间位阻,在吡啶环的2号位上进行亲核取代反应时较困难。而且,该反应的反应温度高,反应时间长,反应产率也较低。经过反复摸索和讨论后,制定出优化的试验方案:用NaH将酚碱化,再与3-氰-2-氯吡啶反应,首先制得2-芳氧基-3-氰吡啶,再在碱性条件下水解、盐酸酸化制得芳氧烟酸。由于—CN的吸电子能力较强,芳氧基引入吡啶环较容易,这样,尽管多了水解步骤,但实际上反应时间缩短,反应产率也大大提高。
2.3 关于目标化合物的合成条件的讨论
采用中间体芳氧基酰氯与氨基酸通过酰基化反应合成目标化合物。氨基酸的氨基和羧基都能与酰基作用。但氨基的酰基化反应活性高于羧基,故反应主要生成目标化合物芳氧基酰胺。碱性有利于提高氨基的反应活性,但碱化不能过度,否则可能因为OH-浓度过高而使酰氯副反应程度增大。故碱化时pH值选择9~10。酰基化反应时间不宜过长,否则可能导致氨基酸中羧基的酯化反应比率提高,副产物也会增多。
