Tektins基因与雄性动物生殖功能
2013-12-01吴秋晗鞠志花唐国红黄金明王长法
吴秋晗,鞠志花,唐国红,黄金明,尹 苗,王长法*
(1.山东师范大学 生命科学学院,山东 济南 250014; 2.山东省农业科学院 奶牛研究中心,山东 济南 250100)
精子在雌性生殖道内运动并最终与卵细胞结合完成受精,主要依靠精子鞭毛的摆动,所以结构完整的鞭毛对于精子穿过宫颈粘液,到达受精部位,穿透放射冠和透明带、进入卵细胞最终完成受精的全过程至关重要。如精子鞭毛结构和功能发生异常,则会导致精子运动障碍和雄性不育。Tektins是一个高度保守的富含coiled-coil 结构域的微管蛋白家族,目前发现5个Tektins (简称TEKT)家族成员,即 TEKT1~TEKT5,主要参与精子鞭毛轴丝和其附件结构的构成,对精子的运动具有重要作用。因此,Tektins家族与雄性哺乳动物的生殖功能密切相关。本文重点介绍了Tektins家族成员、精子鞭毛的超微结构和运动方式以及该家族成员在雄性动物生殖方面的生物学功能。
1 精子鞭毛
精子鞭毛是精子细胞在附睾分化成熟过程中形成的,主要由鞭毛轴丝、外周致密纤维和线粒体鞘等组成,是精子的主要组成部分。大多数哺乳动物精子显示两种类型的生理活性:(1) 新鲜的精子为活化态。活化精子的鞭毛产生一个对称的低振幅波形,驱动精子在相对无粘性的介质如精浆中直线前进。(2) 从受精位置获得的大多数的精子为运动性超活化态[1]。在精子到达输卵管后,鞭毛的拍击模式转变成不对称的高振幅波形[2],即超活化状态。超活化的精子在粘性大的输卵管中能够直线前进到达受精位置,另外超活化精子能够帮助精子穿透进入卵细胞。
1.1 精子鞭毛的结构
精子鞭毛是由一个典型的9×2+2鞭毛轴丝,两个同形结晶的线粒体衍生物,两个附体和一个非结晶体组成。精子的鞭毛分为连接段(颈段Connecting piece)、中段(Midpiece)、主段(Principal piece)和末段(End piece), 见图1[3]。精子鞭毛的连接段将精子的鞭毛植入到头部陷窝中,是整个精子鞭毛结构中最短的一部分;鞭毛中段大致占鞭毛长度的1/4到1/3,是从远端中心粒到终环(annulus)的部分,位于颈段与主段之间。中段由鞭毛轴丝、围绕在鞭毛轴丝外面的外致密纤维(ODFs)和围绕在ODFs外的线粒体鞘以及包绕在外面的质膜(PM)构成。ODF使得中段和主段紧密连接,延伸贯穿中段和主段,而线粒体鞘是中段独有的,终环标志中段的结束和主段的开始;鞭毛主段从终环开始,由鞭毛轴丝、纤维鞘和质膜构成,最大的特征是没有线粒体鞘(MS),大约占鞭毛总长的2/3,是精子鞭毛最长的一段。其中ODF3和ODF8被两个纵列的纤维鞘(FS)取代,因此ODFs从9个减少到7个,FS贯穿整个主段,FS与轴丝双联体微管毗邻并形成突起,这两个纵向的纤维鞘通过横向肋骨(TR)连接,环向肋条围绕ODFs,起到稳定作用。FS是主段特有的结构,因为主段接近尾部,所以ODFs和FS逐渐减少,最终结束;鞭毛末段只有质膜(PM)包着鞭毛轴丝,起始处有少许的纤维鞘,随着纤维鞘逐渐的变细,最后直至消失[4]。

图1 哺乳动物精子和精子鞭毛的横截面结构示意图Fig. 1 Schematic representation of a mammalian sperm and the ultrastructure of the flagellum
1.1.1 鞭毛轴丝 鞭毛轴丝由中央的一对中央微管 (CP)、九个围绕着CP的二联体微管(双微管)和径向辐射轴(RS)构成(图2)。鞭毛轴丝复合体呈“9+2”型,外围是9束二联体微管,每一对微管分为两种类型,(A)型:连接有辐射轴RS,具有两条明显的动力臂——外动力蛋白臂ODA和内动力蛋白臂IDA;(B)型:无动力臂,电子致密度明显低于A型微管[5]。
1.1.2 外周致密纤维ODFs ODFs由围绕在鞭毛轴丝外侧的九个纤维组成,延伸贯穿中段和主段。在中段线粒体鞘围绕着ODFs,在主段FS代替ODF3和ODF8。原始哺乳动物的精子鞭毛缺乏ODFs,ODFs在种系发生过程中的出现与体内受精的出现趋势一致,推测ODFs是为了克服精子在雌性生殖道内的运动阻力进化来的[6]。ODFs 增加了精子尾部的抗张强度,改进了尾部的偏转角度矩即摆动力矩[7],这样可以免除精子鞭毛在附睾运输和射精过程中受到的剪切力损伤[8]。
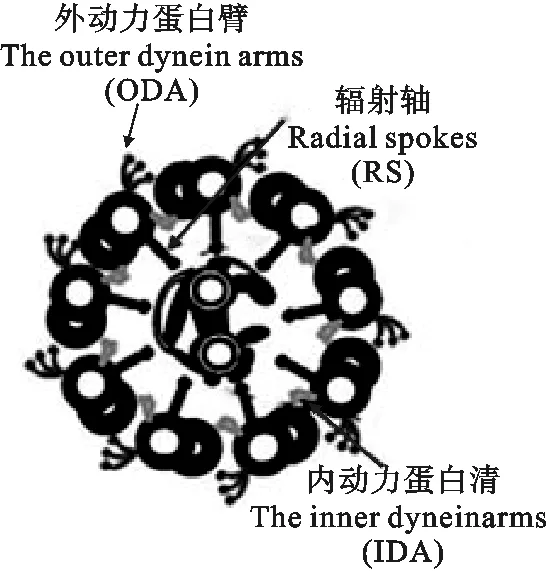
图2 鞭毛轴丝横截面Fig. 2 Transverse section of flagellar axoneme
1.1.3 线粒体鞘 线粒体鞘只存在于鞭毛中段。精子的线粒体通过有氧呼吸产生ATP。鞭毛动力蛋白作为鞭毛活力的能量来源对ATP的要求很高。通过计算精子ATP的扩散系数、统计精子鞭毛的形态及建立数学模型发现:中段线粒体有氧呼吸产生的ATP不能满足整个精子鞭毛动力蛋白的ATP需求[9]。精子线粒体氧化磷酸化缺陷仍然会出现精子受精,说明依然有ATP产生,尽管量较少,且精子仍然存在运动性[10],人们推测线粒体氧化磷酸化不是支持鞭毛摆动的ATP的唯一来源。
1.1.4 纤维鞘 ODFs和FS为鞭毛的平面摆动提供结构支持[11],两个纵列的FS通过圆周肋骨连接,形成一个“工字梁”式的结构,鞭毛轴丝微管可以沿着其滑动;除了它的结构支撑作用,FS在调节精子运动方面还扮演着重要的角色,越来越多定位于FS的蛋白质参与与鞭毛运动相关的信号通路和新陈代谢[12];精子发生过程中特有的位于FS的谷胱甘肽转移酶可以中和细胞氧化毒性物质,抑制引起精子运动性障碍和DNA损伤的氧化应激[13]。精子鞭毛最重要的ATP供应是沿着主段的糖酵解产生,而不是中段的氧化磷酸化。在越来越多的哺乳类动物精子鞭毛的主段FS,发现存在己糖激酶、乳酸脱氢酶和甘油醛-3-磷酸脱氢酶(GAPD-S)[14]等一些糖酵解酶,因而推测糖酵解是精子鞭毛的主要代谢途径。精子的超活化需要糖酵解产生的ATP[15],因此主段的糖酵解是精子鞭毛运动所必需的。
1.2 精子鞭毛的运动
双联体微管外侧包绕着动力蛋白臂、动力蛋白调控复合物、连接蛋白和辐射轴等大分子复合物。动力蛋白臂是精子鞭毛运动的分子马达,动力蛋白调节复合物调节动力蛋白的活性,辐射轴与中央微管一起调节轴丝的鞭打样运动。
当动力蛋白臂磷酸化,动力蛋白ATP酶激活,ATP水解释放出能量,动力蛋白臂瞬间作用于它们邻近的微管并产生一个冲力,引起该微管滑过另一根微管[16],鞭毛轴丝固定在精子头部,这个滑动的力量导致鞭毛弯曲。动力蛋白通过钙调蛋白依赖性蛋白磷酸酶的脱磷酸化又可以逆转这个过程。动力蛋白产生的是一个单向力,因此,正常的鞭毛弯曲摆动需要整个鞭毛轴丝的动力蛋白蛋白臂激活(动力蛋白磷酸化)和失活(动力蛋白去磷酸化)以异步的方式发生[5]。每一动力蛋白臂作用于它相邻的微管,使微管弯曲,然后再释放,微管又可以回到它最初的位置,然后再次向相反的方向弯曲,完成摆动运动。另外,精子鞭毛主段的第三和第八条ODF被FS取代,FS与轴丝二联体微管毗邻并形成突起,使精子尾部截面呈卵圆形,精子鞭毛做垂直于背腹轴(卵圆形长轴)所在平面的左右摆动运动。
2 Tektins家族成员及其生物学功能
Tektins家族存在于家蚕、老鼠和人类等多种动物体内。最初从紫色海胆精子鞭毛分离出Tektins,海胆的Tektins显示为高度卷曲的螺旋分子,是不溶的螺旋丝状蛋白。海胆体内仅鉴定出3种tektins蛋白,杂聚蛋白原纤维(TektinA and TektinB)和二聚体 (Tektin C)是纤毛和鞭毛轴丝双微管的结构成分。
从进化角度上说,Tektins是保守的鞭毛纤维蛋白,是纤毛、鞭毛、基体和中心粒微管的构成蛋白。研究者发现这个家族有TEKT 1、TEKT 2、TEKT 3、TEKT 4和TEKT 5等5个成员[17],每个Tektin成员在鞭毛的结构、稳定性和游动性等方面有各自特异的分布和功能,参与不同的生物学功能。
2.1 Tektin 1 的发现及其生物学功能
TEKT 1是在哺乳动物中第一个被鉴定的Tektin家族成员,分布在嗅觉上皮纤毛轴外面。TEKT 1蛋白存在于圆形精细胞的中心体中,在精子形成开始时消失。有研究认为TEKT 1 通过与中心体蛋白相互作用参与鞭毛轴丝微管的成核作用,可能是组装位于纤毛和鞭毛基部的基体[18]。通过构建TEKT 1缺陷小鼠来研究这个蛋白,目前仍没搞清其真正的功能。
2.2 Tektin 2的发现及其生物学功能
TEKT 2表达于精子的尾部,有报道称TEKT 2分布于人类精子鞭毛的主段,而在中段和尾端没有检测到[19]。TEKT 2定位于老鼠和人的鞭毛轴丝的外环包衣。TEKT 2的敲除实验证明鞭毛轴丝缺少动力蛋白臂,阻碍鞭毛运动从而导致不育。此外发现TEKT 2缺乏的无论雌性小鼠还是雄性小鼠都会发生呼吸纤毛缺陷,推测其缺乏导致纤毛轴功能紊乱[20]。近来的研究发现人TEKT 2的单核苷酸多态性可能对精子的运动性、亚显微结构和生理学功能等有影响。
2.3 Tektin 3的生物学功能
TEKT 3是雄性老鼠精子细胞含量较丰富的一种蛋白,主要表达于睾丸精母细胞粗线期和圆形精子细胞。TEKT 3可能通过影响精子的亚显微结构调控精子的运动性,TEKT3可能与在90°和180°之间不规则的鞭毛弯曲度相关,TEKT3失活的雄性老鼠产生的精子运动性减少47.2%, 30%~50%的精子有典型的结构缺陷,弯曲缺陷程度增加。TEKT3缺失的雄性小鼠其精子前进的运动能力减弱,但精子数量和生殖生理方面无明显影响。TEKT 3基因分布在老鼠11号染色体上,靠近TEKT 1基因,很可能是基因倍增产物[21]。
2.4 Tektin 4的定位及其生物学功能
TEKT 4是精细胞中含量丰富的蛋白,TEKT 4的缺失能引起弱精子症。TEKT 4缺失的精子鞭毛能量利用低效甚至无效,ATP消耗过多,前进的运动能力较弱,雄性生育能力显著降低。TEKT 4敲除小鼠由于能量的无效利用导致精子活力减弱,如同时敲除TEKT 3,则可能产生的精子既有结构缺陷又有鞭毛能量利用低效,双重叠加导致潜在的生育能力降低。然而,TEKT 3和TEKT 4 的双重敲除小鼠仍可以产生后代,显示其他的Tektin家族成员比如TEKT1、TEKT2 和TEKT5可能部分地提供了额外的服务,弥补TEKT 3和TEKT 4 的缺失引起的功能缺陷[22]。
免疫电镜镜检法证明TEKT 4 分布在精子鞭毛的ODFs的远轴凸面表面,没有与纤毛轴微管结合,推测TEKT 4可能与ODFs的稳定性和弹性有关。对牛的研究发现,TEKT4 在不同等电点(PI)表达模式不同,影响精子的运动,导致雄性生育能力明显改变[23]。
2.5 Tektin 5的定位和生物学功能
在出生5周后的老鼠精子尾部能检测到TEKT5的表达,在粗线期精母细胞时期表达量很低,在精子形成时即鞭毛产生时表达量增加6~7倍[24]。TEKT 5 mRNA只存在于睾丸和大脑中,定量RT-PCR显示TEKT 5 mRNA在睾丸的表达量比大脑中高6.8倍。鞭毛附件结构的蛋白组学研究证实大鼠TEKT5是一个62730 Da的蛋白,具有长羧基端。荧光免疫检测发现TEKT5在鞭毛的附件结构中分布较多,另TEKT5的表达方式说明其在精子鞭毛形成过程中具有重要作用。对TEKT 5 cDNA的鉴定表明:在精子中有TEKT 5 mRNA和蛋白的表达,并且确定TEKT 5贯穿精子鞭毛的中段和主段[23]。大鼠TEKT5分布在精子鞭毛中段线粒体鞘内表面[25],TEKT5的N端较长。与其他的Tektins成员相比,TEKT5一个显著的特征就是它有长长的C端尾巴,富含甘氨酸(22.2%)、丝氨酸(19.4%)、 丙氨酸 (13.9%)、半胱氨酸 (12.5%)和脯氨酸(9.7%),由超过70个的额外氨基酸组成,氨基酸序列很奇特,包含多个重复的多肽C-[GSK]-G-[GSPH]-A-[SLP]。这个区域的生物学意义可能是:可形成多个二硫键,与其他蛋白的酸性区域相互作用。巧合的是,小鼠精子鞭毛的外致密纤维蛋白富含半胱氨酸(高达11%~12%)和脯氨酸。ODF1的C端包含一个Cys-Gly-Pro重复序列,而ODF1介导鞭毛轴丝和外致密纤维相互作用,所以推断这个C末端的延伸对于外致密纤维与鞭毛轴丝的联系很重要。
3 Tektins与生殖性能的关联
迄今为止,啮齿动物的5个Tektin基因都已经克隆出来。老鼠TEKT1在圆精细胞中心体出现和精子形成时逐渐消失[18],TEKT1 的功能还不太清楚。人类TEKT2 也叫Tektin-t,出现在精子鞭毛主段[20],破坏老鼠该基因会引起动力蛋白臂功能损伤而导致雄性不育。TEKT3在老鼠精子的分布不太清楚,但是TEKT3缺陷的老鼠精子前进活力减少,推测TEKT3可能通过精子鞭毛的超微结构调节精子的运动。老鼠TEKT4定位于中段和主段的外致密纤维,敲除TEKT 4基因导致鞭毛鞭打运动的不协调和ATP的高消耗从而引起精子前进性运动能力大幅减小[21]。在牛中,TEKT4的不同表达模式也影响精子鞭毛的运动能力。老鼠的TEKT5分布在线粒体和外致密纤维之间[25],功能方面的研究还没有确切报道。很显然,Tektins与精子的形成、鞭毛超微结构以及精子运动的调节等密切相关,Tektins的功能障碍能严重损害精子的运动性,导致雄性不育。
综上所述,Tektins的相关研究报道还很少,确切的生物学功能还不是很清楚。然而,Tektins蛋白家族与精子鞭毛的结构和功能密切相关,影响精子的运动性。因而,对Tektins蛋白家族在精子鞭毛的结构和调节精子运动相关的信号通路中的生物学功能以及分子表达机制等的研究可为雄性不育的研究和治疗、高繁殖力动物优良品种的选育等提供宝贵的理论依据。
参考文献:
[1] Suárez S S, Osman R A. Initiation of hyperactivated flagellar bending in mouse sperm within the female reproductive tract[J]. Biol Reprod, 1987, 36(5): 1 191-1 198.
[2] Sumio I, Teruaki I, Shiari N, et al. Motor apparatus in human spermatozoa that lack central pair microtubules[J]. Mol Reprod Dev, 2002, 63(4): 459-463.
[3] Turner R M. Moving to the beat: a review of mammalian sperm motility regulation[J]. Reprod Fert Develop, 2006, 18(1-2):25-38.
[4] Ho H C, Suarez S S. An inositol 1,4,5-trisphosphate receptor-gated intracellular Ca2+ store is involved in regulating sperm hyperactivated motility[J]. Biol Reprod, 2001, 65(5): 1 606-1 615.
[5] Wargo M J, Smith E F. Asymmetry of the central apparatus defines the location of active microtubule sliding in Chlamydomonas flagella[J]. Proc Natl Acad Sci U S A,2003,100(1):137-142.
[6] Fawcett D W, Ito S. The fine structure of bat spermatozoa. Am J Anat ,1965,116(3): 567-609.
[7] Lindemann C B. Functional significance of the outer dense fibers of mammalian sperm examined by computer simulations with the geometric clutch model[J]. Cell Motil Cytoskeleton, 1996, 34(4): 258-270.
[8] Baltz J M, Williams P O, Cone R A. Dense fibers protect mammalian sperm against damage[J]. Biol Reprod , 1990, 43(3): 485-491.
[9] Du J, Tao J , Kleinhans F W, et al.Water volume and osmotic behaviour of mouse spermatozoa determined by electron paramagnetic resonance[J]. J Reprod Fertil, 1994,101(1): 37-42.
[10] Narisawa S, Hecht N B, Goldberg E ,et al. Testis-specific cytochrome c-null mice produce functional sperm but undergo early testicular atrophy[J]. Mol Cell Biol, 2002, 22(15): 5 554-5 562.
[11] Lindemann C B , Orlando A , Kanous K S. The flagellar beat of rat sperm is organized by the interaction of two functionally distinct populations of dynein bridges with a stable central axonemal partition [J]. J Cell Sci, 1992, 102 (2): 249-260.
[12] Carr D W, Fujita A, Stentz C L , et al. Identification of sperm-specific proteins that interact with A-kinase anchoring proteins in a manner similar to the type II regulatory subunit of PKA[J]. J Biol Chem, 2001, 276(20): 17 332-17 338.
[13] Fulcher K D , Welch J E , Klapper D G , et al. Identification of a unique mu-class glutathione S-transferase in mouse spermatogenic cells[J]. Mol Reprod, 1995, 42(4): 415-424.
[14] Travis A J , Foster J A , Rosenbaum N A ,et al. Targeting of a germ cell-specific type 1 hexokinase lacking a porin-binding domain to the mitochondria as well as to the head and fibrous sheath of murine spermatozoa[J]. Mol Biol Cell, 1998, 9(2): 263-276.
[15] Urner F, Sakkas D. Glucose participates in sperm-oocyte fusion in the mouse[J]. Biol Reprod, 1996, 55(4): 917-922.
[16] Brokaw C J. Direct measurements of sliding between outer doublet microtubules in swimming sperm flagella[J]. Science,1989, 243(4898): 1 593-1 596.
[17] Cao W, Gerton G L, Moss S B. Proteomic profiling of accessory structures from the mouse sperm flagellum [J]. Mol Cell Proteomics, 2006, 5(5): 801-810.
[18] Larsson M, Norrander J, Graslund S,et al. The spatial and temporal expression of Tekt1, a mouse tektin C homologue, during spermatogenesis suggest that it is involved in the development of the sperm tail basal body and axoneme[J]. Eur J Cell Biol,2000, 79(10): 718-725.
[19] Wolkowicz M J, Naaby-Hansen S, Gamble A R, et al. Tektin B1 demonstrates flagellar localization in human sperm[J]. Biol Reprod, 2002, 66(1): 241-250.
[20] Tanaka H, Iguchi N, Toyama Y, et al. Mice deficient in the axonemal protein Tektin-texhibit male infertility and immotile-cilium syndrome due to impaired inner arm dynein function[J]. Mol Cell Biol, 2004, 24(18): 7 958-7 964.
[21] Roy A, Lin Y N, Agno J E, et al. Tektin 3 is required for progressive sperm motility in mice[J]. Mol Reprod , 2009 ,76(5): 453-459.
[22] Iida H, Honda Y, Matsuyama T, et al. Tektin-4 is located on outer dense fibers, not associated with axonemal tubulins of flagella in rodent spermatozoa[J]. Mol Reprod , 2006, 73(7): 929-936.
[23] Thepparat T, Katawatin S, Vongpralub T, et al. Separation of bovine spermatozoa proteins using 2D-PAGE revealed the relationship between tektin-4 expression patterns and spermatozoa motility[J]. Theriogenology ,2012, 77(9): 1 816-1 821.
[24] Cao W L, Ijiri T W, Huang A P, et al. Characterization of a novel tektin member, TEKT5, in mouse sperm journal of andrology[J]. J Androl, 2011, 32(1): 55-69.
[25] Murayama E, Yamamoto E, Kaneko T, et al. Tektin5, a new Tektin family member, is a component of the middle piece of flagella in rat spermatozoa[J]. Mol Reprod, 2008, 75(4): 650-658.
