治疗性抗体高表达CHO细胞株构建策略
2013-12-01李浩强蔡洁行张玉彬
李浩强,蔡洁行,张玉彬
单克隆抗体(MAbs)具有高度的特异性,因而被大量用于各种疾病尤其是癌症和自身免疫性疾病的治疗。2009年,包含生物抗体药物在内的重组蛋白获得了 990 亿美元的市场销售额[1],最突出的重磅炸弹级药物包括:美罗华利妥昔单抗(rituximab,美国 Genentech和Biogen Idec公司研制)、赫赛汀曲妥珠单抗(trastuzumab,美国 Genentech公司研制)、阿伐斯汀贝伐单抗(bevacizumab,美国 Genentech公司研制)、艾比特思西妥昔单抗(cetuximab,美国 ImClone公司和Bristol-Myers Squibb公司研制)和修美乐阿达木单抗(adalimumab,美国 Cambridge 抗体公司和Abbott公司研制)等。表1 为2011年部分单克隆抗体药物的全球销售情况[2]。以上抗体均由大规模培养的经过基因改造的宿主细胞(host cell)来生产表达。对于治疗性抗体而言,为了满足其生物活性,需要进行正确的折叠和翻译后修饰,因此用于生产治疗性抗体的宿主细胞往往是哺乳动物细胞,主要包括:Sp2/0 骨髓瘤细胞、NS0 小鼠骨髓瘤细胞、HEK293人胚胎肾细胞和中国仓鼠卵巢细胞(Chinese hamster ovary,CHO),其中以 CHO 细胞用途最为广泛。
1 CHO 细胞
目前,70% 以上的抗体蛋白是由 CHO 细胞生产的[3]。用于治疗性抗体表达的CHO 细胞是 1957年由 Tjio和Puck[4]将原代培养的中国仓鼠卵巢细胞永生化获得的,其中包括 DUXB11、DG44和CHOK1 细胞株。其中,DUXB11和DG44 细胞不具有二氢叶酸还原酶(dihydrofolate reductase,DHFR)活性,需要甘氨酸、次黄嘌呤和胸腺嘧啶(glycine、hypoxanthine and thymidine,GHT)作为生长补充原料,而 CHOK1 则相反。虽然 CHO 细胞最初是为了便于体外的基础生物医学研究而不是为了用于重组蛋白表达,但 DHFR 缺陷的CHO 细胞易于制作稳定的转基因细胞株。采用外源 DHFR 与目的基因共转染,通过去掉GHT的培养基可以筛选到稳定转染的细胞株,这已成为一项标准的遗传筛选方法。
对比其他哺乳动物细胞,CHO 细胞的优点主要包括:① CHO 细胞能够对蛋白进行糖基化,并且其糖型与人类基本一致;② CHO 细胞能够在生物反应器培养的过程中获得较高的细胞密度;③ CHO 细胞不易传播人类的病毒;④CHO 细胞相比其他生产用哺乳动物细胞基因组更容易进行改造和扩增;⑤ CHO 细胞与别的生产用哺乳动物细胞类似,容易进行外源基因的转染和表达;⑥ CHO 细胞已经广泛运用于蛋白的工业化生产,其转染和筛选特性已经被人们所熟知[5]。
2 表达载体的构建和转染
生产用稳定细胞株的构建首先由表达载体的构建和细胞转染开始(图 1)。将表达抗体的目的基因构建到载体上,再将该载体转染进入宿主细胞内。常见的转染方式主要有磷酸钙转染、电穿孔转染、脂质体转染和逆转录病毒转染。DNA 进入宿主细胞核后将会随机整合到宿主细胞基因组当中去,因此表达水平与基因拷贝数、基因整合位点的转录活性有关。然后,不同筛选试剂将被用于筛选能够正确表达目的基因并且高水平表达的细胞池。由于此时得到的细胞池中的每个细胞特性各异,具有不同的基因整合位点、拷贝数、细胞单产和生长速率,因此需要将其中具有高产、稳定表达特性的细胞个体分离出来分别培养,通常需要获得数百甚至上千的候选克隆供进一步筛选。被筛选出来的克隆经过传代培养和分批补料(fed-batch)实验,比较其生长特性、代谢状况、表达量高低、表达产物质量等因素,选出最优的几个克隆进入生物反应器放大实验,最终确定生产用单克隆细胞株。

表1 2011年部分单克隆抗体全球销售情况

图1 细胞株构建基本流程
人工构建的哺乳动物表达载体一般为穿梭载体,含有原核基因序列:大肠杆菌复制子及抗生素抗性基因等,这样便于载体在原核细胞中扩增和大量制备;另外含有能使外源基因在哺乳动物细胞中有效转录的启动子和增强子元件,以及终止子和PolyA 序列。为了在转染后有效地筛选出高表达的细胞,表达载体上除了包含抗体的重链、轻链以外,往往还含有各种筛选标记,不同的筛选标记一般可以被分为两大类:一类是以 G418(新霉素)为代表的抗生素类筛选标记,另一类是以甲氨蝶呤(methotrexate,MTX)为代表的影响细胞代谢的筛选标记。与此同时,高效的启动子(如 CMV[6])和延长因子(如 EF1α[7])被广泛运用于抗体表达载体。翻译的起始位置是恒定的Kozak 序列[8]:GCC GCC(A/C)CC和抗体特异性的信号肽——不同的重链、轻链类型有各自特异的信号肽序列[9]。表 2 为常用筛选标记及筛选试剂。

表2 哺乳动物表达系统常用筛选标记及筛选试剂
Life Technologies公司的PcDNA3.3/Poptivec 载体系统是常用的商业化载体系统,具有原生巨细胞病毒(CMV)启动子/增强子序列,能有效促进目的基因表达,其中PcDNA3.3 含有 G418 抗性基因,Poptivec 含有 DHFR 基因,适用于DHFR 缺陷的细胞。另外,该公司开发的PCHO1.0 载体系统包含两个不同强度的CMV 启动子、DHFR 基因和嘌呤霉素抗性基因,能够将抗体的重链和轻链构建在同一个载体上进行转染表达,适用于该公司开发的CHO-STM细胞。
为了得到稳定高产的细胞株,往往使用 MTX 或者氨基亚砜蛋氨酸(methionine sulfoximine,MSX)进行筛选扩增[10],据相关文献报道,同时使用 MTX和MSX 可以显著提高筛选的效果[11]。
MTX是 DHFR的特异性抑制剂。当宿主细胞是DHFR-,如 CHO-DG44,当转染的载体上含有 DHFR 基因时,MTX能够促使细胞增加包含 DHFR 基因和目标蛋白基因在内的基因拷贝数。通过不断增加 MTX的浓度可以逐步增加拷贝数,直到到达“瓶颈”,即随着 MTX 浓度的增加,拷贝数不发生明显改变。在载体构建的过程中,可以使用较弱的启动子来弱化 DHFR 基因的表达或者改造DHFR的基因使之不稳定,从而增加 MTX的筛选扩增效果[12]。
MSX是一种跟 MTX 类似的代谢类抑制剂,它能够特异性抑制谷氨酸合成酶(glutamine synthetase,GS)。对比DHFR 筛选系统,GS 较少用于单抗的表达生产,其主要原因是有实验表明 GS 系统较为不稳定,即随着细胞的培养时间的延长,其表达量出现了明显的下降。由于实际生产用稳定细胞株一般要求经过 12周的稳定性实验,表达量的下降应小于30%,故 DHFR 系统在生物制药工业最为广泛使用。
插入染色体的位置影响真核基因的表达,即“位置效应”。当外源基因插入异染色质及其附近区域产生位置效应时,此处异染色质区域将产生位置效应斑点,此时,周围的异染色质将有效地阻止插入基因的表达。为了克服“位置效应”,一般有两种办法:①将目的基因定点整合到合适的位点;②在目的基因的侧翼加上“绝缘子”DNA 序列,从而抑制“位置效应”。
在CHO 细胞中,含有核骨架依附区以及核基质依附区(S/MAR)的DNA 序列能够保护目的基因不被周围的染色质所影响[13]。有研究表明,S/MAR能够减少不同克隆之间表达的差异性[14-15]。同时,也有数据指出,当载体中含有 MAR 元件时,目的基因的表达量可以提高 10 倍[16]。
3 高表达细胞株的筛选
筛选高表达单克隆细胞株是细胞株构建的关键步骤,衡量标准包括抗体表达量、产品质量、代谢稳定性、细胞稳定性等。当目的基因被转染到宿主细胞内,并按照一定的细胞密度在合适的筛选压力下进行传代培养后便得到了细胞池。细胞池的表达量取决于转染的方式、筛选压力的作用以及目的基因整合情况。由于目的基因整合具有很大的随机性,即使使用相同的方法进行转染和筛选,表达量依然会体现出极大的差异性[17],接下来就要从细胞池中筛选出高产稳定的细胞株。
常用的筛选克隆的方法包括:有限稀释法(limiting dilution cloning,LDC)、流式细胞仪分选法(fluorescence activated cell sorter,FACS)、半固体培养基筛选法等。其中有限稀释法因为其低成本和易于操作,曾广泛运用于克隆的筛选。该法是将细胞稀释到极低的细胞密度,并将稀释好的细胞置于96 孔板中培养,使孔板中每个孔的理论细胞数小于1个,稀释后使用显微镜对 96 孔板整板拍照,以确保单克隆。经过一段时间的培养后使用酶联免疫吸附反应选取表达量高的细胞扩大培养。有限稀释法往往需要重复两次,以确保单克隆细胞株的纯度。由于有限稀释法实验量大、实验周期长、实验效率低,已经被逐步淘汰。现代企业常使用半固体培养基法进行单克隆的筛选[18]。细胞生长在半固体培养中,形成单克隆细胞团,同时将抗体分泌在细胞团周围,半固体培养基中含有荧光标记的二抗,能与抗体 Fc 片段特异性结合,当用一定波长的光进行激发时就能发出荧光(图 2)[19]。使用图像分析软件能够对单克隆细胞团的大小、荧光强度进行测定,从而筛选出生长旺盛、表达量高的单克隆细胞团。自动化的机械臂能够按照实验人员设定的参数将符合要求的细胞团挑取出来用于后续的扩大培养。半固体培养基法能够通过自动化的方式挑取单克隆细胞,大大减轻了实验人员的工作负担,但用于荧光扫描、图像分析和克隆挑取的机器价格昂贵,同时在半固体培养基中由单个细胞长成具有明显抗体分泌的细胞团需要 2~3周时间,耗时较长。
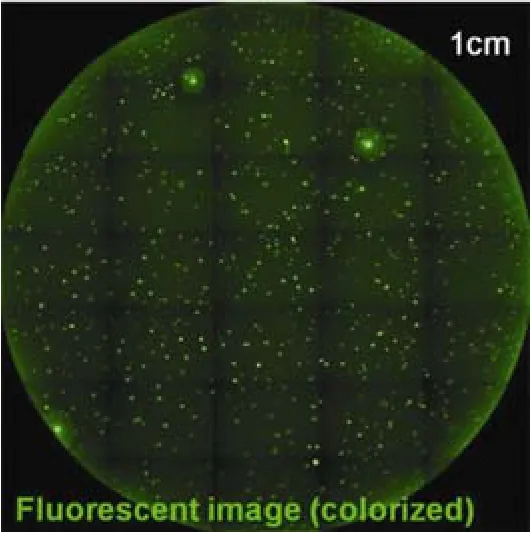
图2 半固体培养基克隆荧光
另一种开始广泛使用的方法是流式细胞仪分选法。将带有荧光标记的二抗和分泌抗体的CHO 细胞混合孵育,分泌到细胞表面的抗体就能够被流式细胞仪检测到,从而利用其分选功能筛选出分泌多的细胞[20]。为了使分泌到胞外的抗体能够维持在细胞膜表面,还可以使用微囊将细胞以及分泌的抗体包裹起来。目前,又有新的方法运用于流式细胞仪分选,即将绿色荧光蛋白(green fluorescent protein,GFP)的两个基因片段作为报告基因分别构建到抗体重链和轻链的表达载体上进行共转染[21],当这两个片段都整合到细胞内进行表达时,能够产生绿色荧光蛋白而发出绿色荧光,利用 FACS 进行分选得到高表达的细胞。使用该方法在转染完成后48 h 就能够进行检测,可以有效缩短克隆筛选的时间,提高实验效率。
4 细胞培养工艺的优化
在获得单克隆细胞株后,还需要对培养条件进行优化,以达到更高的表达量和合乎规定的产品质量。经过二十多年的发展,化学成分明确的培养基(chemically defined media,CD media)已经大规模运用于细胞培养和抗体的生产表达。常用的细胞培养基一般含有氨基酸、维生素、无机盐、糖、脂质体和生长因子等[22]。在普通的CD 培养基中细胞通常不能达到较高的细胞密度和活率,因此往往在分批补料培养过程中加入适量的非动物源的水解物[23],这些水解物由蛋白水解产生,包括氨基酸、短肽、碳水化合物、维生素和无机盐等,能够补充细胞生长和抗体表达所需的营养。
为了对基础培养基和补料进行优化,需要对细胞的代谢进行分析研究,例如通过保持较低的糖浓度来抑制乳酸的产生,降低谷氨酰胺的浓度来减少铵离子的累积。乳酸是细胞代谢中的重要代谢产物之一,一直以来人们认为高水平的乳酸含量会对细胞产生明显的毒害作用,因此大量的实验被用于降低乳酸含量或者促进细胞对乳酸的消耗。Genentech公司的科研人员尝试将丙酮酸和乳酸作为细胞培养的碳源,并使用乳酸取代 CO2来调节 pH 值,显著降低了细胞培养过程中铵离子的浓度和pCO2,而在细胞培养的过程中,其生长状况和表达量与对照组基本一致[24]。
培养基不仅影响细胞生长,还对表达的抗体的质量有着较大影响,如抗体蛋白的糖基化形式、抗体蛋白的酸碱峰分布等,实验设计(design of experiment,DOE)[25]被广泛运用,同时为了达到节省人力和时间的目的,高通量的实验方法被越来越多地采用。例如 Amgen公司的研究人员采用深孔 24 孔板,每孔可容纳 1~3ml 细胞[26]。另一种高通量筛选系统是 SimCell[27],一种由 Bioprocess公司开发的用于分批补料培养的微型生物反应器,该微型反应器能够实时检测活细胞密度、活率、pH 值和溶解氧,每个微型反应器的体积约为700 μl,可同时进行上千个实验。
当前,以 Amgen、Genentech公司为代表的生物制药巨头所使用的细胞株的蛋白表达量已达到 5~10 g/L,Pfizer、MedImmune公司的个别细胞株甚至超过了 10 g/L。因此,细胞培养的生物反应器也从过去的大型化(20 kl)向小型化(1 kl)、连续性、一次性转变。传统的不锈钢反应器在使用前需要进行彻底的清洁灭菌,而且有着更大的污染的风险,而一次性反应器可以大大节省准备的时间。带有搅拌器的袋式生物反应器,如 Hyclone公司的SUB、Sartorius公司的BIOSTAT和Xcellerex公司的XDR-DSTB,正越来越多地被运用于治疗性抗体的生产[28]。
5 结语
哺乳动物细胞培养技术的创新和相关设备的发展会不断提高哺乳动物细胞培养的效率,缩短细胞株构建的时间,更易于获得高产稳定的单克隆抗体细胞株,从而推动生物制药行业的进步。可以预见,在未来的5~10年里,产量大于10 g/L的细胞株将更多地投入到生产中去。
[1]Walsh G.Biopharmaceutical benchmarks 2010.Nat Biotechnol, 2010,28(9):917-924.
[2]La Merie Business Intelligence.TOP 30 Biologics 2011.(2012-04-26)[2013-01-27].http://www.pipelinereview.com/index.php/2012042647751/FREE-Reports/TOP-30-Biologics-2011.html.
[3]Jayapal KP, Wlaschin KF, Hu W, et al.Recombinant protein therapeutics from CHO cells-20 years and counting.Chem Eng Prog,2007, 103(10):40-47.
[4]Tjio JH, Puck TT.Genetics of somatic mammalian cells.II.Chromosomal constitution of cells in tissue culture.J Exp Med, 1958,108(2):259-268.
[5]Kelley B.Industrialization of mAb production technology: the bioprocessing industry at a crossroads.MAbs, 2009, 1(5):443-452.
[6]Boshart M, Weber F, Jahn G, et al.A very strong enhancer is located upstream of an immediate early gene of human cytomegalovirus.Cell,1985, 41(2):521-530.
[7]Running Deer J, Allison DS.High-level expression of proteins in mammalian cells using transcription regulatory sequences from the Chinese hamster EF-1 alpha gene.Biotechnol Prog, 2008, 20(3):880-889.
[8]Kozak M.Point mutations define a sequence flanking the AUG initiator codon that modules translation by eukaryotic ribosomes.Cell,1986, 44(2):283-292.
[9]V BASE database.[2013-01-27].http://www2.mrc-lmb.cam.ac.uk/vbase/list2.php.
[10]Birch JR, Racher AJ.Antibody production.Adv Drug Deliv Rev, 2006,58(5):671-685.
[11]Li F, Vijayasankaran N, Shen AY, et al.Cell culture processes for monoclonal antibody production.MAbs, 2010, 2(5): 466-479.
[12]Cacciatore JJ, Chasin LA, Leonard EF.Gene amplification and vector engineering to achieve rapid and high-level therapeutic protein production using the Dhfr-based CHO cell selection system.Biotechnol Adv, 2010, 28(6):673-681.
[13]West AG, Gaszner M, Felsenfeld G.Insulators: many functions, many mechanisms.Genes Dev, 2002, 16(3):271-288.
[14]Goetze S, Baer A, Winkelmann S, et al.Performance of genomic bordering elements at predefined genomic loci.Mol Cell Biol, 2005,25(6):2260-2272.
[15]Girod PA, Zahn-Zabal M, Mermod N.Use of the chicken lysozyme 5'matrix attachment region to generate high producer CHO cell lines.Biotechnol Bioeng, 2005, 91(1):1-11.
[16]Araki Y, Hamafuji T, Noguchi C, et al.Efficient recombinant production in mammalian cells using a novel IR/MAR gene amplification method.PLoS One, 2012, 7(7):e41787.
[17]Browne SM, Al-Rubeai M.Selection methods for high-producing mammalian cell lines.Cell Line Dev, 2009, 6:127-151.
[18]Lee CC, Ly C, Sauerwald T, et al.High-throughput screening of cell lines expressing monoclonal antibodies.Bioprocess Int, 2006, 4(Suppl 3):32-35.
[19]Genetix Clonepix.[2013-01-27].http://www.genetix.com/en/systems/clonepix/applications/index.html.
[20]BBrezinsky SC, Chiang GG, Szilvasi A, et al.A simple method for enriching populations of transfected CHO cells for cells of higher specific productivity.J Immunol Methods, 2003, 277(1-2):141-155.
[21]Kim YG, Park B, Ahn JO, et al.New cell line development for antibody-producing Chinese hamster ovary cells using split green fluorescent protein.BMC Biotechnol, 2012, 12:24.
[22]van der Valk J, Brunner D, De Smet K, et al.Optimization of chemically defined cell culture media--replacing fetal bovine serum in mammalian in vitro methods.Toxicol In Vitro, 2010, 24(4):1053-1063.
[23]Lobo-Alfonso J, Price P, Jayme D.Benefits and limitations of protein hydrolysates as components of serum-free media for animal cell culture applications.Protein Hydrolysates Biotechnol, 2010:55-78.
[24]Li J, Wong CL, Vijayasankaran N, et al.Feeding lactate for CHO cell culture processes: impact on culture metabolism and performance.Biotechnol Bioeng, 2012, 109(5):1173-1186.
[25]Hammett K, Kuchibhatla J, Hunt C, et al.Developing chemically defined media through DOE: complete optimization with increased protein production in less than 8 Months.Cell Technol Cell Products,2007, 3:683-691.
[26]Carter J, Zhang J, Dang TL, et al.Fusion partners can increase the expression of recombinant interleukins via transient transfection in 2936E cells.Protein Sci, 2010, 19(2):357-362.
[27]Amanullah A, Otero JM, Mikola M, et al.Novel micro-bioreactor high throughput technology for cell culture process development:reproducibility and scalability assessment of fed-batch CHO cultures.Biotechnol Bioeng, 2010, 106(1):57-67.
[28]Huang TK, McDonald KA.Bioreactor systems for in vitro production of foreign proteins using plant cell cultures.Biotechnol Adv, 2012,30(2):398-409.
