重组金黄色葡萄球菌肠毒素A协同增强破伤风类毒素的免疫原性研究
2013-12-01王丽婵马霄张华捷谭亚军徐颖华张庶民侯启明
王丽婵,马霄,张华捷,谭亚军,徐颖华,张庶民,侯启明
金黄色葡萄球菌肠毒素(staphylococcal enterotoxins,SEs)是金黄色葡萄球菌产生的一种外毒素,为水溶性的蛋白质,可引起食物中毒,由于其免疫激活作用极其强大,White等[1]将其定义为超抗原。超抗原与普通异种抗原不同,它不需要经过抗原递呈细胞(APC)的处理,在主要组织相容性复合体(MHC)II 类分子的作用下,只需极小剂量(10-12mol/L)就可以刺激比普通抗原多数千倍的Vβ 特异性 T 细胞增殖,并释放大量细胞因子,是一种较好的免疫调节剂和增效剂[2-3]。根据血清型的不同将金黄色葡萄球菌的肠毒素主要分为SEA、SEB、SEC1、SEC2、SEC3、SED、SEE 七种类型,其中 SEA是最常见的一种[4]。
凡能非特异地通过物理或化学的方式与抗原结合或混合,并增强抗原免疫反应性(包括细胞免疫或体液免疫)的物质均可称之为佐剂。目前常用的佐剂有铝佐剂、蛋白类佐剂、含脂类佐剂及核酸类佐剂等,其中临床应用最多、最成熟的是铝佐剂。本文的主要目的是初步探讨重组超抗原金黄色葡萄球菌肠毒素 A 作为免疫佐剂功能的可行性。如前所述,多项研究已经表明[5-6],SEA只需极小剂量即可激活大量 T 细胞,并释放多种细胞因子,刺激 T 细胞的活性,提高机体免疫水平,特别是细胞免疫水平,这些特性使其具备作为免疫佐剂的潜力。本实验室在前期超抗原抗肿瘤研究中已经证实,金黄色葡萄球菌肠毒素能够激发机体的细胞免疫反应,诱导 Th1 型细胞因子的产生[7]。本次研究主要是观察其诱导体液免疫反应的能力,用 SEA与破伤风类毒素(tetanus toxoid,TT)和Al(OH)3佐剂联合免疫小鼠,检测小鼠的体液免疫效果,初步探讨 SEA的佐剂效应。
1 材料与方法
1.1 材料
1.1.1 抗原及佐剂 破伤风类毒素由华兰生物工程股份有限公司提供;重组SEA 由本科室前期制备;Al(OH)3佐剂由北京天坛生物制品股份有限公司提供。
1.1.2 实验动物 SPF 级 NIH 小鼠 64只,14~16 g,雌雄各半,购自本院实验动物中心。饲养于SPF 级动物房。
1.1.3 主要试剂与仪器 HRP 标记的山羊抗小鼠IgG 为美国 Santa Cruz公司产品;ELISA 酶标板为美国 Costar公司产品;OPD 显色试剂为美国Ameresco公司产品;酶标仪为美国 Molecμlar Devices公司产品;其他试剂均为国产分析纯。
1.2 方法
1.2.1 动物分组及免疫 NIH 小鼠 64只,随机分成 8组,每组8只,腹部皮下免疫 0.5ml/只。实验分为两个大组,分别是破伤风类毒素高剂量组(1 lf/ml)和破伤风类毒素低剂量组(0.25 lf/ml);两个剂量的TT 分别与高(80μg/ml)、中(20μg/ml)、低(5μg/ml)3个剂量的超抗原 SEA结合,以便确定 SEA的最适剂量;各个组均与终浓度为1.5 mg/ml的Al(OH)3佐剂 4 ℃ 吸附过夜。
1.2.2 小鼠血清抗体 IgG 水平检测 动物免疫4周后,摘眼球采血,分离血清待用。利用破伤风类毒素包被,3 lf/ml,每孔 100 μl,测定免疫后小鼠血清破伤风类毒素抗体 IgG 水平。将各组小鼠免疫血清以 1∶100 起进行 2 倍倍比 8个系列稀释,标准孔以百白破联合疫苗免疫小鼠后4周血清作为对照,以 1∶400 起进行 2 倍倍比 8个系列稀释,加入已包被抗原的酶标板中,置37 ℃ 温育 1 h。洗板后,加入 HRP 标记的羊抗小鼠 IgG,37 ℃ 温育 1 h;洗板后,每孔加入显色液 100 μl,室温放置15 min;加入 2 mol/L 终止液,于30 min内测定在波长 490 nm 处的各孔 A 值。将标准对照所含的破伤风类毒素抗体含量设置为1,用SoftMax pro 软件,应用四参数、双平行线分析方法对各样品组的结果进行数据分析,计算抗体的酶标单位数。
1.3 统计学分析
应用 IBM SPSS Statistics 统计学软件对实验结果进行分析,实验数据以表示,组间比较采用单因素方差分析,以 P<0.05 为差异有统计学意义。
2 结果
2.1 TT 高剂量组小鼠血清抗体 IgG 检测结果
TT 高剂量免疫组,主要检测在TT 及Al(OH)3免疫剂量不变的条件下,不同浓度的重组超抗原 SEA 对 TT的免疫增强作用。ELISA 法检测免疫后4周的小鼠血清抗 TT 抗体水平,检测结果见表1。
由检测结果可见,与对照组相比,SEA 高剂量组及中剂量组均能显著增强 TT的免疫原性(P<0.05),且两个剂量之间没有统计学差异(P >0.05);但 SEA 低剂量组未能增强 TT 免疫原性,与对照组相比没有统计学差异(P >0.05)。
表1 TT 高剂量组免疫后小鼠血清抗 TT 抗体IgG 检测( ,n=8)Table1 Anti-TT IgG levels of immunized mice after immunization with high doses of TT groups ( , n=8)
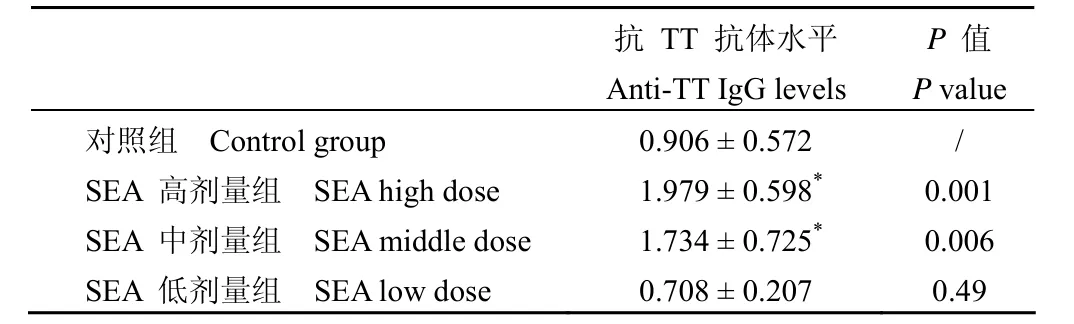
表1 TT 高剂量组免疫后小鼠血清抗 TT 抗体IgG 检测( ,n=8)Table1 Anti-TT IgG levels of immunized mice after immunization with high doses of TT groups ( , n=8)
注:*和对照组比较,P<0.05。Note: *Compared with control group, P<0.05.
对照组 Control group 0.906±0.572 /SEA 高剂量组 SEA high dose 1.979±0.598* 0.001 SEA 中剂量组 SEA middle dose 1.734±0.725* 0.006 SEA 低剂量组 SEA low dose 0.708±0.207 0.49
表2 TT 低剂量组免疫后小鼠血清抗 TT 抗体IgG 检测( ,n=8)Table2 Anti-TT IgG levels of immunized mice after immunization with low doses of TT groups ( , n=8)
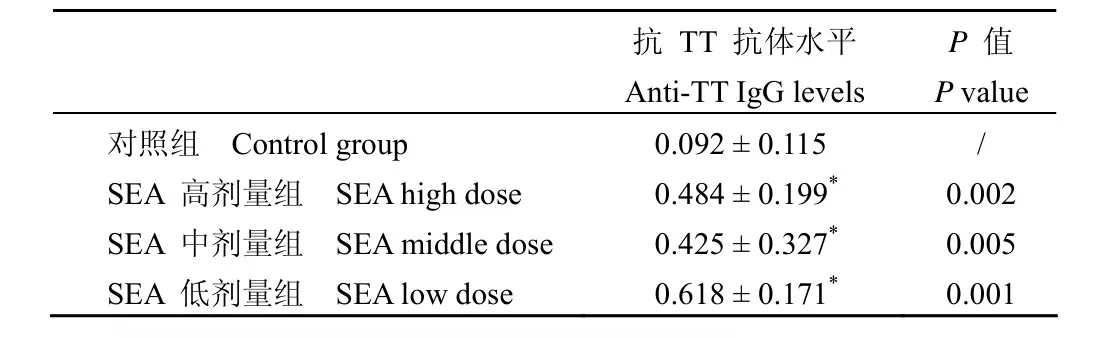
表2 TT 低剂量组免疫后小鼠血清抗 TT 抗体IgG 检测( ,n=8)Table2 Anti-TT IgG levels of immunized mice after immunization with low doses of TT groups ( , n=8)
注:*和对照组比较,P<0.05。Note: *Compared with control group, P<0.05.
抗 TT 抗体水平Anti-TT IgG levels P 值P value对照组 Control group 0.092±0.115 /SEA 高剂量组 SEA high dose 0.484±0.199* 0.002 SEA 中剂量组 SEA middle dose 0.425±0.327* 0.005 SEA 低剂量组 SEA low dose 0.618±0.171* 0.001
2.2 TT 低剂量组小鼠血清抗体 IgG 检测结果
TT 低剂量免疫组,检测在TT 及Al(OH)3免疫剂量不变的条件下,不同浓度的SEA 对低剂量TT的免疫增强作用。检测方法同上,检测结果见表2。
与对照组相比,SEA的各个剂量组均能增强低剂量 TT的免疫原性,P<0.05;且各个剂量组之间没有统计学差异,P<0.05。
结合以上两个剂量 TT的免疫结果,可得出如下结论:①无论是对照组还是样品组,高剂量 TT免疫组产生的抗体水平均高于低剂量免疫组;②对于不同剂量 SEA的免疫增强作用,在TT 高剂量组,高、中剂量的SEA 免疫协同增强作用相同,低剂量 SEA 与对照组相比未能增强 TT 免疫原性;③ TT 低剂量免疫组,3 种不同剂量的SEA 均能协同增强 TT的免疫原性,且各剂量之间没有统计学差异;④从试验结果可看出,按照免疫佐剂用量最小化原则,SEA 协同增强 TT 免疫原性的最适剂量为20μg/ml,无论是高剂量 TT组,还是低剂量 TT组,均能增强其免疫原性。
3 讨论
金黄色葡萄球菌肠毒素 A 作为一类高效免疫刺激分子,与MHC-II 类分子和TCR 具有独特的作用方式,组成三聚体复合物,进而诱导 T 细胞的大量增殖和细胞因子的释放,活化 Th1 型细胞等效应,提高机体免疫水平,尤其是细胞免疫水平。SEA 这些特性使其在肿瘤生物学治疗方面的应用日益广泛,受到国内外研究者的关注,可单独应用[8],也可与其他载体联用制备融合蛋白发挥抑瘤作用[9-11]。近来,利用超抗原特性作为免疫佐剂或免疫调节剂的研究也有所报道[12-13]。本实验室在之前的研究中证实了此类超抗原激活细胞免疫及其抗肿瘤效果[7],在本次实验中主要是观察重组SEA与TT 联合免疫后对 TT的体液免疫增强作用。
为了确定重组SEA的最适使用剂量,实验中将 TT 分高剂量组和低剂量组,每个剂量组又分别与高、中、低 3个剂量的SEA 同时与Al(OH)3吸附后免疫小鼠。体液免疫检测结果显示,在TT 高剂量组,高、中剂量的SEA 均能显著增强 TT的抗体水平,而低剂量 SEA组的检测结果在数值上却略低于对照组,但这并不能说明低剂量的SEA会干扰甚至降低 TT的免疫原性,因为两者经统计分析后并没有统计学差异。造成此种现象的潜在原因如下:首先是实验动物本身的个体差异较大,致使对同一抗原的免疫反应差异;其次是实验操作者在实验过程中可能存在误差,比如动物免疫、ELISA测定等环节。在实验条件允许的情况下,可通过加大样本量来减少或消除造成这些误差的潜在因素。在TT 低剂量组,高、中、低剂量的SEA 均能增强 TT的免疫原性,且各剂量组之间无统计学差异,但与对照组[Al(OH)3+ TT]相比均有统计学差异。以上这些结果说明对于TT 抗原来说,SEA的最适使用剂量与TT的浓度有关,TT 免疫剂量越低,SEA 对其免疫增强作用越明显,且达到同样的免疫增强效果的同时所需 SEA 剂量越小。但综合两个 TT 免疫剂量的实验结果来看,在SEA 浓度为20μg/ml,即小鼠免疫剂量为10 μg/只时,对高剂量 TT和低剂量 TT 均有较强的协同免疫增强作用,因此对 TT 来说,SEA的最适剂量为20μg/ml。本实验中只研究了重组SEA 对 TT 抗原的免疫增强作用与免疫剂量之间的关系,但是,对 TT 免疫增强作用的最适剂量并不一定适合其他种类的抗原,因此,SEA的使用剂量还需依抗原而定。
理论上,试验中应该在不同时间点取血检测抗体产生的动态水平,这样可以更全面地监测免疫后产生抗体高峰期的时间。但本研究只是对 SEA 协同增强 TT的免疫原性在抗体水平上进行初步评价,想通过增加 SEA 成分,在不影响或增加 TT保护力的同时,减少 TT的使用量。加之根据《中国药典》[14]规定,破伤风疫苗效力检测在疫苗免疫后4周进行毒素攻击,计算其保护性,因此本研究选择了免疫 4周后进行免疫效果观察。此外,本试验结果显示 TT 抗体水平在SEA的协同下显著提高。但是,是否增高的TT 抗体水平能够提高其保护性,还需要在后续实验中建立破伤风毒素攻击的动物模型进行更全面的评价。
综上所述,重组SEA和Al(OH)3佐剂联合应用可显著提高 TT 对小鼠的体液免疫效果,增强TT的免疫原性,两者联合应用具有一定的协同效应,初步证明了重组SEA 作为免疫佐剂使用的可行性,为后续超抗原佐剂的研究奠定了理论基础,同时也为其应用提供了更广阔的前景。
[1]White J, Herman A, Pullen AM, et al.The V beta-specific superantigen staphylococcal enterotoxin B: stimulation of mature T cells and clonal deletion in neonatal mice.Cell, 1989, 56(1):27-35.
[2]Fleischer B, Schrezenmeier H.T cell stimulation by staphylococcal enterotoxins.Clonally variable response and requirement for major histocompatibility complex class II molecules on accessory or target cells.J Exp Me, 1988, 167(5):1697-1707.
[3]Mehindate K, Thibodeau J, Dohlsten M, et al.Cross-linking of major histocompatibility complex class II molecules by staphylococcal enterotoxin A superantigen is a requirement for inflammatory cytokine gene expression.J Exp Med, 1995, 182(5):1573-1577.
[4]Fraser JD.High-affinity binding of staphylococcal enterotoxins A and B to HLA-DR.Nature, 1989, 339(6221):221-223.
[5]Kotb M.Superantigens of gram-positive bacteria: structure-function analyses and their implications for biological activity.Curr Opin Microbiol, 1998, 1(1):56-65.
[6]Fischer H, Dohlsten M, Andersson U, et al.Production of TNF-alpha and TNF-beta by staphylococcal enterotoxin A activated human T cells.J Immunol, 1990, 144(12):4663-4669.
[7]Wang L, Zhang H, Zhang S, et al.Construction and characterization of a novel superantigen fusion protein: bFGF/SEB.Cancer Invest, 2009,27(4):376-383.
[8]Woody MA, Krakauer T, Stiles BG.Staphylococcal enterotoxin B mutants (N23K and F44S): biological effects and vaccine potential in a mouse model.Vaccine, 1997, 15(1):133-139.
[9]Dohlsten M, Hansson J, Ohlsson L, et al.Antibody-targeted superantigens are potent inducers of tumor-infiltrating T lymphocytes in vivo.Proc Natl Acad Sci U S A, 1995, 92(21):9791-9795.
[10]Kodama H, Suzuki M, Katayose Y, et al.Mutated SEA-D227A-conjugated antibodies greatly enhance antitumor activity against MUC1-expressing bile duct carcinoma.Cancer Immunol Immunother,2001, 50(10):539-548.
[11]Wahlsten JL, Mills CD, Ramakrishnan S.Antitumor response elicited by a superantigen-transmembrane sequence fusion protein anchored onto tumor cells.J Immunology, 1998, 161(12):6761-6767.
[12]Iida H, Asada H, Yokoi S, et al.Regulatory effects of antihistamines on the responses to staphylococcal enterotoxin B of human monocyte-derived dendritic cells and CD4+ T cells.J Dermatol Sci,2008, 52(1):31-38.
[13]Jin YW, Li P, Xu QB, et al.Enhancement of immune responses to hepatitis B DNA vaccine by superantigen SEA in mice.Chin J Biotechnol, 2005, 21(5):682-685.(in Chinese)靳彦文, 李平, 胥全彬,等.超抗原SEA增强小鼠对HBV DNA疫苗的免疫反应.生物工程学报, 2005, 21(5): 682-685.
[14]Chinese Pharmacopoeia Commission.Pharmacopoeia of the People’s Republic of China.Volume 3, 2010.Beijing: China Medical Science Press, 2010:58.(in Chinese)国家药典委员会.中华人民共和国药典.2010年版三部.北京: 中国医药科技出版社, 2010:58.
