人脐带间充质干细胞注射液的长期稳定性研究
2013-12-01耿洁张磊王斌韩忠朝
耿洁,张磊,王斌,韩忠朝
近年来随着干细胞研究的快速发展,干细胞逐渐在医学领域得到广泛应用。为适应临床使用的需要,各种干细胞制品制剂诸如新鲜制剂、冻存制剂、凝胶剂、组织工程细胞装置相继被开发。美国、加拿大、韩国的一些干细胞药物相继完成临床前研究进入临床试验阶段,这些都标志着干细胞从实验室技术向着药物的方向发展。干细胞向药物转化过程中的药学研究是药物安全性和有效性的基础,参照药物研发技术规范进行干细胞药物制剂稳定性的研究是非常重要的一部分[1]。
药物稳定性是指药物在生产制备后,经过运输、储藏、周转直至临床应用前一系列过程中质量变化的程度。稳定性研究的目的在于查明一种药品是怎样作为时间函数和在各种不同环境因素影响下的不同表现,为药品辅料的筛选,生产工艺、生产条件、包装材料的选择和有效期的确定提供必不可少的科学依据。干细胞冻存制剂,是将一定浓度的干细胞悬液与细胞冻存保护液按比例混合配制,分装于适宜冷冻的内包装材料中,放于液氮中保存的制剂。作为一种不同于传统药物制剂的全新药物制剂形式,具有非常强的特殊性,更需要通过全面的稳定性研究来指导制剂的开发、制备、储存、运输、使用等[2]。
我们开发的新药“注射用间充质干细胞(脐带)”已完成了临床前研究,进入临床试验审批阶段。在药学研究过程中,我们开发建立了一整套适用于间充质干细胞冻存制剂的质量检测方法及标准。
本研究的目的是考察干细胞制剂在液氮冻存条件下物理、化学、生物学功能、微生物学等性质随时间变化的规律,为干细胞药品的生产、包装、贮存、运输条件和有效期的确定提供科学依据,以保障临床用药安全有效[3]。与传统药物制剂相比,干细胞药品有一个突出特点即制剂的有效成分是活细胞。因此在稳定性考察的过程中将重点考察保存环境对活细胞的生物学活性的影响,为保证制剂中活细胞的生物学活性长时间稳定,制剂的保存温度被设定在–196 ℃。这一保存温度也是首次应用于药物制剂开发中。
1 材料与方法
1.1 材料
1.1.1 细胞与培养基、试剂 细胞制剂由本公司制备,含有 2×107个/袋的细胞悬液(含冻存保护剂)经超低温冻存制备得到的;胎牛血清购自兰州民海生物工程有限公司;DF12 培养基购自美国 Gibco公司;Human TNFRI Immuno Assay Kit 购自R & D公司;定量检测牛血清白蛋白(BSA)酶联免疫试剂盒购自无锡博生医用生物技术开发有限公司。
1.1.2 仪器 FACS Calibur 型流式细胞仪购自美国 BD公司;SevenEasy 型 pH 计购自梅特勒-托利多公司;Model 680 酶标仪购自美国 Bio-Rad公司。
1.2 方法
选择研发过程中中试规模制备的3 批制剂,定期取样进行物理、化学、生物学功能、微生物学、外源添加物残留量分析,以考察其稳定性变化趋势。
1.2.1 外观 在灯检箱中采用目检法进行外观检查。双手持袋,轻轻旋转或翻转容器,注意不使液体产生气泡。判定标准为均匀白色或略带黄色半透明细胞混悬液,不应有摇不散的絮状物,无异物。
1.2.2 pH 值 将待检样品复苏后取出,平衡至室温后按《中华人民共和国药典》2010年版第三部附录 VA 进行,判定标准为6.5~8.0。
1.2.3 细胞活率 使用 37~40 ℃ 温水迅速复苏融化待检制剂,采用台盼蓝拒染法进行细胞存活率测定。判定标准为不低于80%。
1.2.4 细胞表型纯度 将制剂中复苏得到的细胞接种至T-75培养瓶中,并使用含有 10% 胎牛血清的DF12 进行培养,待细胞生长至 90% 融合后,消化获取细胞悬液,使用荧光抗体对细胞进行表面标记,而后采用流式细胞仪测定细胞表型。判定标准为CD73、CD90和CD105 阳性率不低于95%;CD45、CD34、CD14/CD11b、CD79α/CD19和HLA-DR 阳性率不高于2%[4]。
1.2.5 生物学效力 将制剂中复苏得到的细胞接种至T75培养瓶中,并使用含有 10% 胎牛血清的DF12 进行培养,待细胞生长至 90% 融合后,消化获取细胞悬液,计数细胞总数,500×g 离心 10 min,弃上清获取细胞,加入 RIPA 裂解液,制备得到浓度为1×107个/ml的细胞裂解液。而后使用 TNFRI ELISA Kit 对裂解物中 TNFRI进行检测。该方法采用 ELISA 法检查细胞中 TNFRI 表达水平,判定标准为间充质干细胞生物学效力应不小于13 pg/百万细胞。
1.2.6 内毒素 按《中华人民共和国药典》2010年版第三部附录 XIIE 进行,判定标准为细菌内毒素的含量应不高于2 EU/ml。
1.2.7 无菌 按《中华人民共和国药典》2010年版第三部附录 XIIA 进行,结果应为阴性。
1.2.8 牛血清残留量 将细胞制剂复苏后取样,使用“定量检测牛血清白蛋白(BSA)酶联免疫试剂盒”,对细胞悬液的牛血清残留量进行检测。每次检测同时进行试验有效性确认。判定标准为每个制剂牛血清残留量不高于50 ng。
2 结果
2.1 外观
结果表明,样品在12、24、36个月的时间内制剂外观始终保持稳定,未出现结团、絮状物等现象。
2.2 pH 值
结果(表1)表明,样品的pH 值在12、24、36个月时间内,保持稳定。
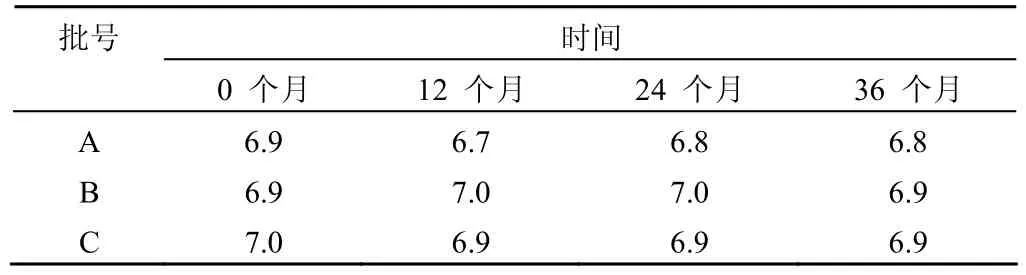
表1 pH的稳定性
2.3 细胞活率
使用配对 t 检验对数据进行统计学分析,分析保存时间对细胞活率所产生的影响是否具有统计学意义。结果(图 1)显示各个检测点的数据与0 月相比,均 P >0.05。表明截至 36个月,在超低温环境下的长期保存对制剂的细胞活率产生的影响均无统计学意义。
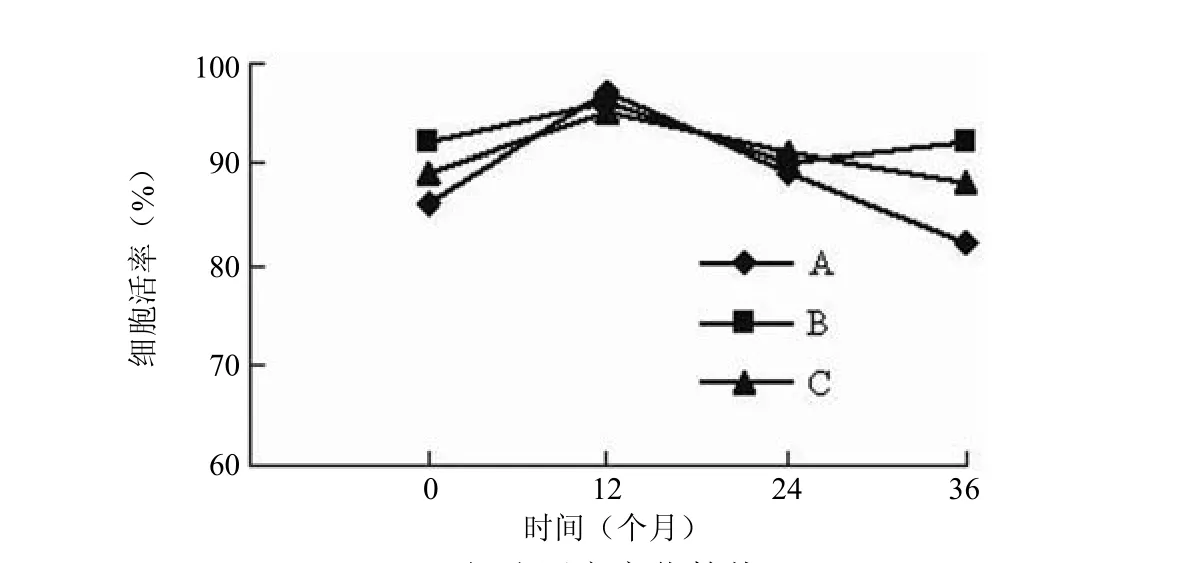
图1 细胞活率变化趋势
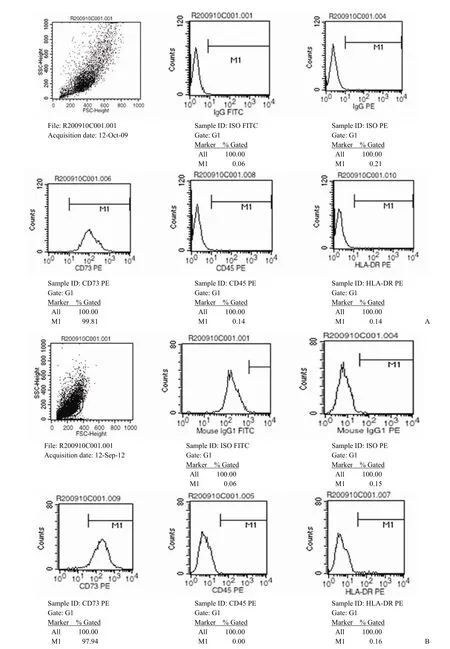
图2 流式细胞检测结果(A:R200910C001,0个月数据;B:R200910C001,36个月数据)
2.4 细胞表型纯度
结果(图 2)表明,同一批次细胞经过 36个月冻存,复苏后其特征表型未发生变化。
2.5 生物学效力
样品在12、24、36个月的时间内制剂的生物学效力检测结果均在检测限度内。
2.6 细菌内毒素
样品在12、24、36个月的时间内制剂的内毒素情况始终保持稳定,各时间样品均小于2 EU/ml,在限度检测中未出现结果的变化。
2.7 无菌
样品在12、24、36个月的时间内制剂的无菌检查结果始终保持稳定。
2.8 牛血清残留量
在36个月时间内,制剂中牛血清残留量均不大于50 ng/剂量,保持稳定,如表 2 所示。
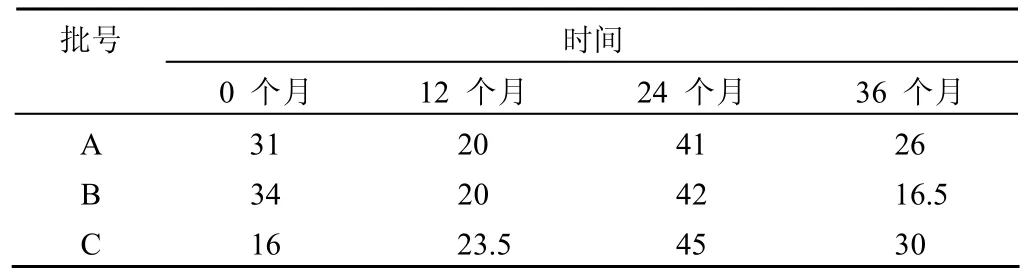
表2 牛血清残留量(ng/剂量)
3 讨论
3.1 储存条件的选择
本研究所检测的样品为具有生物学活性的干细胞,干细胞发挥疾病治疗功效依赖于具有生物学活性的活细胞。在临床应用过程中,常规条件保存新鲜制备的细胞制剂有效期短,无法长时间保存,即使是在4 ℃ 环境下储运的干细胞制剂也无法长时间保持细胞活率的稳定。细胞活率在制备后几十个小时内会随着储存时间的延长而显著下降,导致制剂中活细胞的不断减少,而细胞的死亡就意味着治疗功效的丧失。这一问题严重制约了干细胞的临床应用。一种无法长时间稳定保存的制剂是无法实现大规模标准化制备,往往在应用时无法准确获得检测结果,这将极大地降低其质量的可控性,进而增加安全性风险。细胞的超低温冻存技术是一项已被医学生物学研究领域应用多年且成熟的细胞保存技术。如今随着干细胞引领的再生医学的发展,这项技术将被应用于干细胞药物的开发中。
要使干细胞制剂得以长时间保存,必须提供一个稳定的适宜的温度环境。冷冻保存温度的选择成为了关键。冷冻保存温度指能长期保存细胞的超低温度,在此温度下,细胞生化反应极其缓慢甚至停止,但经过长期保存,在复苏后仍能保持正常的结构和功能。不同的细胞和生物体以及使用不同的冷冻保存方法要取得同样的冷冻保存效果,冷冻保存温度可以不同。但从实际和效益的观点出发,液氮温度(–196 ℃)是目前最佳的冷冻保存温度。在–196 ℃ 时,细胞的生命活动几乎完全停止,但复苏后细胞的结构和功能完好。如果冷冻过程得当,一般生物样品在–196 ℃ 下均可保存十年以上。干细胞冻存制剂是储存在超低温环境下的特殊生物制剂。液氮提供的–196 ℃的超低温环境对于干细胞冻存制剂的储存是十分关键而且必需的。只有在超低温环境下细胞才能被有活性的长期保存,并可以通过适宜的方法复苏得到完整的活细胞并用于治疗。
3.2 理化指标
在检测数据中 pH 值和外观这两项理化指标在为期36个月的观察中没有出现异常。外观并没有随着储存时间的延长出现变化也没有表现出某种变化的趋势。由此证明在36个月的储存过程中,现有的保存条件下保持制剂外观具有很好的稳定性。pH 作为一个可以量化的指标,通过统计学分析表明制剂的pH 值未出现随时间而变化的趋势。从检测数据本身来看,同一批号制剂前后多次检验时 pH 值表现出的差异为检测随机误差造成,这种差异无明显趋势。
3.3 细胞表型纯度
间充质干细胞表面表达多种特征分子,这些分子可以作为干细胞的特征,通过基于荧光抗体检测技术的流式细胞术进行定量测定以获取细胞纯度的数据。但目前尚无一种特异性细胞表面分子可以单独用于干细胞的鉴定及纯度的测定,因此目前世界公认的标准为使用 8 种细胞表面分子组合用于干细胞的纯度测定,纯化后的间充质干细胞应同时满足8个表面分子的纯度指标:CD73、CD90和CD105 阳性率不低于95%;CD45、CD34、CD14/CD11b、CD79α/CD19和HLA-DR 阳性率不高于2%。本文选取 CD73、CD45和HLA-DR的结果。
3.4 微生物学指标
微生物学指标为无菌检查和细菌内毒素检查。通过实验发现每一批次制剂的无菌、内毒素检测结果在跨越 36个月的4 次检测中结果前后一致。可见制剂的无菌、内毒素在此次稳定性考查期间其限度检测结果是稳定的,同时表明内包装材料在–196 ℃ 环境下,能够保持足够的机械强度和密闭性。
3.5 生物学活性指标
首先是细胞活率,需要指出的是作为目前生物学研究领域内公认的细胞活率检测方法——台盼蓝拒染法是有一定的检测误差的。在《生物制品质量控制分析方法验证技术评审一般原则》[5]中指出,生物学检测方法的标准差通常在±20% 之间,台盼蓝拒染法也存在同样的特点,这一点和很多物理化学检测方法有很大的不同,因此可以看到同一批制剂基于台盼蓝拒染法检测得到的细胞活率数据前后有一些变化,这种变化是由于方法学本身特点造成的,因此我们在本次研究中选用了初始细胞活率不同的3 批样品进行研究,以求通过增加样本量获取更为准确的检测结论。通过统计学方法对细胞活率数据的分析,可以得出如下结论:在时间跨度 36个月的检测中,3 批制剂总体上未表现出细胞活率随着时间而降低的趋势,也就是说制剂超低温保存过程中的细胞活率是稳定的。
其次是细胞纯度。脐带间充质干细胞是一种从脐带组织中通过分离并在体外培养过程中纯化得到的干细胞。但在纯化的过程中依靠现有的技术方法尚无法完全清除非干细胞的其他细胞,因此制剂中干细胞纯度检测也成为了衡量制剂生物学活性的重要指标。通过实验发现,在经过了 36个月的储存后,全部 3 批制剂中的干细胞纯度仍然是合格的。
3.6 生物学效力指标
本研究中的生物学效力是根据临床适应证的需要而进行的。由于干细胞的多向分化能力,在临床应用时表现出针对不同的适应证的疗效。本研究通过检测肿瘤坏死因子受体 1(TNFRI)来评估其免疫调节的作用。同样的,根据其他适应证例如促进血管新生、支持造血、促进皮肤修复等功能,应更新生物学效力的检测方法。
大量的研究已经证明 MSC 具有免疫抑制活性,MSC可以迁移至损伤或炎症部位,抑制 T 淋巴细胞的活性,同时抑制炎症预激因子(如 TNF-α、IFN-γ),发挥组织修复作用[6]。
依据 MSC的免疫抑制作用,我们进行了淋巴细胞增殖抑制试验,发现共培养体系中 MSC的数量与所产生的T 细胞增殖抑制作用之间存在明确的量效关系[7]。但是该检测方法存在着操作环节多、具有放射性污染、技术难度大、实验周期长、外周血细胞和MSC 消耗量大、所用新鲜人外周血批次差异大等缺点,造成检测结果不稳定,重复性差,无法有效测定 MSC的生物学效力。由于MSC 表达的肿瘤坏死因子受体 1(TNFRI)可接受 TNF-α的刺激信号进而诱导 MSC 分泌 PGE2等免疫抑制因子,最终抑制 T 细胞增殖[8],用 ELISA 法检测 MSC的TNFRI 表达水平理论上可以间接地代表 MSC的免疫抑制效果。经验证,ELISA 法检测干细胞表面 TNFRI 表达量与间充质干细胞免疫调节的能力强弱具有一定的相关性,作为MSC 生物学效力测定方法,其线性、范围、精密度、准确度、专属性、耐用性均满足接受标准。
3.7 添加物质的残留量
牛血清是间充质干细胞培养过程中培养基的添加物质,在研究中坚持少加甚至不加的原则,但是目前阶段本研究采用逐步减量的工艺。虽然在传代的后期不使用牛血清,但是传代前期使用的血清不可避免地残留在制备细胞悬液中,因此在制备细胞制剂时,要严格控制牛血清的残留量。
添加物质的残留量分析是考察制剂稳定性的关键指标,随着保存时间的延长,添加物质应保持一定的水平。本研究中,经过 36个月的保存,牛血清的残留量仍然控制在一定范围内,较为稳定。
综上所述,我们所制备并用于本研究的间充质干细胞冻存制剂在–196 ℃的储存环境下,包括理化、微生物学、生物学活性、添加物质残留量的各项检测指标均保持稳定,未出现明显异常,也未表现出显著的变化趋势,可见此干细胞冻存制剂在超低温环境下可以获得非常稳定的保存而不出现任何影响到制剂质量的明显变化。这为干细胞冻存制剂有效期的制订提供了重要的依据,也提示我们此项稳定性研究可以继续进行并积累更多的数据,以证明此制剂在超低温环境下可以获得更长的保存期。
目前已完成制剂保存 36个月的研究,更长时间的稳定性研究后续正在进行。
[1]The International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use.ICH harmonised tripartite guideline -- 2007 part quality.Zhou HJ,interpret.Beijing: People’s Medical Publishing House, 2006.(in Chinese)ICH指导委员会.药品注册的国际技术要求——2007质量部分.周海钧, 译.北京:人民卫生出版社, 2006.
[2]China Food and Drug Administration.Technical guideline on research and quality control of human somatic cell therapy products.(2003-03-20) [2013-01-05].http://www.sda.gov.cn/WS01/CL0237/15709.html.(in Chinese)国家食品药品监督管理局.人体细胞治疗研究和制剂质量控制技术指导原则.(2003-03-20) [2013-01-05].http://www.sda.gov.cn/WS01/CL0237/15709.html.
[3]China Food and Drug Administration.Guideline for stability testing of drug substances.(2005-03) [2013-01-02].http://www.sda.gov.cn/gsz 05106/01.pdf.(in Chinese)国家食品药品监督管理局.化学药物稳定性研究技术指导原则.(2005-03) [2013-01-02].http://www.sda.gov.cn/gsz05106/01.pdf.
[4]Dominici M,Le Blanc K, Mueller I, et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement.Cytotherapy, 2006,8(4):315-317.
[5]China Food and Drug Administration.General principles for biological products quality control method validation.(2005-12)[2013-01-02].http://wenku.baidu.com/view/552092659b6648d7c1c746f7.html.(in Chinese)国家食品药品监督管理局.生物制品质量控制分析方法验证技术评审一般原则.(2005-12) [2013-01-02].http://wenku.baidu.com/view/552092659b6648d7c1c746f7.html.
[6]Liu RY, Fan C, Mitchell S, et al.The role of type I and type II tumor necrosis factor (TNF) receptors in the ability of TNF-alpha to transduce a proliferative signal in the human megakaryoblastic leukemic cell line Mo7e.Cancer Res, 1998, 58(10):2217-2223.
[7]Di Nicola M, Carlo-Stella C, Magni M, et al.Human bone marrow stromal cells suppress T-lymphocyte proliferation induced by cellular or non-speci fi c mitogenic stimuli.Blood, 2002, 99(10):3838-3843.
[8]Aggarwal S, Pittenger MF.Human mesenchymal stem cells modulate allogeneic immune cell responses.Blood, 2005, 105(4):1815-1822.
