西藏牦牛12SrRNA基因全序列测定及系统进化关系
2013-11-30姜雪鸥钟金城
姜雪鸥,钟金城
(西南民族大学 动物遗传育种学国家民委-教育部重点实验室,四川 成都 610041)
动物线粒体基因组中通常含有2个rRNA、13个结构蛋白基因、22个tRNA和1个D-loop区[1]。按照母性遗传方式传代,其分子量小,拷贝数多,进化速度很快,碱基的替代率比单拷贝核DNA基因组快6~10倍。12SrRNA基因是在进化上比较保守,通常被用于系统发生和分子进化的研究[2]。
牦牛是牛属动物中唯一繁殖在青藏高原及其毗邻高寒牧区的牛种,一般生活在海拔3 000 m以上的高山、亚高山地区,对低氧、高寒等恶劣的环境具有很强的适应能力, 同时,该物种对于缺氧环境的适应能力具有很大的生态可塑性[3]。
本文以西藏11个牦牛品种为研究材料,首次对它们的mtDNA 12SrRNA基因全序列进行了测定及分析,并在11个群体内进行同源性比较和分子信息学的探讨,为今后深入研究牦牛线粒体基因的分子特征、种群结构等方面提供理论基础。
1 材料与方法
1.1 试验动物及血样采集
从11个西藏牦牛品种或类群中,随机选取健康成年牦牛110头,采集耳组织,75%乙醇保存,低温带回实验室,-80 ℃保存(牦牛的品种及数量见表1)。
1.2 酶和试剂
Tris-Base、氯仿、95%酒精、DNA Marker 2000、蛋白酶K、EDTA、硼酸、IPTG、饱和酚、X-gal、氨卞青霉素、琼脂粉等均购自大连宝(TakaRa)生物工程有限公司;动物基因组DNA凝胶回收试剂盒购自天根生化科技有限公司。
1.3 菌株和载体
大肠杆菌DH5α由成都天泰生命科技有限公司提供;pMD19-T Vector载体购自大连宝(TakaRa)生物有限公司。
1.4 基因组DNA提取及检验
采用的是常规的酚-氯仿法提取动物组织的基因组DNA[4],用1%~1.5%的琼脂糖凝胶电泳以及紫外分光光度计法双重检测DNA的浓度和纯度,并将所提DNA产物置于-20 ℃保存备用。
1.5 引物的设计、合成及稀释
参照NCBI (http://www.ncbi.nlm.nih.gov/)上已有的亚洲水牛(GenBank Accession No:AY488491.1)、非洲水牛(GenBank Accession No:EF536353.1)、欧洲野牛(GenBank Accession No:HM045017)和家牛(GenBank Accession No:EU177829)的12SrRNA序列,应用生物信息学软件DNAMAN和Primer Premier 5.0设计引物,由英潍捷基(上海)贸易有限公司(cnservice.invitrogen.com)合成。引物序列为:PF:5′-GGCACTGAAAATGCCTAGATG-3′与PR:5′-GCATACTGGAAAGTGTGCTTG-3′。
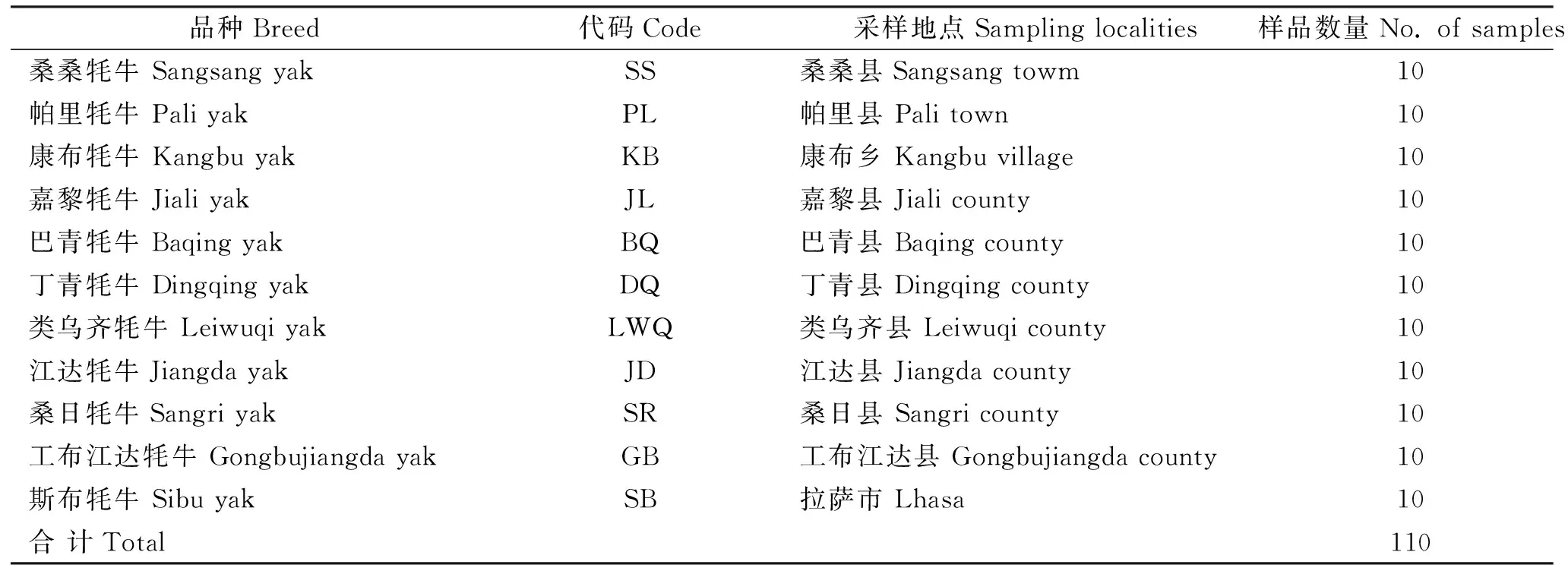
表1 样本信息Table 1 Information of samples
1.6 PCR扩增
PCR的扩增体系:总体系为25 μL,包括MgCl2(25 mmol/L) 1.5 μL,灭菌去离子水,14.85 μL dNTP(各2.5 mmol/L) 2 μL,模板DNA(50 ng/μL)2 μL,10×Buffer(Mg2+Free)2.5 μL,上、下游引物各1 μL,ExTaq (5 U/μL)0.15 μL。
PCR的扩增程序:94 ℃预变性3 min;94 ℃变性30 s,62.5 ℃退火30 s,72 ℃延伸90 s, 30个循环;最后72 ℃延伸5 min,4 ℃保存。PCR产物用1%的琼脂糖凝胶电泳检测。
1.7 PCR产物的的克隆
PCR产物参照DNA凝胶回收试剂盒说明书进行回收纯化,用pMDTM19-T Vector与回收的目的片段在恒温16 ℃的金属浴中反应连接2~8 h;将连接产物转入大肠杆菌DH5α感受态细胞中培养;再将培养好的菌液涂在含有X-Gal 底物、氨苄青霉素、IPTG 诱导物的固体培养基平板上,利用蓝白斑法进行筛选;用灭菌好的牙签去挑取白色的单一菌落,在含有氨卞青霉素的LB液体培养基中培养,将构建的重组质粒通过PCR 法进行转化子鉴定克隆是否成功。
1.8 测序及分析
提取阳性重组质粒,将其送往英潍捷基(上海)贸易有限公司测序。测序结果用BioXM、DNAMAN、dnasp5等软件进行序列比对分析;用MEGA生物信息学软件构建不同的物种间系统进化树。
2 结果与分析
2.1 mtDNA D-loop扩增结果
PCR扩增产物经琼脂糖凝胶电泳显示有清晰明亮的区带,片段长度应为1 008 bp左右,由图1可看出,牦牛的mtDNA D-loop区的PCR扩增产物大小与预期结果一致。

图1 PCR扩增产物的1%琼脂糖凝胶电泳图Fig.1 Electrophoretic agarose gel of PCR amplification
2.2 牦牛12SrRNA全序列的长度与碱基组成
本研究测定的11个牦牛类群110个个体的12SrRNA全序列,长度为962 bp、963 bp、964 bp或965 bp,T、C、A、G 4种核苷酸的平均比例分别为22.5%(22.4%~22.7%)、23.2%(23.0%~23.3%)、36.6%(36.4%~36.7%)、17.8%(17.7%~17.8%),见表2。
2.3 12SrRNA基因的遗传多样性
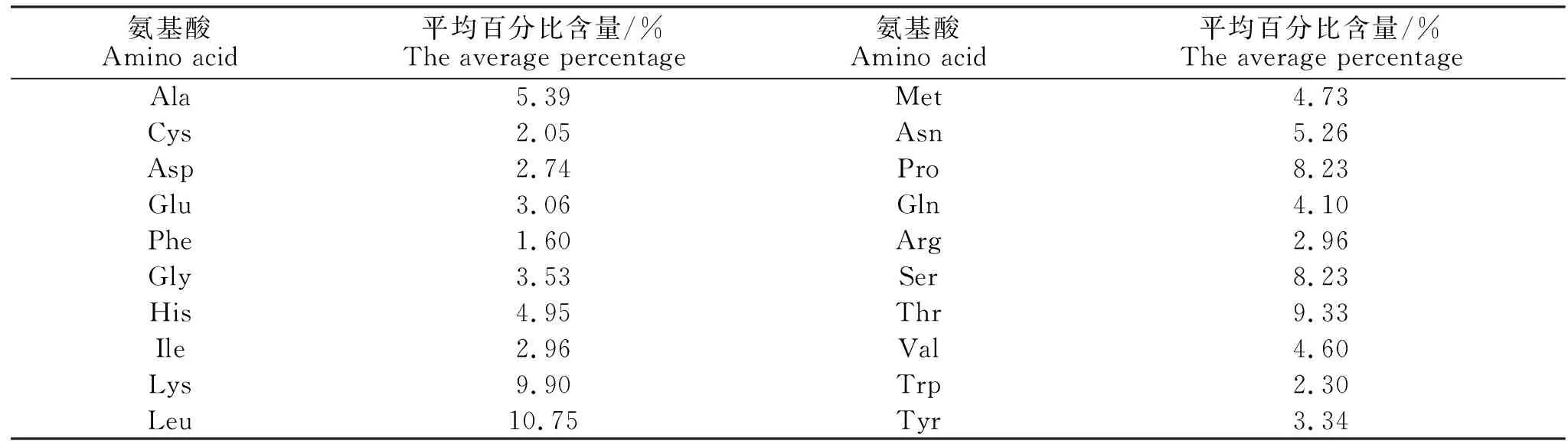
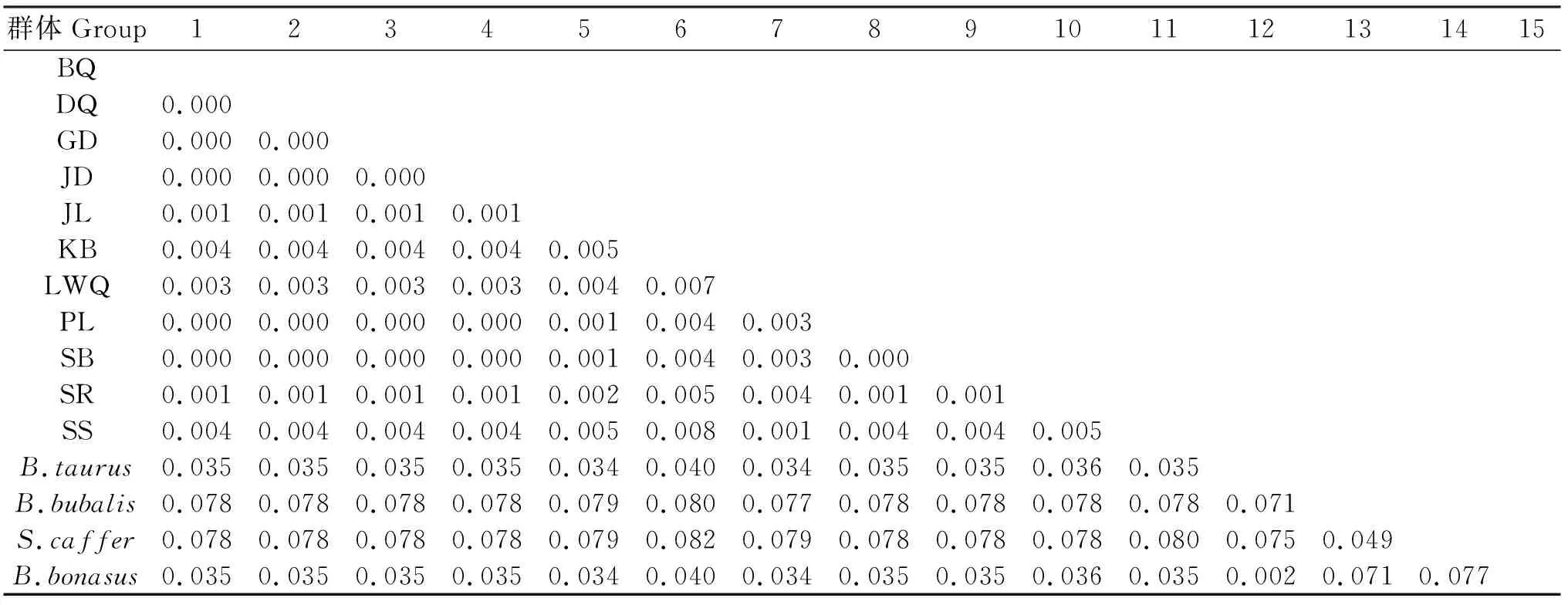
通过dnasp5软件分析110只牦牛,共检测出35种单倍体(见表3),其中帕里牦牛的单倍型高于其他8个类群,而桑日牦牛的单倍型数最小,为2。Tajima′s D检验是中性检验的一种,BQ、DQ、GD、PL、SB的Tajima′s D统计值为正值或者接近零(P>0.05),说明中性检验不显著,序列进化方式为平衡选择,且有一些单倍型分化;而其他6个类群的Tajima′s D统计值均为负值(0.01 根据测得的序列推算其氨基酸序列组成(见表4),结果显示,在11个类群的牦牛中,12SrRNA均含有20种氨基酸,共由321个氨基酸组成,统计发现:12SrRNA各氨基酸平均含量在1%~11%之间变化,亮氨酸(Leu)的含量最高,为10.75%;苯丙氨酸(Phe)的含量最低,为1.60%。 表2 西藏11个类群牦牛12SrRNA基因片段的碱基组成比较Table 2 The base composition of of 12SrRNA of Tibetan yak 表3 西藏11个类群牦牛12SrRNA基因的核苷酸多样性和单倍型多样性Table 3 The nucleotide diversity and haplotype diversity of 12SrRNA of Tibetan yak 表4 11种西藏牦牛12SrRNA的氨基酸组成Table 4 Average amino-acid composition of 12SrRNA of Tibetan yak 应用Mega 5 软件算出了11种牦牛及亚洲水牛、非洲水牛、欧洲野牛和家牛四种牛亚科12SrRNA序列间的相对遗传距离,它们之间的序列差异在0.000~0.082(见表5)。其中帕里牦牛、斯布牦牛、巴青牦牛、丁青牦牛、江达牦牛与工布江达牦牛的序列差异最小为0.000,表明它们的亲缘关系最近;康布牦牛与非洲水牛的序列差异最大为0.082,表明它们的亲缘关系最远。图3表明,相对于亚洲水牛、非洲水牛、欧洲野牛和家牛四种牛亚科的关系,西藏11种牦牛类群之间的遗传距离更近,同源性更高。 分别用邻接法和最小进化法构建11种西藏牦牛与亚洲水牛、非洲水牛、欧洲野牛和家牛四种牛亚科的12SrRNA基因序列系统进化树,如图2~3所示,两种方法得出大致相同的拓扑结构。结果显示: 表5 11种西藏牦牛12SrRNA两两序列间的遗传距离Table 5 The genetic distance among 11 groups of 12SrRNA of Tibetan yak 注:1-15分别为BQ、DQ、GD、JD、JL、KB、LWQ、PL、SB、SR、SS、B.taurus、B.bubalis、S.caffer、B.bonasus Note: No.1 to 15 are BQ、DQ、GD、JD、JL、KB、LWQ、PL、SB、SR、SS、B.taurus、B.bubalis、S.cafferandB.bonasusrespectively. 图2 用ME法构建的12SrRNA基因序列系统进化树Fig.2 The ME phylogenetic tree between 11 groups of 12SrRNA 图3 用N-J法构建的12SrRNA基因序列系统进化树Fig.3 The N-J phylogenetic tree between 11 groups of 12SrRNA 帕里牦牛、斯布牦牛、巴青牦牛、丁青牦牛、江达牦牛、工布江达牦牛、康布牦牛与桑日牦牛同属于一个单倍型,它们先与嘉黎牦牛聚在一起;桑桑牦牛和类乌齐牦牛为同一单倍体;以上两聚合枝聚为一个合枝;家牛与非洲野牛聚在一起,亚洲水牛与非洲水牛聚在一起。11种西藏牦牛是同一属的,因而它们之间的亲缘关系比较近。枝上数值为重复1000次的支持率。以上系统进化关系还可以从11种牦牛与亚洲水牛、非洲水牛、欧洲野牛和家牛四种牛亚科的遗传距离得以验证(见表3)。 本试验根据NCBI上已有的亚洲水牛、非洲水牛、欧洲野牛和家牛四种牛类的线粒体基因组的信息设计引物,成功扩增出西藏牦牛的线粒体12SrRNA基因序列。 该基因长度为962~965 bp之间,其碱基含量与其他的牛类相近。A+T含量59.1%显著高于G+C含量40.8%,表现出一定的碱基偏好性。相对于已经研究的牦牛线粒体D-Loop控制区序列和细胞色b基因相比较,西藏牦牛的(A+T)% 略低[5-6]。序列比对还发现,12SrRNA基因在线粒体基因组中的位置较为保守。 Nei的定义说明核苷酸差异数目(歧义度)值越小,说明该群体的遗传多样性越低[7]。本研究测得11个牦牛类群间的核苷酸歧义度在0.01890~0.08774之间变化,而总的核苷酸歧义度为0.06421,表明群体间遗传变异大于群体内遗传变异,说明西藏牦牛群体的遗传变异主要存在于种群间。 一些物种mtDNA的研究表明,细胞色素b基因和D-Loop控制区序列可适于属内不同种内种间的系统发育分析[7-9]。而很多研究认为,12SrRNA序列更适合较高阶元类群的系统发育分析,相对而言,在一些低阶的鱼类等类群,线粒体进化较快的区段12SrRNA基因序列不能够提供有效的信息含量[10-12]。近年来,线粒体12SrRNA的二级结构模型及变型在牦牛的物种鉴定和系统发育研究中得到广泛应用,以至于将成为今后的进一步探讨内容[13-16]。 本研究首次对牦牛的12SrRNA基因进行克隆测序,并对其基因结构进行了初步分析,为探究牦牛线粒体基因组的遗传特点、物种进化关系以及物种多样性分析等提供参考。 参考文献: [1] Li Ming,Wei Fu-wen,Huang Cheng-ming. Phylogeny of Snub-Nosed Monkeys Inferred From Mitochondrial DNA Cytochrome B and 12S rRNA Sequences[J]. International Journal of Primatology, 2004,25(4):861-873. [2] Chen Yi-yu,He Shun-ping,Wang Wei. Mitoehondrial d-loop sequence variation and phylogeny of gobioboline fishes[J]. Progress in Natural Sciences, 2002,12(11):866-868. [3] 金 双,钟金城,陈智华,等. 牦牛EPO基因部分片段的克隆测序及其分析[J]. 畜牧与兽医, 2007,39(2):25-27. [4] Sambrook J, Fritsch EH, Maiatis T. 分子生物学实验指南[M].2版.北京:科学出版社,1998:26-31. [5] 刘 强. 从线粒体细胞色素b基因和D-Loop控制区序列差异研究野牦牛和家牦牛的系统进化关系[D].杭州:浙江大学,2005. [6] 杨万远,陈雪梅,钟金城. 野牦牛mtDNA Cytb基因全序列测定及系统进化关系[J]. 中国草食动物,2009(3):8-13. [7] Zullo S, Sieu L C, Slightom J L, et al. Mitochondrial D-loop sequences are integrated in the rat nuclear genome[J]. Journal of Molecular Biology, 1991,221(4):1 223-1 235. [8] 姬秋海. 中国牦牛品种资源的研究进展[J]. 自然资源学报, 2001,16(6):564-570. [9] Vun V F, Mahani M C, Lakim M. Phylogenetic relationships of leaf monkeys (Presbytis; Colobinae) based on cytochrome b and 12S rRNA genes[J]. Genetics and Molecular Research, 2011,10(1):368-381. [10] Oakenfull E A ,Ryder O A. Mitochondrial control region and 12S rRNA variation in Przewalski's horse (Equus przewalskii)[J].Animal Genetics, 1998,29:456-459. [11] Emna Mkaouar rebai, Nourhene Fendri kriaa, Nacim Louhichi. Whole mitochondrial genome screening in two families with hearing loss: detection of a novel mutation in the 12S rRNA gene[J]. Bioscience Reports, 2010,30 (6):405-411. [12] Ballard J W,Olsen G J,Faith D P. Evidence from 12S ribosomal RNA sequences that onychophorans are modified arthropods[J]. Science, 1992,258:1 345-1 348. [13] Brutto S L,Arculeo M,Sara M. Mitochondrial simple sequence repeats and 12S-rRNA gene reveal two distinct lineages of Crocidura russula(Mammalia, Soricidae)[J]. Heredity, 2004,92:527-533. [14] 李齐发,李隐侠,赵兴波. 牦牛线粒体DNA细胞色素b基因序列测定及其起源、分类地位研究[J]. 畜牧兽医学报, 2006,37(11):1 118-1 123. [15] Alejandro Espinosa De Los Monteros. Models of the Primary and Secondary Structure for the 12S rRNA of Birds: A Guideline for Sequence Alignment[J]. DNA Sequence, 2003,14(4): 241-256. [16] 郑 冬,刘学东,马建章. 12SrRNA基因及其二级结构在系统学研究中的应用[J]. 东北林业大学学报, 2003,31(3):59-61.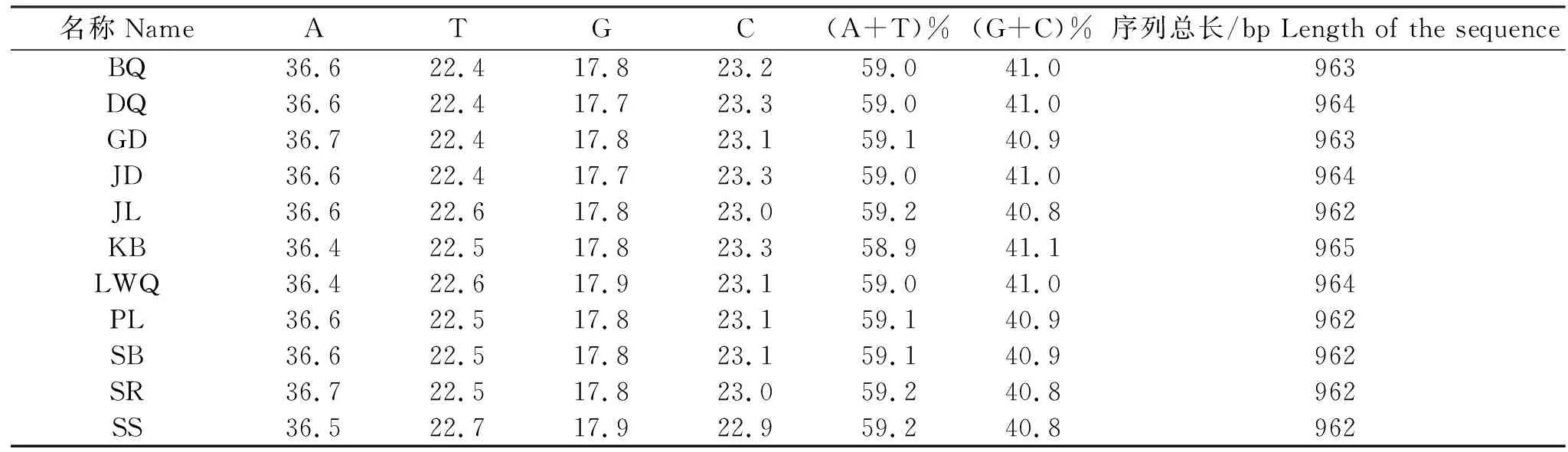

2.4 11种牦牛类群12SrRNA基因序列间差异
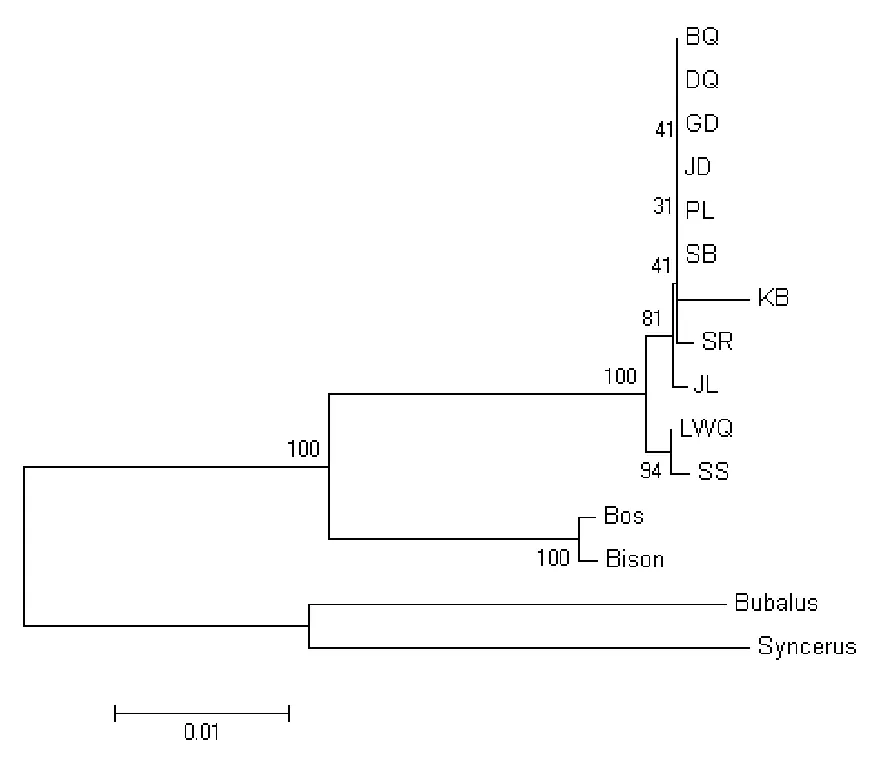
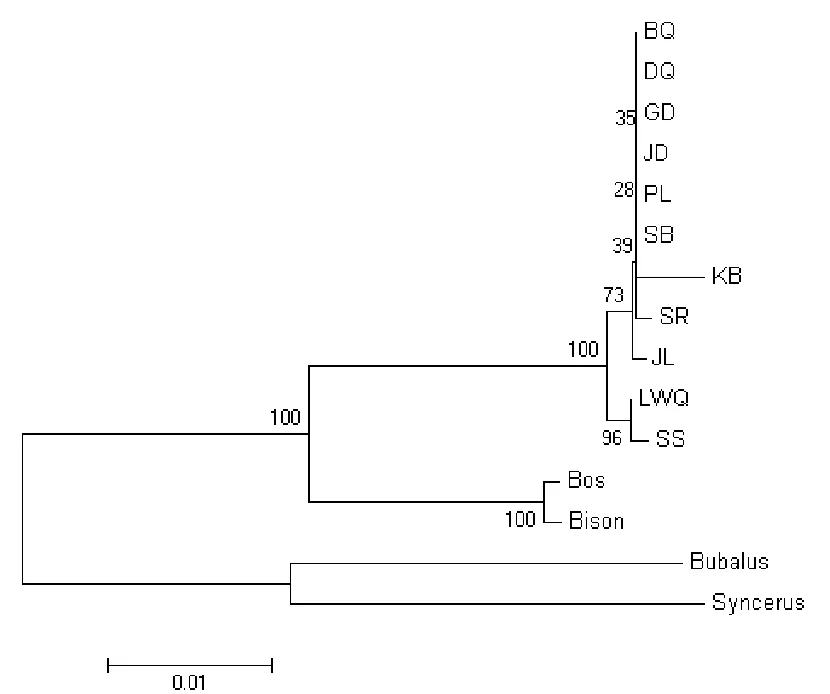
2.5 分子系统进化
3 讨 论
