自动净化及新型酶联免疫法测定废气中的二噁英
2013-11-28周志广许鹏军刘爱民黄业茹高木阳子
周志广,许鹏军,任 玥,李 楠,齐 丽,郑 森,赵 虎,范 爽,张 烃,刘爱民,黄业茹,高木阳子
(1.国家环境分析测试中心 国家环境保护二英污染控制重点实验室,北京 100029;2.京都电子工业株式会社,日本 京都 601-8317)
1 实验部分
1.1 试剂与仪器
正己烷(美国J.T-Baker),DMSO(日本Wako Pure Chemical),13C取代的净化内标和13C取代的进样内标(加拿大Wellington Laboratory),多层硅胶柱和氧化铝柱(日本三浦环境科学研究所),Milli-Q plus纯水器(美国Millipore公司);分析仪器采用Waters公司生产的AutoSpec ULtima NT型高分辨气相色谱-高分辨质谱联用仪(HRGC-HRMS)以及与京都电子公司共同开发研制的SPD-600、DXS-600。
实验所用的样品为废弃物焚烧后产生的废气样品。
1.2 自动前处理仪器实验条件的优化
SPD-600仪器基本结构如图1,其中2和3是简化的多层硅胶柱和氧化铝柱。简化多层硅胶柱的基本构成为:硫酸钠(2 g)+2%氢氧化钾硅胶(0.8 g)+硅胶(0.05 g)+44% 硫酸硅胶(7.3 g)+硅胶(0.05 g)+10% 硝酸银硅胶(3.5 g)+硫酸钠(2 g)。
采用废气样品,首先研究了加热对多层硅胶柱净化效率的影响,将采集到的废气样品均分为两份,分别加到多层硅胶柱上,按照下述条件进行净化处理:①130 mL正己烷、室温下淋洗;②90 mL正己烷、60℃下淋洗。
其次进行了溶剂置换效率的研究:净化完毕的样品经氧化铝柱分离后,置换成DMSO,溶剂置换效率将直接影响后续测定结果,为此通过对比净化内标回收率来验证溶剂的置换效率。将两份分别添加了净化内标的废气样品,1份按照HJ77.2-2008方法净化,另1份按照SPD-600设定的条件净化,将此净化完毕溶解在DMSO中的样品,采用液-液萃取置换成正己烷,然后进行高分辨气相色谱-高分辨质谱(HRGC-HRMS)分析,每个样品分别做3次平行实验。
1.3 自动测定仪器的原理及其与普通酶联免疫方法的比较
DXS-600是一种自动测定仪器,其原理为基于酶联免疫的结合平衡除外法。抗体的制备过程如下:将牛血清蛋白(BSA)与二英类物质结合得到的复合物(DXN-BSA)作为抗原,注射到小鼠的体内,使其在体内产生二英抗体,取出脾脏细胞与骨髓瘤细胞,然后结合制备杂交瘤细胞。以该杂交瘤细胞与废气中TEQ高相关性的异构体的结合性为指标进行筛选,再通过克隆培养,取得能与二英类产生特异性结合的抗二英类单克隆抗体细胞;测定单元中的固相抗原为2,4,5-TCP-BSA。采用标准溶液浓度系列分别进行普通酶联免疫方法和DXS-600测试,每种方法进行3次平行测试,将测得的结果进行四参数回归得出标准曲线,并对标准曲线进行比较。
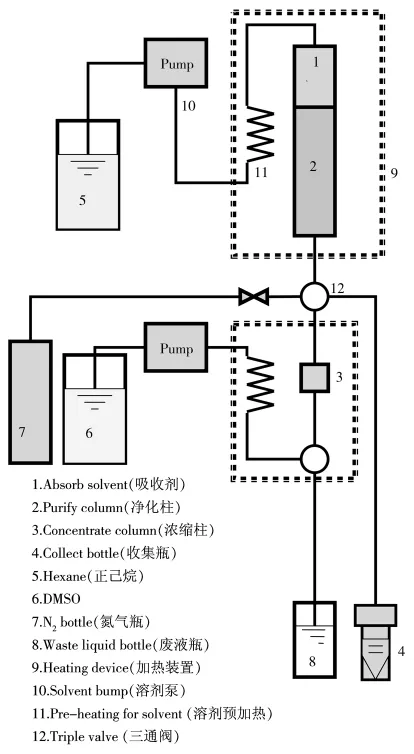
图1 样品净化和溶剂置换装置示意图Fig.1 Diagram of experimental purification and solvent substitution system
2 结果与讨论
2.1 自动前处理仪器实验条件的优化
2.1.1 加热对多层硅胶柱净化效率的影响 将在不同条件下净化完毕的样品分别进行紫外光谱分析(图2),从图2可以看出,室温下、130 mL正己烷淋洗,净化后的样品在260 nm下具有很强的吸收。这表明净化的样品中存在不饱和芳香族化合物,此类化合物中,其中一些物质具有与二英类物质相似的结构并呈现出相似的毒性,因此极易与抗体结合,影响检测结果,必须去除[17]。而60℃加热、90 mL正己烷淋洗,净化完毕的样品,在260 nm下的吸收较弱。为了得到详细的信息,将此两份样品进行气相色谱-质谱(GC-LRMS)分析(如图3)。从色谱图的对比可以看出,在加热条件下净化的样品,多环芳烃(PAH)、烷基苯(ABz)、烷基联苯类等化合物峰明显减少。而且研究表明加热后二英类化合物的出峰时间会提前,从而缩短净化时间[17]。从以上对比研究可以看出,60℃加热条件下进行净化可以提高净化效率、缩短净化时间。
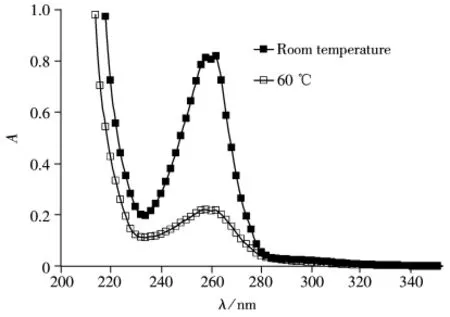
图2 在室温和60℃条件下净化后废气样品的紫外光谱图Fig.2 UV spectra of flue gas samples purified by multilayer silica gel column at room temperature and 60℃

图3 在室温和60℃条件下净化后的废气样品的GC-LR/MS图Fig.3 GC-LRMS chromatograms of flue gas samples purified by multi-layer silica at room temperature and 60℃
2.1.2 净化内标回收率的对比研究 按“1.2”的有关步骤进行了加标回收对比(见表1)。从对比结果可以看出,按照HJ77.2-2008标准分析方法人工填制的净化柱的回收率为78%~122%,相对标准偏差为1%~19%,而SPD-600的回收率为87%~107%,相对标准偏差为2%~8%。SPD-600净化分离后的样品内标回收率高于按照标准分析方法人工填制的净化柱,相对标准偏差范围也较小,很大程度上消除了人为因素的影响。同时本方法只采用90 mL正己烷淋洗,而HJ77.2-2008标准分析方法中则需用200 mL正己烷淋洗净化柱,200 mL二氯甲烷-正己烷(1∶3)以及200 mL甲苯淋洗活性炭柱。因此,SPD-600仪器使用较少的溶剂,就可使回收率满足分析要求。因此该系统完全可以满足各种生物检测方法中样品前处理的需要。
综合上述研究,确定最佳的样品处理流程如下:样品采用简化的多层硅胶柱和氧化铝柱净化,对此组合柱进行60℃加热,采用90 mL正己烷以2.5 mL/min的速率进行淋洗。最后采用0.7 mL DMSO将二英类化合物溶出,DMSO的淋洗速率为2.5 mL/min,样品制备完毕后,避光、0℃以上保存。
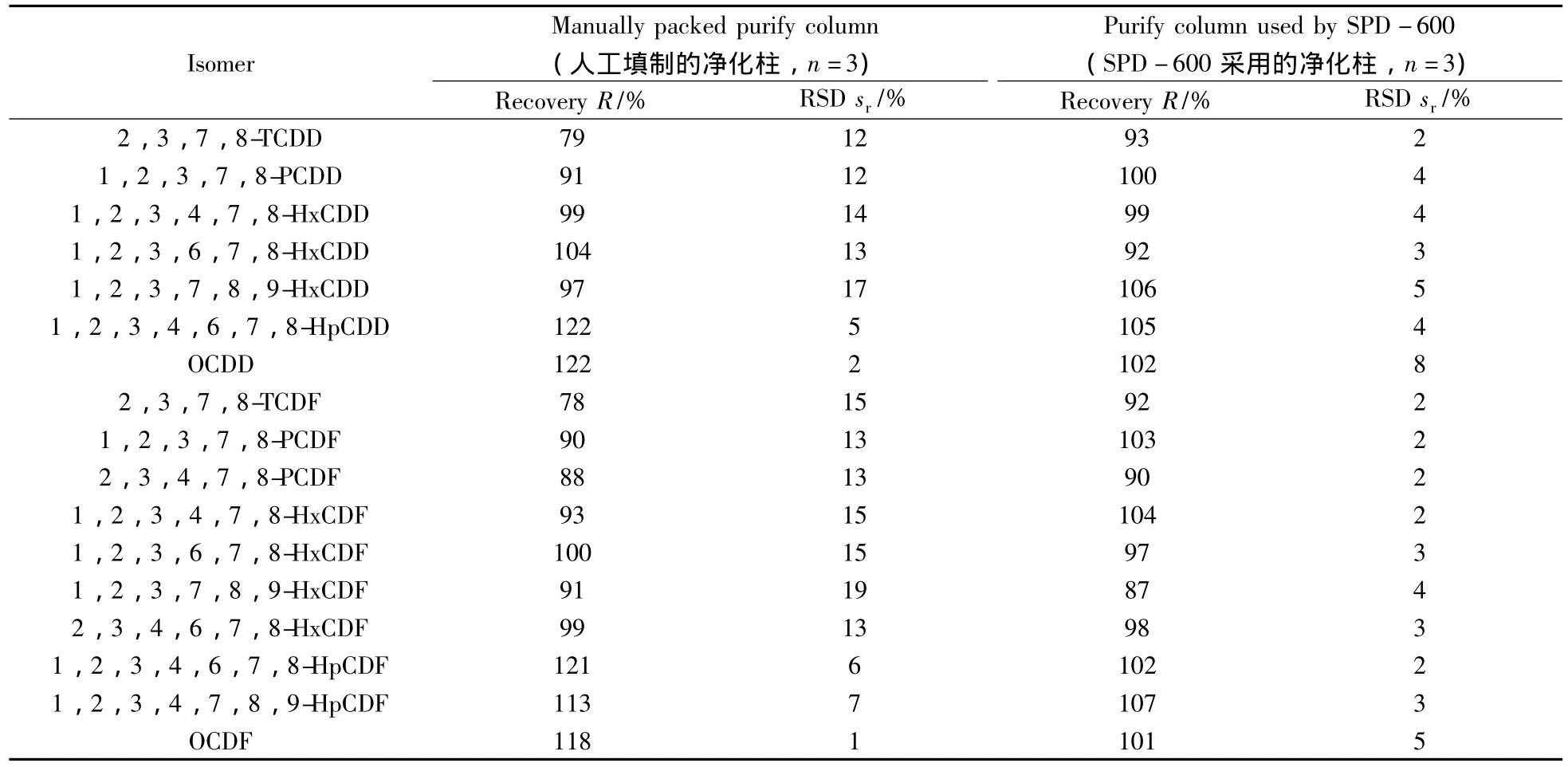
表1 人工净化柱和SPD-600净化柱回收率之间的比较Table 1 Comparison of recoveries between manually packed column and alumina column used by SPD-600
2.2 自动测定仪器
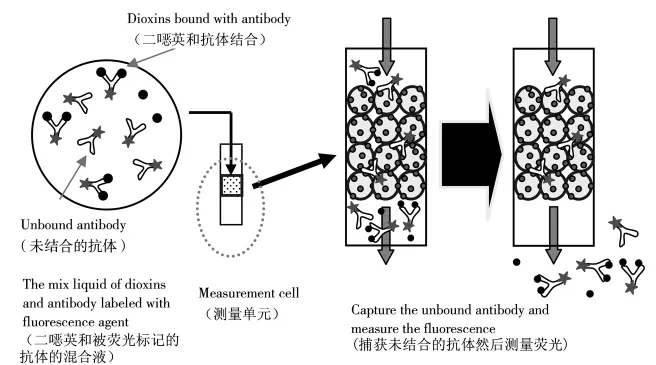
图4 测量的基本原理Fig.4 The principle of measurement
在酶联免疫方法中,标准曲线中只有直线部分是可取的。从图5两条标准曲线的对比可以看出,DXS-600曲线的直线范围比普通的酶联免疫方法大,检出下限由1.1 μg/L降低至0.025 μg/L,灵敏度提高了近40倍,同时由于DXS-600是自动测定仪器,消除了实验过程中不确定因素的影响。对比分析发现,实验结果的重现性(相对标准偏差)由8.0%~18%变为2.2%~4.8%,另外此仪器一次可测定3个样品,缩短了分析时间,可用于大批量样品的测试。

图5 DXS-600和ELISA标准曲线的比较Fig.5 Comparison of calibration curves between DXS-600 and ELISA
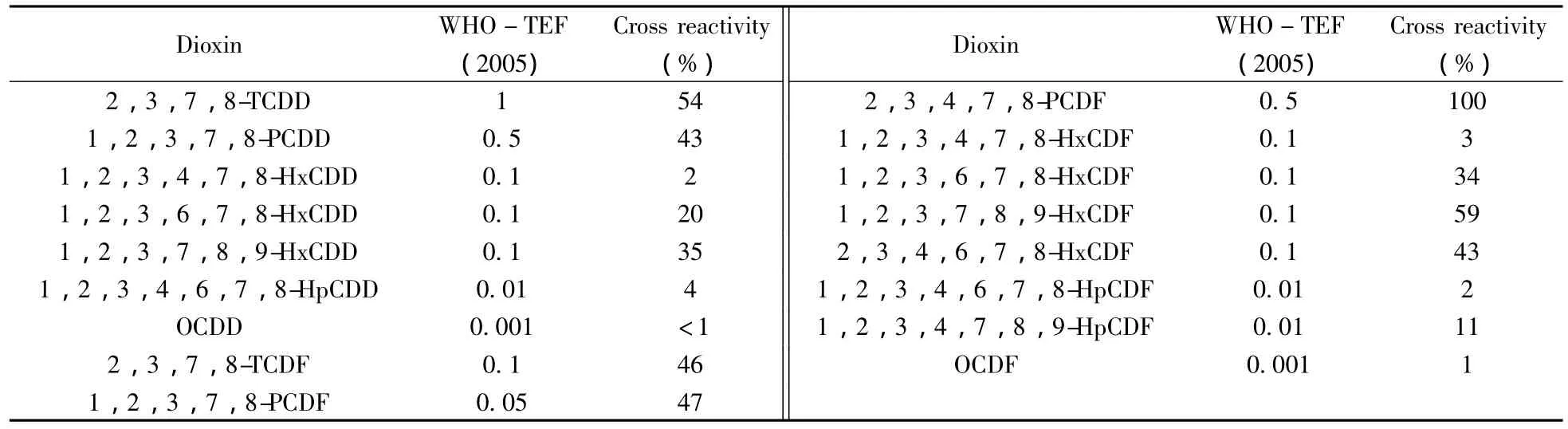
表2 WHO-TEF(2005)与交叉反应值的比较Table 2 Comparison of WHO-TEF(2005)and cross reactivity
2.3 SPD-600净化+DXS-600测定与HRGC-HRMS测定结果之间的比较
实验采用SPD-600和DXS-600联用分析了21个废弃物焚烧产生的废气样品,并将测定的结果与HRGC-HRMS进行了比较。结果表明,在一定浓度范围内此仪器组合测定的结果与HRGC-HRMS测定的结果表现出良好的线性关系,两者的换算方程为y=1.541x-1.906,r2=0.985 8。由于此仪器组合操作简单、自动化程度较高、净化时间和测定时间较短,因此在一定的使用范围内可用于二英的快速筛查。
3 结论
致谢:本研究承蒙日本京都电子株式会社立石典生、竹内义清等人员的帮助,在此表示感谢。
[1]Fernandez- Salguero P M,Hilbert D M,Rudikoff S,Ward J M,Gonzalez F J.Toxicol.Appl.Pharmacol.,1996,140:173-179.
[2]Mimura J,Yamashita K,Nakamura K,Morita M,Takagi T N,Nakao K,Ema M,Sogawa K,Yasuda M,Katsuki M,Fujii-Kuriyama Y.Genes Cells,1997,2:645-654.
[3]Poland A.Annu.Rev.Pharmacol.,1982,22:517 -542.
[4]Safe S H.Annu.Rev.Pharmacol.,1986,26:371 -399.
[5]Smith L M,Salling D L,Johnson J L.Anal.Chem.,1984,56:1830-1842.
[6]Rappe C.Environ.Sci.Technol.,1984,18:78A -90A.
[7]Liemd A K D.Trends Anal.Chem.,1999,18(6):429-439.
[8]Liemd A K D.Trends Anal.Chem.,1999,18(7):499-507.
[9]Behnisch P A,Hosoe K,Sakai S.J.Environ.Int.,2001,(27):413 -439.
[10]No.92 Bulletin,Ministry of Environmental Government of Japan,2005,http://www.env.go.jp/chemi/dioxin/manual/edr_sim - method/bio_manual.pdf.
[11]Besselink H,Jonas A,Pijnappels M,Swinkels A,Brouwer B.Organohalogen Compd.,2004,66:677-681.
[12]Matsuki T,Nakama E,Kishino J,Tokuda Y,Takagi Y,Kataoka C,Hamada N,Fujita H,Tateishi N,Sawadaishi K,Hoda K.Organohalogen Compd.,2005,67:39 -41.
[13]Ohmura N,Lackie S J,Saiki H.Anal.Chem.,2001,73(14):3392-3399.
[14]Robert C,BlakeⅡ,Diane A M.Methods in Molecular Biology,2003,248:417-430.
[15]Thomas R G,Hiroshi S,Takashi J,Yukihiro T,Naoya O,Steve J L.Biosens.Bioelectron.,2004,20:397-403.
[16]Harrison R O,Eduljee G H.Science of the Total Environment,1999,239:1-18.
[17]Vanden B M,Birnbaum L,Bosveld A T,Brunstrom B,Cook P,Feeley M,Giesy J P,Hanberg A,Hasegawa R,Kennedy S W,Kubiak T,Larsen J C,Van L F X,Liem A K,Nolt C,Peterson R E,Poellinger L,Safe S,Schrenk D,Tillitt D,Tysklind M,Younes M,Waern F,Zacharewski T.Environ.Health Perspect,1998,106:775-792.
[18]Jun K,Yoshinori T,Yoko T,Chiwa K,Hiroyuki F,Noriaki H,Kazuyuki S,Katsuhisa H.Organohalogen Compd.,2004,66:715-722.
