分散固相萃取净化超高效液相色谱串联质谱法研究茶叶与茶汤中茚虫威残留降解规律
2013-11-28张新忠罗逢健陈宗懋刘光明楼正云
张新忠,罗逢健,陈宗懋* ,刘光明,楼正云
(1.中国农业科学院茶叶研究所 农产品质量安全研究中心,浙江 杭州 310008;2.农业部茶及饮料植物产品加工与质量控制重点开放实验室,浙江 杭州 310008;3.农业部茶叶产品质量安全风险评估实验室,浙江 杭州 310008)
喷施化学农药是防治茶树病虫害最快、最有效的方法。随着科学家对茶叶中水溶性农药残留认识的日益清晰,茶园使用较多的有机磷类、吡虫啉、啶虫脒等农药,因水溶性强易在茶汤中浸出,其在茶叶中残留的安全性受到越来越多的关注[1]。近年来国家正在大力发展茶园替代农药的研究,茚虫威是其中一种对茶树假眼小绿叶蝉等有很好防治效果的低毒杀虫剂,用于替代吡虫啉等农药[2]。
茚虫威(Indoxacarb,CAS No.:144171-61-9,C22H17ClF3N3O7)化学结构式见图1A,其水溶解度小,具有触杀和胃毒作用,能阻断钠离子通道使昆虫神经细胞丧失功能,杀虫谱广对各龄期幼虫有效[3-4]。近年来已有文献报道了茚虫威在甘蓝[5]、小白菜[4,6]、棉花[7]、菜用大豆[8]等作物上的残留检测方法及消解动态研究,及其在多种动植物源食品、饲料中残留的检测方法[9-11],方法多采用气相色谱测定,亦有对茶叶中茚虫威残留检测方法的报道[9,12-14],但尚未见有关茶汤中茚虫威残留检测及其在茶园茶叶中的消解动态、最终残留的研究,以及茶叶-茶汤过程的浸出率及饮用安全性风险评估研究。目前我国大陆、国际食品法典委员会(CAC)等国家和地区组织均未制订茚虫威在茶叶中的最大残留限量(MRL)值,而欧盟和我国台湾省规定为0.05 mg/kg,日本为0.02 mg/kg[15]。因此有必要进行茶园茶叶、茶汤中茚虫威残留降解的研究,明确茚虫威在茶叶生长及饮用过程中的迁移降解规律,并进行安全性风险评估,为茚虫威在茶园的安全使用和茶叶饮用安全提供科学依据。
本文采用分散固相萃取技术净化茶叶,固相萃取柱富集净化茶汤,超高效液相色谱串联质谱法(UPLC-MS/MS)测定,建立了茶叶成茶、鲜叶和茶汤中茚虫威残留的分析方法,并利用该方法首次研究了2010~2011年150 g/L茚虫威乳油在湖南永定、福建松溪两地茶园的残留消解动态和最终残留试验,以及茚虫威在茶叶-茶汤冲泡过程的浸出率并进行相关风险评估研究。
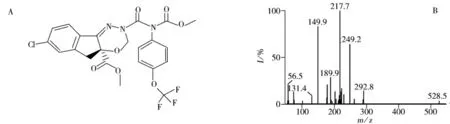
图1 茚虫威的化学结构式(A)及ESI+MS/MS质谱图(B)Fig.1 Chemical structure(A)and ESI+MS/MS spectrum(B)of indoxacarb
1 实验部分
1.1 仪器与试剂
UPLC/Quattra PremierXE超高效液相色谱三重四极杆串联质谱联用仪(UPLC-MS/MS),配有电喷雾电离(ESI)源,MassLynx 4.1质谱工作站(美国Waters公司);高速离心机(德国Sigma公司);电子分析天平(0.000 1 g和0.01 g,瑞士Mettler-Toledo公司);R-210旋转蒸发仪(瑞士Buchi公司);KQ-250DB型数控超声波清洗器(昆山市超声仪器有限公司);T-18高速均质匀浆器(德国IKA公司);DFT-200手提式高速万能粉碎机(浙江温岭市林大机械有限公司);Vortex Genie2型涡旋振荡器(美国Scientific Industries);MZ 2C型真空抽气泵(德国Vaccubrand公司);6位玻璃大体积负压固相萃取装置、0.22 μm Filter Unit滤膜(天津博纳艾杰尔科技有限公司);Bond Elut C18-SPE柱(500 mg/6 mL,美国Agilent公司)。
乙腈、甲酸、无水MgSO4、NaCl、氨水(25%~28%)(分析纯,上海试四赫维化工有限公司);甲醇(色谱纯,韩国SK Chemicals公司);纯净水(杭州娃哈哈有限公司);5%氨水乙腈:取95 mL乙腈,加入5 mL氨水配制而成;Cleanert SCX、C18-N、NH2、PSA、C18填料(40~60 μm)及 Cleanert Pesti-Carb填料(即石墨化炭黑GCB,38~124 μm)均购自天津博纳艾杰尔科技有限公司;取0.30 g C18与0.050 g GCB装至10 mL离心管制成 C18与GCB混合分散萃取管;茚虫威标准品(98%,德国Dr.Ehrenstorfer公司);150 g/L茚虫威乳油(凯恩,美国杜邦公司)。
1.2 残留实验
1.2.1 消解动态实验 在福建松溪和湖南永定两地选择长势均匀的茶园,分别于2010年、2011年的7~8月以制剂500 mL/hm2(有效成分75.0克/公顷)剂量,每亩兑水60 L,喷雾茶园茶叶1次,施药后间隔2 h(原始沉积量)、1、2、3、5、7、10、14、21 d,采用随机法15点采摘茶叶鲜叶,-18℃下存放备用,分别测定鲜叶上的茚虫威残留量,获得对应的消解动态曲线和半衰期。设3个重复,每重复小区面积为22 m2。施药前,采集茶叶样品,用作空白对照。
1.2.2 最终残留实验 在“1.2.1”的相同地点和相同时间按照制剂333.33 mL/hm2(有效成分50.0克/公顷,推荐剂量)和制剂500 mL/hm2(有效成分75.0克/公顷)两个剂量浓度,每亩兑水60 L,药液质量浓度分别为833.33 mg/L和1 250.00 mg/L,采用手动背负式喷雾器施药1~2次,每次施药间隔7 d,最后一次施药后5、7、10、14 d分别以随机法15点采摘茶叶鲜叶一芽二叶、三叶,将鲜叶按常规方法加工制成成茶,-18℃下存放备用,测定样品中茚虫威的残留量。每个处理设3个重复,每个重复小区面积为22 m2,并设空白对照。
1.2.3 成茶-茶汤冲泡过程中茚虫威残留的浸出率研究 取3份茚虫威最终残留成茶样,各称取3.00 g,按照茶叶感官评审方法标准[16]采取1∶50比例加入100℃沸水150 mL,冲泡10 min(2倍标准要求),制得茶汤,第一次冲泡后滤出茶汤,再加入100℃沸水150 mL,依次冲泡3次,分别按照“1.3.2”方法测定原始成茶样、3次冲泡所得茶汤中的茚虫威含量,计算成茶-茶汤冲泡过程中茚虫威的浸出率,进行饮用安全风险评估。
1.3 分析方法
1.3.1 检测条件 色谱条件:色谱柱Acquity UPLC BEH C18柱(100 mm×2.1 mm,1.7 μm);柱温40℃;进样量5 μL;样品盘温度8℃;流量0.20 mL/min;采用0.10%甲酸甲醇-水(2∶98,体积比)溶液(A)和0.10%甲酸的乙腈溶液(B)组成的流动相进行梯度洗脱,洗脱程序:0→1.0min,40%A保持1 min;1.0→3.0 min,40% A→10.0% A;3.0→5.5 min,10.0% A→5.0% A;5.5→8.1 min,5.0%A→1.0%A;8.1→8.2 min,1.0%A→40%A,然后保持1.8 min。茚虫威保留时间为3.98 min。
质谱条件:电喷雾正电离模式多反应监测扫描方式,ESI+-MRM;电喷雾电压2.5 kV;离子源温度120℃;脱溶剂气温度300℃;锥孔反吹气N2,流速50 L/h;脱溶剂气N2,流速500 L/h;碰撞气Ar,流速0.15 mL/min;倍增电压650 V;二级质谱母离子驻留时间0.100 s;锥孔电压25 V;定量离子对:母离子m/z 528,子离子m/z 150,碰撞裂解电压35 V;定性离子对:母离子m/z 528,子离子m/z 218,碰撞裂解电压30 V。
1.3.2 提取净化 茶鲜叶、成茶:分别称取磨碎后的样品鲜叶10.00 g(成茶5.00 g),置于100 mL塑料离心管中,加10 mL水涡旋混合均匀,10 min后,加入10 mL 5%氨水乙腈涡旋混匀,浸泡过夜,超声15 min,加入5 g NaCl混匀,均质1 min,5 000 r/min离心5 min,分取上层乙腈层4 mL至装有0.30 g C18+0.05 g GCB的10 mL离心管中,混匀涡旋1 min,5 000 r/min离心5 min,过0.22 μm滤膜,UPLC-MS/MS进样5 μL,基质外标法测定。
茶汤:称取茶叶3 g,按照茶叶感官评审方法标准[16]以1∶50比例加入沸水150 mL,冲泡10 min(2倍标准要求),制得茶汤,待冷却后,分取100 mL茶汤上样至Bond Elut C18-SPE柱,5 mL水-甲醇(7∶3)淋洗,抽干5 min,加入20 mL甲醇洗脱,接收洗脱液浓缩近干,加入1 mL甲醇-水(9∶1)超声溶解,涡旋混匀,过0.22 μm滤膜,UPLC-MS/MS进样5 μL,基质外标法测定。
1.3.3 标准溶液配制与标准曲线 称取0.010 0 g茚虫威标准品至烧杯中,乙腈溶解并转移至50 mL容量瓶,定容,配制成200 mg/L的标准储备液,于-18℃下避光保存。将储备液用乙腈稀释成20.0、5.0、1.0、0.5、0.1、0.05、0.01 mg/L系列标准工作溶液,UPLC-MS/MS进样5 μL测定,以浓度为横坐标(X),峰面积为纵坐标(Y),获得茚虫威的标准曲线、相关系数及仪器检出限。
1.3.4 加标回收率与精密度 称取经测定不含茚虫威的茶鲜叶(成茶、茶汤)空白样品,分别添加0.1、1.0、20.0 mg/L(茶汤为0.04、0.40、4.0 mg/L)的标准溶液1.0 mL,涡旋混匀后放置过夜12 h(茶汤为30 min)以更接近于实际样品农药残留情况,然后按照“1.3.2”方法加入水和乙腈进行提取与净化,每个加标浓度重复5~6次;同时将按照“1.3.2”处理后得到的空白茶鲜叶(成茶、茶汤)样品溶液,加入相应浓度的标准溶液后定容,作为基质标准进行测定,计算加标回收率、相对标准偏差及方法定量下限。
2 结果与讨论
2.1 色谱质谱条件优化
已有文献对蔬菜、水果和土壤中的茚虫威残留分析时,多采用 GC/ECD[4,6-11,17]、GC - SIM/MS[18]和 HPLC[19]方法,较少采用 LC - MS/MS[17,20]或 UPLC - MS/MS[5]。茶叶基质复杂,研究时常采用色谱质谱分析[12-14],本文采用UPLC-ESI+MS/MS对茚虫威进行分析,优化了锥孔电压和喷雾电压,得到准分子离子峰[M+H]+(m/z 528),对准分子离子峰进行二级质谱子离子扫描,得到碎片离子信息,优化碰撞裂解能量,20 V碰撞电压下茚虫威的ESI+MS/MS质谱图见图1B,最终的优化条件见“1.3.1”,选择子离子m/z 150作为定量离子,m/z 218用来辅助定性,分别表示准分子离子可能经过断裂生成(m/z 262)之后,再经过六元过渡态重排、中心丢失后而生成的碎片离子(m/z 218)和(m/z 150)。
研究中以BEH C18色谱柱和保留能力更强的HSS T3色谱柱进行分析,由于茚虫威本身保留较强,分析时采用BEH C18色谱柱即能获得很好的效果,因此最终选择BEH C18色谱柱用于茚虫威分离,选择0.10%甲酸/甲醇-水(2∶98)、0.10%甲酸/乙腈溶液作为流动相,其中流动相中添加甲酸有助于样品的离子化。
2.2 前处理方法优化
文献[5]的研究结果表明,相对于乙酸乙酯、二氯甲烷和丙酮对蔬菜中茚虫威残留的提取效果,用乙腈提取的回收率最好,且引入杂质较少。前期研究[21]亦表明,乙腈比丙酮更适合茶叶中茚虫威残留提取,而且采用5%氨化乙腈溶液,还可降低茶叶中茶多酚、咖啡碱的影响。
分散固相萃取净化技术在样品前处理方面具有快速、简单、便宜、高效等优点,近年来在茶叶农药残留检测中的应用增多[22-24],净化吸附填料多采用PSA和GCB,同时加以MgSO4吸附残余水分。本研究中考察了0.30 g不同填料(SCX、C18、C18-N、NH2、PSA)、0.20 g GCB、0.50 g MgSO4对1 mL 0.10 mg/L茚虫威标准溶液(乙腈溶剂)的吸附效果,回收率分别为107%、101%、103%、110%、98%、21%、107%;当茚虫威浓度降低为0.020 mg/L时,分别采用0.20 g SCX、C18、C18-N、NH2、PSA和0.10 g GCB填料进行实验,回收率分别为89%、96%、93%、99%、110%和54%,除GCB和SCX外,均有较好的回收效果。考虑到后续采用BEH C18色谱柱进行分析,为减少色谱柱的负载,采用C18填料作为净化吸附剂,并加入GCB除去色素类杂质。本实验最终采用0.30 g C18与0.05 g GCB填料混合净化4 mL提取液,获得了较好的萃取效果。
2.3 标准曲线、灵敏度、回收率与精密度
在优化条件下,考察了方法的线性关系,结果显示,在0.01~20.0 mg/L质量浓度范围内,茚虫威的线性方程为Y=8 723.6X+4 333.9,相关系数r为0.993 7,该方法对茚虫威的检出限为0.025 ng。图2A为0.010 mg/L茚虫威标准溶液的色谱图。
按照“1.3.4”进行加标回收率实验,同时配制相应浓度的基质标准溶液进行定量,回收率和相对标准偏差(RSD)结果见表1。结果显示,茚虫威在低、中、高加标浓度下,平均回收率为96%~107%,RSD为1.3%~7.8%,其中成茶中平均回收率为102%~107%,RSD为4.4%~7.8%;鲜叶中平均回收率为102%~103%,RSD为1.7%~4.4%;茶汤中平均回收率为96%~103%,RSD为1.3%~4.1%。本方法中茚虫威在茶鲜叶、成茶中的定量下限为5 μg/kg,茶汤中的定量下限为0.10 μg/L。图2B~C为加标样品的色谱图。
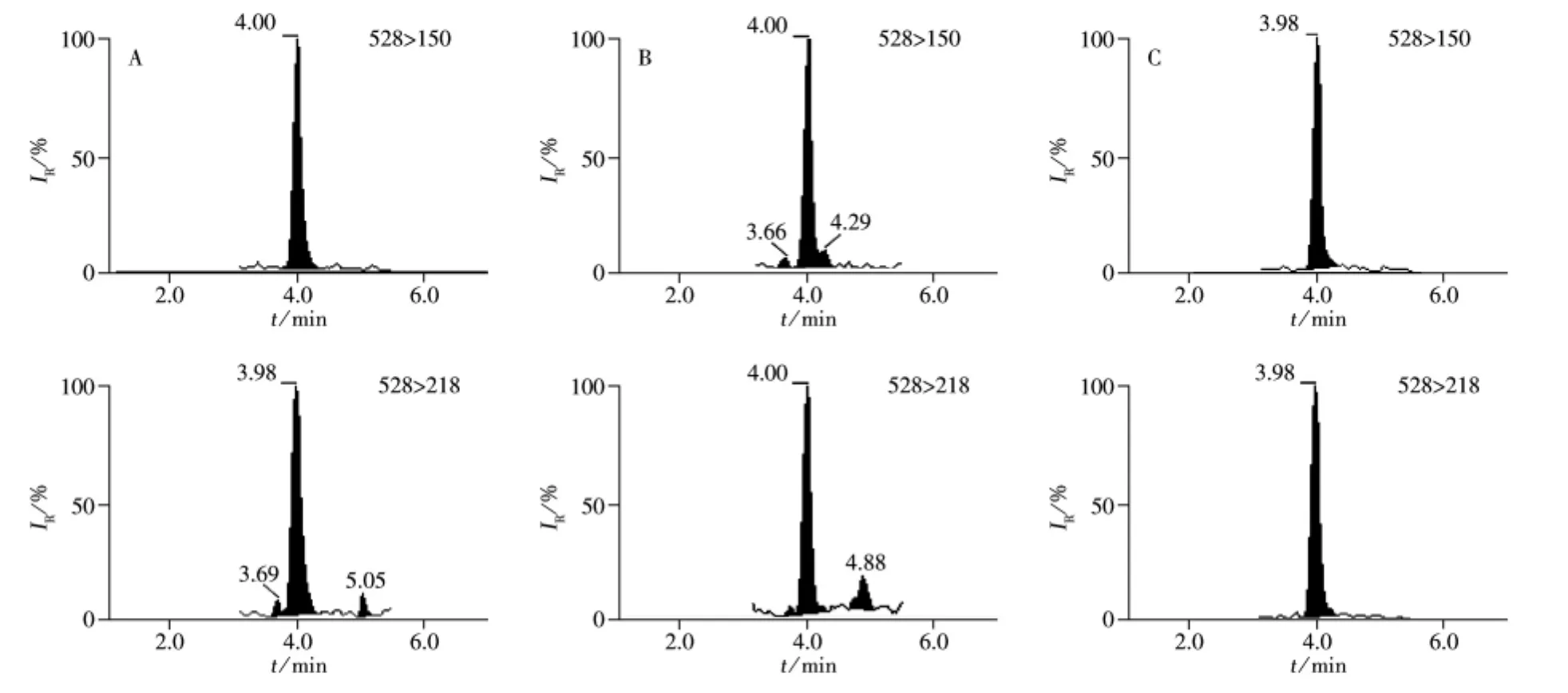
表1 茚虫威在茶鲜叶、成茶和茶汤中的加标回收率、相对标准偏差及定量下限Table 1 Spiked recoveries,relative standard deviations(RSDs)and limits of quantitation(LOQs)of indoxacarb in fresh tea leaves,made tea and tea infusion
2.4 茚虫威在茶鲜叶上的消解动态
按照“1.2.1”进行150 g/L茚虫威乳油在茶鲜叶上的消解动态试验,依照“1.3”测定鲜叶中茚虫威的残留量,结果见表2。结果表明:喷药7 d后,消解率均达到90%以上;2010年茚虫威在湖南永定和福建松溪茶园茶鲜叶上的消解动态方程分别满足方程y=10.960 5e-0.3663x和y=11.938 1e-0.4895x,相关系数r分别为0.941 6和0.991 0,半衰期分别为1.89 d和1.42 d;2011年茚虫威在湖南永定和福建松溪茶园茶鲜叶上的消解动态方程分别为y=4.167 4e-0.2803x和y=1.761 1e-0.4284x,相关系数r分别为0.958 6和0.974 0,半衰期分别为2.47 d和1.62 d。两年两地试验表明茚虫威在茶园鲜叶上的半衰期为1.42~2.47 d,属于易降解农药。
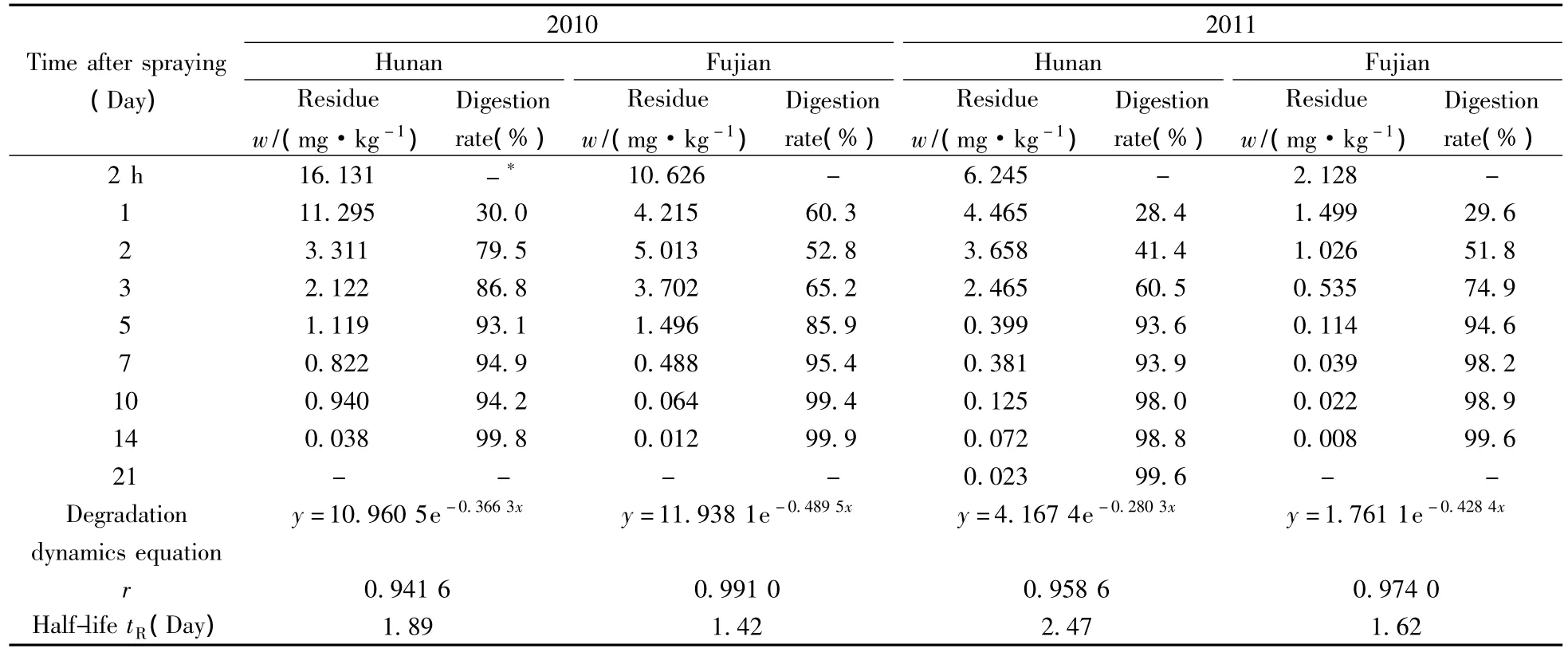
表2 150 g/L茚虫威乳油在茶鲜叶上的消解动态平均值数据Table 2 The average dynamic degradation data of 150 g/L indoxacarb emulsifiable concentrates in fresh tea leaves
2.5 茚虫威在成茶茶叶中的最终残留结果
按照“1.2.2”进行150 g/L茚虫威乳油在成茶茶叶中的最终残留试验,依照“1.3”分析测定成茶中茚虫威的残留量,数据结果见表3。数据显示,按照推荐剂量制剂333.33 mL/hm2(有效成分50.0克/公顷)施药1次,间隔5 d后成茶中茚虫威残留量为0.918~2.520 mg/kg,7 d后残留量为0.389~1.173 mg/kg,10 d后残留量为0.028~0.319 mg/kg,14 d后残留量为0.019~0.096 mg/kg;施药2次,间隔5 d后成茶中茚虫威残留量为0.956~6.884 mg/kg,7 d后残留量为0.447~2.611 mg/kg,10 d后残留量为0.074~1.973 mg/kg,14 d后残留量为0.010~0.219 mg/kg。
按照高剂量(1.5倍推荐剂量)制剂500 mL/hm2(有效成分75.0克/公顷)施药1次,间隔5 d后成茶中茚虫威残留量为0.874~3.193 mg/kg,7 d后残留量为0.518~1.490 mg/kg,10 d后残留量为0.153~0.561 mg/kg,14 d后残留量为0.012~0.165 mg/kg;施药2次,间隔5 d后成茶中茚虫威残留量为0.804~5.004 mg/kg,7 d后残留量为0.425~2.908 mg/kg,10 d后残留量为0.103~2.236 mg/kg,14 d后残留量为0.011~0.391 mg/kg。
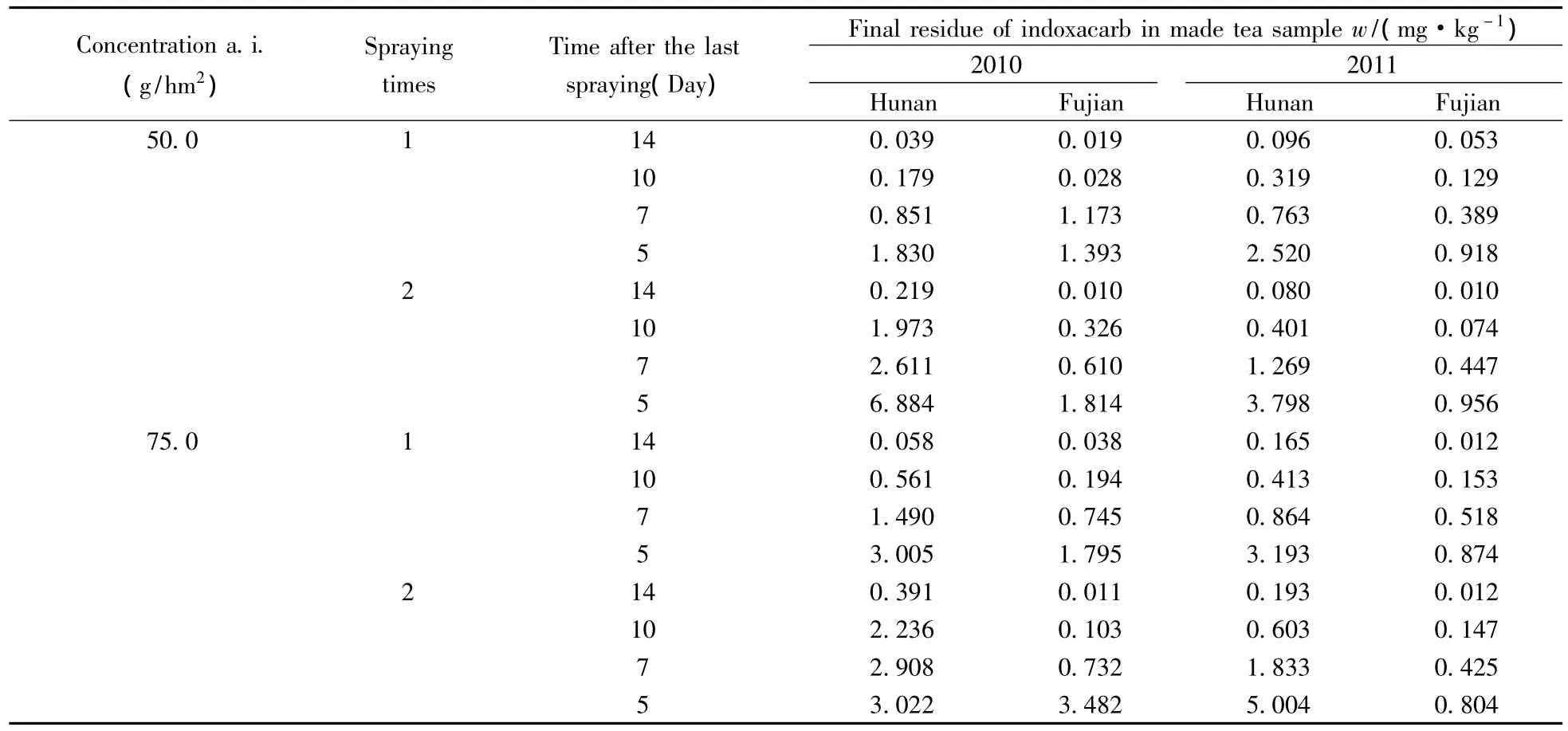
表3 150 g/L茚虫威乳油在茶叶成茶上的最终残留试验结果Table 3 Final residues of 150 g/L indoxacarb emulsifiable in made tea
实验表明,按照推荐剂量和1.5倍推荐剂量施药1~2次,10 d后成茶茶叶中的茚虫威残留量均小于3 mg/kg。
2.6 茚虫威在成茶-茶汤冲泡过程中的浸出率
取3份田间最终残留试验成茶样(整叶样),并将其部分粉碎后得“碎末样”,分别按照“1.2.3”制得茶汤,按照“1.3.2”测定成茶样和茶汤中的茚虫威残留量,计算成茶-茶汤中茚虫威的浸出率,结果见表4。其中“整叶样”第1次浸出率为1.8%~2.6%,第2次浸出率为1.4%~1.7%,第3次浸出率为1.0%~1.6%,3次总浸出率为4.3%~5.7%,平均值为5.2%; “碎末样”第1次浸出率为6.6%~7.5%,第2次浸出率为1.0%~1.6%,两次总浸出率为8.2%~8.8%,平均值为8.4%;茶叶整碎程度对浸出率存在一定影响,随着浸泡次数增多,总浸出率加大,但逐次浸出率降低。由此可见茚虫威在茶叶-茶汤冲泡中浸出率较低,总浸出率小于10%,难浸泡出农药,茶叶冲泡后,超过90%的茚虫威残留仍然残存在茶渣中,不会影响人体饮用安全。
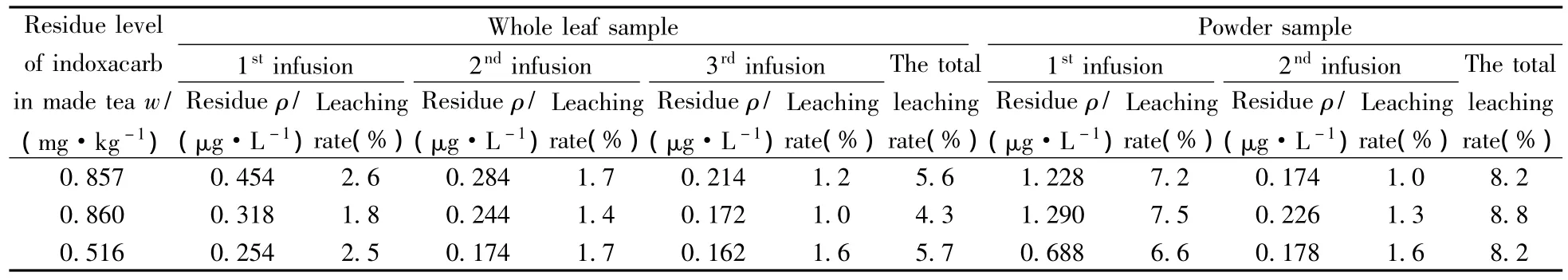
表4 茚虫威在成茶-茶汤冲泡过程中的浸出率数据Table 4 The leaching rate data of indoxacarb during the brewing process from made tea to tea infusion
2.7 茶叶中茚虫威残留饮用安全性风险评估
目前,欧盟、日本和我国台湾省虽然设定有茶叶中茚虫威残留量的MRL值标准,但上述三地区的MRL值均为未在茶树上进行残留试验和风险评估情况下而采用的“一律标准”。CAC暂无茶叶中茚虫威残留量的MRL标准,但规定其在结球甘蓝中的残留为3 mg/kg,花椰菜中为0.20 mg/kg,番茄中为0.50 mg/kg,茄子中为0.50 mg/kg,莴苣茎中为7 mg/kg,莴苣叶中为15 mg/kg。根据150 g/L茚虫威乳油在茶叶上的最终残留试验,喷药后间隔10 d,成茶中茚虫威残留量为0.028~2.236 mg/kg。假定以3.00 mg/kg值设定为茶叶中的MRL标准,考虑到饮茶时,只饮用茶汤,不会食用茶渣的特殊性,故引入泡茶时农药最大浸出率来计算人体最大摄入量为:
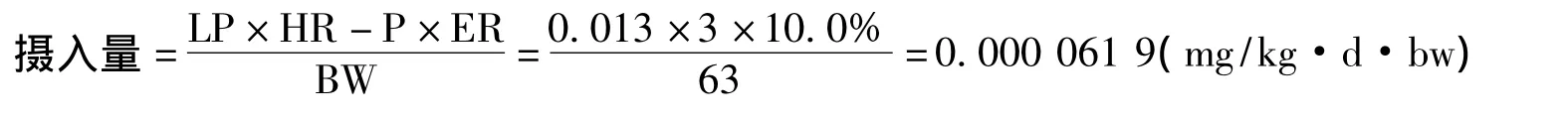
其中LP为世界上每人每天饮用茶叶的最高数量(13 g/d=0.013 kg/d);HR-P为理论上应该取假定安全间隔期10 d的成茶中最高残留量2.236 mg/kg,此处按照建议MRL值3 mg/kg计算;BW为成人平均体重(63 kg);ER为泡茶时农药最大浸出率(整叶和碎末浸出率均小于10.0%,故以10.0%计算)。
计算获得人体最大摄入量为0.000 061 9 mg/kg·d·bw,该值仅为茚虫威ADI值(0.01 mg/kg·d·bw[25])的0.619%,说明当采用3 mg/kg作为茚虫威在茶叶中的MRL值时,人体饮用安全系数高达161.5,因此可认为茚虫威在茶叶中的MRL值为3 mg/kg是安全的。150 g/L茚虫威乳油施药剂量为制剂240.00~333.33 mL/hm2(即有效成分36.0~50.0克/公顷),施药1次,安全采摘期为10 d。
3 结论
本文利用分散固相萃取净化茶叶、固相萃取富集净化茶汤,超高效液相色谱串联质谱法建立了茶叶、茶汤中茚虫威残留的分析方法,首次研究了150 g/L茚虫威乳油在茶园茶叶中的残留降解规律,并对茚虫威在茶叶-茶汤浸泡过程中的浸出率和饮用安全性进行风险评估。结果表明按照风险评估制定茶叶中茚虫威残留量MRL值为3 mg/kg对人体饮用是安全的,人体摄入的茚虫威残留量仅占每日允许摄入量(ADI)的0.619%。
[1]Chen Z M.Agricultural Quality&Standards(陈宗懋.农产品质量与安全),2011,3:5-7.
[2]Peng P,Wang X Q,Lin Q,Huang S J,Hu X,Tang M.Tea Commun.(彭萍,王晓庆,林强,黄尚俊,胡翔,唐敏.茶叶通讯),2010,37(1):27-28.
[3]Ding N,Meng Q W,Zhao W J,Miao W R.Chin.J.Pestic.Sci.(丁宁,孟庆伟,赵伟杰,苗蔚荣.农药学学报),2005,7(2):97-103.
[4]Gong Y,Li Y S.Pesticide Science and Administration(龚勇,李友顺.农药科学与管理),2005,26(5):11-14.
[5]Jiang B W.Food Sci.(江滨炜.食品科学),2009,30(10):176-178.
[6]Chen L P.Agrochemicals(陈丽萍.农药),2008,47(8):593-594.
[7]Dong F S,Zheng Y Q,Sha X Y,Li S,Yao J R.J.Agro-environ.Sci.(董丰收,郑永权,沙宪英,李硕,姚建仁.农业环境科学学报),2005,24(5):1027-1031.
[8]Chen L P,Guo J H,Cai E X,Zhang W D.Chin.J.Pestic.Sci.(陈丽萍,郭建辉,蔡恩兴,张维德.农药学学报),2008,10(4):443-449.
[9]Yang F,Xu D M,Lu S Y,Lin Y H,Liu Z C,Yu K J,Lan J C,Chen G N.Food Sci.(杨方,徐敦明,卢声宇,林永辉,刘正才,余孔捷,蓝锦昌,陈国南.食品科学),2008,29(12):519-561.
[10]Li A J,Lu L J,Wang M T,Lu C M,Zhang X Z,Yao T L.Feed Res.(李爱军,卢利军,王明泰,卢春梅,张秀珍,姚天玲.饲料研究),2008,5:46-47.
[11]Zhu L P,Zhu T,Pan Y X,Sun J,Dong J.Chin.J.Anal.Chem.(朱莉萍,朱涛,潘玉香,孙军,董静.分析化学),2008,36(7):999-1003.
[12]Huang Z Q,Zhang Y,Wang L B,Ding L,Wang M L,Yan H F,Li Y J,Zhu S H.J.Sep.Sci.,2009,32:1294-1301.
[13]GB/T 23205-2008.Determination of 448 Pesticides and Related Chemicals Residues in Tea——LC -MS-MS Method.National Standards of the People s Republic of China(茶叶中448种农药及相关化学品残留量的测定——液相色谱-串联质谱法.中华人民共和国国家标准).
[14]Chen G Q,Cao P Y,Liu R J.Food Chem.,2011,125(4):1406 -1411.
[15]http://db.foodmate.net/pesticide/index.php.(食品伙伴网-食品数据库-农兽药数据库查询).
[16]GB/T 23776 -2009.Methodology of Sensory Evaluation of Tea.National Standards of the People s Republic of China(茶叶感官评审方法.中华人民共和国国家标准).
[17]Xu D M,Yang F,Lu S Y,Lan J C,Yu K J,Cai C P,Liu X J.Agric.Sci.China,2008,7(10):1228-1234.
[18]Liu Y B,Zhang M X,Xue R F.Chem.Res.Appl.(刘永波,张明霞,薛瑞芳.化学研究与应用),2011,23(9):1269-1272.
[19]Zhao P J,Li Z M,Deng L G,Mao J S,Zhao S C.Agrochemicals(赵平娟,李增梅,邓立刚,毛江胜,赵善仓.农药),2006,45(11):758-759.
[20]Lesueur C,Knittl P,Gartner M,Mentler A,Fuerhacker M.Food Control,2008,19:906-914.
[21]Zhang X Z,Luo F J,Chen Z M,Lou Z Y,Liu G M,Wang F,Wu L C.Chin.J.Anal.Chem.(张新忠,罗逢健,陈宗懋,楼正云,刘光明,王方,吴鲁超.分析化学),in accepted.
[22]Xu J,Chen J,Ye H Y,Wang L,Sun L H,Lai Z F.J.Instrum.Anal.(徐娟,陈捷,叶弘毅,王岚,孙灵慧,赖子峰.分析测试学报),2011,30(9):990-995.
[23]Zhang X Z,Luo F J,Liu G M,Lou Z Y,Chen Z M.Chin.J.Anal.Chem.(张新忠,罗逢健,刘光明,楼正云,陈宗懋.分析化学),2011,39(9):1329-1335.
[24]Ye J L,Jin G E,Zhuang W E,Zheng W H,Wu Y H.Chin.J.Anal.Lab.(叶江雷,金贵娥,庄婉娥,郑文慧,吴云辉.分析试验室),2011,30(10):115-119.
[25]Pesticide Residues in Food-2005 JMPR Report.http://www.fao.org/docrep/009/a0209e/a0209e07.htm.
