高效液相色谱-串联质谱法同时测定饲料中氯霉素、甲砜霉素与氟甲砜霉素残留量
2013-11-28魏云计朱臻怡王小晋
冯 民,魏云计*,朱臻怡,何 健,王小晋,柳 菡,丁 涛,吴 斌
(1.淮安出入境检验检疫局,江苏 淮安 223001;2.江苏出入境检验检疫局动植物与食品检测中心,江苏 南京 210001)
氯霉素、甲砜霉素和氟甲砜霉素属于氯霉素类抗生素,因对革兰氏阴性菌和革兰氏阳性菌具有很强的活性,而表现出广谱的抗菌能力,广泛地应用于动物养殖业。由于这些氯霉素类抗生素能导致人体产生再生障碍性贫血和溶血性贫血等毒副作用[1],欧盟、美国等先后将其定为禁用药物,不得用于畜牧养殖业中,且动物源性食品中氯霉素的最高残留限量为0.1~0.3 μg/kg,甲砜霉素和氟甲砜霉素的最高残留限量一般为50~100 μg/kg。虽然它们在动物体内残留量低,但毒副作用依然存在。饲料一般是兽药添加的主要载体,开展饲料中氯霉素类药物检测是从源头进行控制的有效方法,因此研究饲料中氯霉素类药物检测的方法具有重要意义。
目前国内外关于氯霉素类药物的残留检测方法已很成熟,主要采用酶联免疫法[2-4]、高效液相色谱法[5-7]、气相色谱 -质谱法[8-10]和液相色谱 -串联质谱法[11-16]。由于饲料的组成成分复杂、基质干扰较大,针对其氯霉素、甲砜霉素和氟甲砜霉素残留量同时检测的液相色谱-串联质谱法国内尚未见报道。本文利用液相色谱-串联质谱的高选择性和强抗干扰能力等特点,建立了饲料中氯霉素、甲砜霉素和氟甲砜霉素残留的快速定性定量方法,能满足饲料进出口检测和国家药物残留监控的要求。
1 实验部分
1.1 仪器与试剂
Thermo Finngan TSQ Quantum Ultra EMR串联质谱仪,配有电喷雾离子源(ESI);C18柱(150 mm×2.1 mm i.d.,3.5 μm,Agilent公司)。
甲醇为色谱纯;乙酸乙酯、正己烷、丙酮、磷酸氢二钾、磷酸二氢钾、氯化钠均为分析纯;氯霉素、甲砜霉素、氟甲砜霉素标准品均购自Dr.Ehrenstorfer GmbH,纯度≥98%;氘代氯霉素(Chloramphenicol-D5)购自WITEGA Laboratorien Beelin-Adlershof GmbH,用甲醇溶解并配制成1.0 g/L标准储备液,再根据需要稀释成适当浓度的混合标准工作液,4℃避光保存;实验用水均为去离子水。
1.2 样品前处理
1.2.1 样品提取 称取(1.00±0.05)g饲料于50 mL具塞离心管中,准确加入50 μL 100 μg/L氯霉素-D5内标溶液,加入4 mL 0.5 mol/L pH 7.0磷酸盐缓冲液,于涡旋混合器上混匀30 s后静置15 min待饲料浸润,加入10 mL氨化乙酸乙酯(乙酸乙酯-25%氨水,98∶2),于涡旋混合器上快速混匀30 s,超声波提取10 min;以8 000 r/min离心5 min,转移上层有机溶液至50 mL梨形瓶中,于45℃水浴中减压浓缩至干,加入4 mL 4%氯化钠溶液使之充分溶解,待净化。
1.2.2 净 化 上述溶液用5 mL正己烷净化脱脂,离心后弃去正己烷层;水层加入8 mL丙酮,离心后转移上清液于50 mL具塞离心管中,加入10 mL二氯甲烷,涡旋30 s;以8 000 r/min离心5 min,转移下层有机溶液至50 mL梨形瓶中,于45℃水浴中减压浓缩至干,用1 mL甲醇-水(2∶8)溶解残留物,经0.45 μm滤膜过滤,滤液供液相色谱-串联质谱仪测定。
1.3 液质联用仪分析条件
色谱条件:色谱柱:Agilent ZORBAX SB-C18柱(150 mm×2.1 mm i.d.,3.5 μm);流动相:A为甲醇,B为水;流速:250 μL/min;进样量:25 μL;线性梯度洗脱程序:0~4.0 min,30%A;4.0~6.0 min,30%~90%A;6.0~6.5 min,90%~30%A;6.5~8.0 min,30%A;柱温:30℃。
质谱条件:采用电喷雾离子源(ESI),负离子扫描,喷雾电压2 500 V,源内诱导解离电压10 V,多反应监测(MRM)方式检测,其他质谱条件见表1。
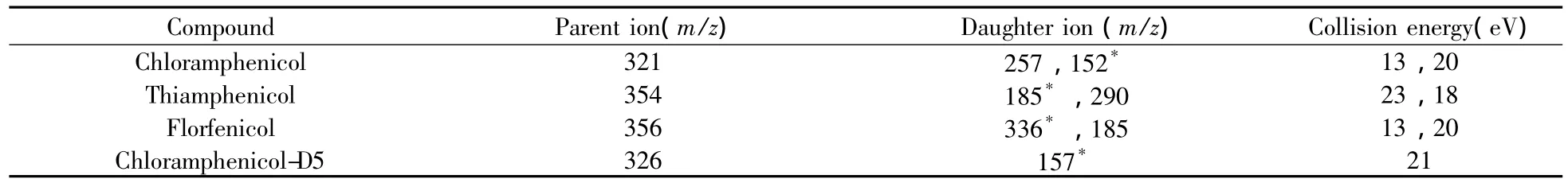
表1 氯霉素、甲砜霉素和氟甲砜霉素优化的质谱条件Table 1 The optimized MS-MS conditions for chloramphenicol,thiamphenicol and florfenicol
2 结果与讨论
2.1 质谱条件的优化
为降低高浓度氯霉素类药物残留对仪器的干扰,提高检测灵敏度,采用流动相注射分析方法进行质谱条件的优化。流动相为甲醇-水(80∶20),流速200 μL/min,蠕动泵注入1.0 mg/L混合标准溶液,流速为2 μL/min,通过“T”三通连接,六通阀控制流动相切入/切出质谱检测器;负离子模式下进行母离子全扫描,找出准确母离子峰,通过调节喷雾电压和吹扫气流优化母离子的灵敏度和稳定性,并对其子离子进行全扫描,找出丰度较强的碎片离子,以母离子和子离子组成监测离子对,以MRM模式对待测物进行定性和定量分析。选择丰度最强,并且色谱峰无干扰的碎片离子组成监测离子对,m/z 321/152、m/z 354/185和m/z 356/336分别用于氯霉素、甲砜霉素和氟甲砜霉素的定量分析,其它离子对则分别用于定性分析;内标氘代氯霉素定性离子对为m/z 326/157。

图1 不同提取溶剂时氯霉素、甲砜霉素和氟甲砜霉素的回收率Fig.1 Recoveries of chloramphenicol,thiamphenicol and florfenicol using different extraction solvents
2.2 提取条件的优化
氯霉素类药物属于弱极性物质,易溶于甲醇、乙腈、丙酮、乙酸乙酯等有机溶剂,可以通过这些溶剂进行提取。乙酸乙酯对氯霉素、甲砜霉素和氟甲砜霉素的提取效率最高,适合于动物组织样品的提取,有文献[17]报道碱化乙酸乙酯对虾等水产品有更好的回收率。由于饲料含有大量的脂肪、蛋白质、纤维素、矿物质等复合组分,本研究比较了乙腈、丙酮、乙酸乙酯以及分别经1%、2%、3%、4%氨水碱化乙酸乙酯的提取效率(见图1)。实验结果表明,当采用2%氨水碱化乙酸乙酯进行提取时,3种药物的提取效率及稳定性最好,随着氨水比例的进一步提高,其提取效率无明显提高且对提取甲砜霉素的干扰增大,因此选用2%碱化乙酸乙酯为最佳提取溶剂。饲料样品的水分很少,在提取前充分润湿有利于目标物的提取,本实验采用磷酸盐缓冲液润湿饲料,可达到沉淀蛋白质,减少氯霉素类药物与蛋白质结合,提高回收率的效果。
2.3 样品的净化
碱化乙酸乙酯的提取效率虽高,但提取的非极性脂溶物较多,基质干扰较大,需要进一步净化。文献[17]以甲醇和4%氯化钠溶液溶解目标物,正己烷净化脱脂两次,乙酸乙酯进行液-液分配萃取净化,取乙酸乙酯层浓缩至干,用0.05%醋酸溶液溶解后再过C18固相萃取柱净化。本研究结合液相色谱-串联质谱强选择性和抗干扰能力的特点,用4 mL 4%氯化钠溶液溶解目标物,5 mL正己烷净化脱脂,除去正己烷层,加入8 mL丙酮离心,除去变性蛋白质后,再加入10 mL二氯甲烷进行液-液分配萃取净化。通过对比文献[17]发现本方法可有效去除基质干扰,省去固相萃取过程,缩短样品前处理时间,空白样品的加标回收率为77%~108%,可满足实验要求。
2.4 线性范围、检出限与定量下限
配制6个不同质量浓度的标准溶液,溶液中氯霉素、氟甲砜霉素的质量浓度为0.2、0.5、1.0、2.0、5.0、10.0 μg/L,甲砜霉素的质量浓度为1.0、2.5、5.0、10.0、25.0、50.0 μg/L,氘代氯霉素-D5的质量浓度为5.0 μg/L,在优化实验条件下进样分析,测定其峰面积,以质量浓度为横坐标,峰面积比值(氯霉素峰或甲砜霉素或氟甲砜霉素的面积/氘代氯霉素-D5面积)为纵坐标,绘制标准曲线,各化合物的回归方程、相关系数如表2所示。在空白饲料基质中添加混合标准品,以信噪比(S/N)≥3计算方法的检出限(LOD);以信噪比(S/N)≥10计算方法的定量下限(LOQ),3种化合物的检出限和定量下限见表2。其相应的MRM色谱图见图2A,标准溶液的MRM色谱图见图2B。

表2 3种抗生素药物的回归方程、相关系数(r2)、检出限和定量下限Table 2 Linear equations,correlation coefficients(r2),limits of detection(LOD)and limits of quantitation(LOQ)of three antibiotic drugs

图2 加标饲料(A)及3种抗生素药物标准溶液(B)的MRM色谱图Fig.2 Multiple reaction monitoring(MRM)chromatograms of spiked feed sample(A)and three antibiotic drugs standard solution(B)
2.5 回收率与精密度
选取阴性饲料样品,添加3种氯霉素类标准品和内标,氯霉素、氟甲砜霉素的加标水平为0.3、1.0、5.0 μg/kg,甲砜霉素的加标水平为 1.5、5.0、25.0 μg/kg,氘代氯霉素-D5的加标水平为5.0 μg/kg,每个加标水平做5次平行,结果见表3。结果显示,待测物的加标回收率为77%~108%,相对标准偏差为5.4%~10.9%。

表3 饲料样品中氯霉素、甲砜霉素和氟甲砜霉素的回收率与相对标准偏差(n=5)Table 3 Recoveries and RSDs of chloramphenicol,thiamphenicol and florfenicol in feed sample(n=5)
2.6 实际样品的检测
应用本方法对出口的宠物饲料及市场抽取的水产饲料和畜禽饲料共19个样品进行检测,其中8个样品中的氯霉素残留量大于0.3 μg/kg,阳性率为42.1%;4个样品中的氟甲砜霉素残留量大于0.3 μg/kg,阳性率为21.1%;2个样品中的甲砜霉素残留量大于1.5 μg/kg,阳性率为10.5%,但上述样品的药物残留量均小于国家残留监控的限量要求。
3 结论
本文建立了饲料中氯霉素、甲砜霉素和氟甲砜霉素残留同时测定的高效液相色谱-串联质谱分析方法。该法采用串联质谱和同位素内标消除了饲料复杂基质的影响,提高了定量的准确性。该方法操作简便,省去了固相萃取步骤,缩短了检测周期,方法的灵敏度高,回收率好,可满足实际检测工作的需要。
[1]Turton J A,Havard A C,Robinson S,Holt D E,Andrews C M,Fagg R,Williams T C.Food Chem.Toxicol.,2000,38:925-938.
[2]Peng Y P,Qi W,Tang H B,Liu X Y.Mod.Food Sci.Technol.(彭运平,齐维,唐海波,刘晓云.现代食品科技),2010,26(12):1414-1417.
[3]Zhou H C,Zhu T,Yan Q C,Wang Y,Tian X L.Fish.Sci.(周宏琛,朱涛,闫秋成,王勇,田晓林.水产科学),2007,26(2):123-124.
[4]Tan H,Mai Q.Chin.J.Health Lab.Technol.(谭慧,麦琦.中国卫生检验杂志),2010,20(7):1649-1650.
[5]Wang R Y,Wang P L,She Y X,Wang J,Wang X C,Zhong Y G.Chin.J.Anal.Lab.(王荣艳,王培龙,佘永新,王静,王锡昌,钟耀广.分析试验室),2009,28(8):26-28.
[6]Xie K Z,Xu D,Chen S Q,Xie X,Jia L F,Huang Y P,Guo H S,Wang J Y,Liu Z P.Chin.J.Anal.Lab.(谢恺舟,徐东,陈书琴,谢星,贾龙飞,黄玉萍,郭辉生,王金玉,刘宗平.分析试验室),2011,30(7):31-35.
[7]Zhan C R,Guo P,Chen Z G,Wang Y X,Hu Z G.Chin.J.Anal.Chem.(占春瑞,郭平,陈振桂,王远兴,胡志国.分析化学),2008,36(4):525-528.
[8]Xie W,Chen C Z,Huang Y Y,Fu H R.Chin.J.Chromatogr.(谢维,陈春祝,黄盈煜,傅晖蓉.色谱),2006,24(6):659.
[9]Huo Y,Yu H.Chin.J.Anal.Lab.(霍彦,于红.分析试验室),2010,29(Suppl 1):441-445.
[10]Li P,Qiu Y M,Cai H X,Kong Y,Tang Y Z,Wang D N,Xie M X.Chin.J.Chromatogr.(李鹏,邱月明,蔡慧霞,孔莹,唐英章,王大宁,谢孟峡.色谱),2006,24(1):14-18.
[11]Sheridan R,Policastro B,Thomas S,Rice D.J.Agric.Food Chem.,2008,56(3):3509-3516.
[12]Zhang F Q,Wang Y S,Fan S H,Zhou C M.Food Sci.(张凤清,王岩松,范世华,周长民.食品科学),2010,31(8):248-251.
[13]Yang Z,Li X Q,Wang J,Zhang Q H.Chin.J.Chromatogr.(杨总,李秀琴,王娟,张庆合.色谱),2011,29(9):927-931.
[14]Wang Z J,Leng K L,Sun W H,Liu Y P,Zhai Y X,Tan Z J,Guo M M,Wang Y.Prog.Fishery Sci.(王志杰,冷凯良,孙伟红,刘艳萍,翟毓秀,谭志军,郭萌萌,王瑜.渔业科学进展),2009,30(2):115-119.
[15]Liu Y Q,Wang H,Yin X Y,Yang H M,Yan L B.Food Sci.(刘艳琴,王浩,殷晓燕,杨红梅,闫龙宝.食品科学),2008,29(4):344-346.
[16]Luo H T,Huang X L,Wu H Q,Zhu Z X,Huang F,Lin X S.J.Instrum.Anal.(罗辉泰,黄晓兰,吴惠勤,朱志鑫,黄芳,林晓珊.分析测试学报),2011,30(12):1329-1337.
[17]Peng T,Li S J,Chu X G,Cai Y X,Li C J.Chin.J.Anal.Chem.(彭涛,李淑娟,储晓刚,蔡云霞,李重九.分析化学),2005,33(4):463-466.
