粮谷中8种痕量真菌毒素的定量分析方法
2013-11-28王明林储晓刚
曹 娅,孙 利,王明林,冯 峰,储晓刚*
(1.山东农业大学 食品科学与工程学院,山东 泰安 271018;2.中国检验检疫科学研究院 食品安全研究所,北京 100123)
真菌毒素是200多种真菌产生的次代谢的有毒物质,可分为镰刀菌属、曲霉菌属、青霉菌属3种,能够在宽泛的气候条件下,生长于田间或者贮藏过程中的农作物上[1]。真菌毒素是一类分子量小于700的有毒化合物质,存在于食品和饲料中,其一方面直接导致农产品腐败变质、营养物质损失以及产品的品质降低等[2-4],另一方面通过对任何动物机体内DNA、RNA、蛋白质和各种酶类的合成抑制以及对细胞结构的破坏而引起真菌毒素中毒,真菌毒素对任何动物的毒性都很高,通过吸入及皮肤接触或摄入被污染的食物,可引起动物病理变化和生理变态,引发包括中毒性肝损害、干细胞毒性、生殖紊乱、遗传毒性、致癌作用、致畸作用和免疫抑制等中毒症状[5-6]。
当前,针对真菌毒素常用的分析方法主要有薄层层析色谱法[7]、气相色谱法[8]、液相色谱法[9]、气相色谱串联质谱法[10]、液相色谱串联质谱法[11-14]和酶联免疫吸附法[15]。薄层层析色谱法精确度低、操作较为复杂,近年来的应用受到限制。免疫亲和柱的价格昂贵,同时由于其高特异性的特点,无法进行多残留检测。而气相色谱法和气相色谱串联质谱法检测的范围较窄,仅限于沸点较低的真菌毒素(如单端孢霉烯和棒曲霉素等)。液相色谱的应用范围虽然广泛,但检测的准确度与灵敏度相对于液相色谱串联质谱法较低,可能产生假阳性结果。因此,多选择性、高灵敏度的液相色谱串联质谱法成为近年来真菌毒素检测的主要分析方法。
为了去除基质干扰,提高方法的灵敏度,前处理方法的优化必不可少。目前用于粮谷中真菌毒素的常规前处理方法有固相萃取法(SPE)[16]、液液萃取法(LLE)[17]等。但很少加入内标对方法进行校正定量分析。本方法的基质是粮谷,杂质较多,干扰较大,而真菌毒素由于性质各异,在前处理过程和电离过程中的损失需要用同位素内标来校正[18]。本实验应用高效液相色谱法-串联四极杆质谱技术,通过优化前处理方法和色谱质谱条件,首次建立了粮谷中8种真菌毒素的同位素内标稀释定量法。
1 实验部分
1.1 仪器与试剂
Agilent 1200高效液相色谱仪(Agilent公司),串联API 5000三重四极杆质谱仪(Applied Biosystem公司),涡旋混合仪(Scientific Industries公司),KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司),Avanti J-26 XPI离心机(Beckman Coulter公司)。
乙腈(HPLC级,Merck公司),正己烷(HPLC级,Honeywell公司),标准品(黄曲霉毒素B1,黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2、伏马毒素B1、伏马毒素B2、柄曲霉素和异烟棒曲霉素 C)及同位素内标(黄曲霉毒素B113C17、黄曲霉毒素B213C17、黄曲霉毒素G113C17、黄曲霉毒素G213C17、伏马毒素B113C34、伏马毒素B213C34、柄曲霉素13C18和异烟棒曲霉素13C22)均购于Biopure公司,实验用水均为超纯水,电阻率大于18.2 MΩ·cm(Millipore公司)。
标准品黄曲霉毒素B1、黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2、柄曲霉素和异烟棒曲霉素C用乙腈溶解,配成50 μg/L的储备液;伏马毒素B1和伏马毒素B2用乙腈-水溶解,配成500 μg/L的储备液;同位素内标的储备液配制方法同上。最后用乙腈-水溶液逐级稀释标准品及同位素内标,配制浓度依次为200、100、50、20、5、1 μg/L的工作液,置于4℃冰箱冷藏。
1.2 样品前处理
称取研磨好的粮谷样品1.0 g(精确至0.01 g)置于50 mL离心管中,加入浓度为20 μg/kg的混合同位素内标,再加入5 mL正己烷和5 mL 60%乙腈,涡漩10 s,超声5 min,在10 000 r/min的转速下离心5 min,取1 mL乙腈水层样液过0.2 μm的滤膜,待分析。
1.3 色谱-质谱条件
色谱柱:Agilent Eclipse Plus C18(1.8 μm,2.1 mm×100 mm);柱温为25℃;流动相A为0.1%乙酸,B为甲醇,流速为200 μL/min,梯度洗脱程序:0~20 min,50%~5%A;进样体积为5 μL。
电喷雾离子源(ESI):正离子模式;毛细管电压:5.5 kV,气帘气:30 psi;雾化气(Gas1):60 psi;辅助气(Gas2):50 psi;离子源温度:550℃。采用MRM多反应监测方式,母离子/子离子对均设为单位分辨,各参数见表1。

表1 ESI模式下各化合物的质谱条件Table 1 MS/MS conditions in ESI mode for the detection of target compounds in standard solution

(续表1)
2 结果与讨论
2.1 样品前处理的优化
目标样品粮谷含有油脂类化合物,采用液液萃取的方式可将极性较强的真菌毒素萃取出来。实验对比了乙腈、甲醇、水、乙腈水和甲醇水的萃取效果,在相同的样品中加入最大浓度为10 μg/kg的混合标准溶液,结果显示当以乙腈水作为提取溶剂时效果最好。为了保证目标化合物的萃取回收率,本实验对乙腈水的混合比例以及不同的超声萃取时间进行了比较,在空白样品中加入最大浓度为10 μg/kg的混合标准溶液,按照“1.2”步骤处理,HPLC-MS/MS检测分析。如图1所示,当乙腈与水的比例为6∶4时,8种真菌毒素的回收率最佳。由于各化合物极性差别较大,特别是伏马毒素极性较大,提取溶剂中需含有适量的水,因此实验选择乙腈 ∶水(6∶4)为最佳萃取溶剂。进一步考察了萃取时间对萃取效率的影响。结果显示,多数化合物的回收率随着超声时间的延长而提高,但当萃取时间大于5 min后,回收率提高不明显,而延长萃取时间也会产生热使得化合物分解或产生其他变化,综合考虑后选择超声萃取时间为5 min。

图1 不同乙腈与水的比例下8种真菌毒素的回收率Fig.1 Recoveries of 8 types of mycotoxin in vary ratio of acetonitrile to water solvent
2.2 色谱条件的优化
由于电喷雾质谱是在溶液状态电离,因此流动相的组成除了影响分析物的保留时间和峰形外,还会影响分析物的离子化效率,从而影响目标化合物的检测灵敏度。本实验对于流动相中不同有机溶剂(乙腈和甲醇)的种类进行了考察,结果显示当甲醇作为有机相时各化合物的峰形良好,离子化效率高于乙腈,因此有机相确定为甲醇。
考察了流动相A的pH值在3.3~6.5范围时对各化合物的离子化影响,结果如图2所示,当pH值为3.3时,各化合物响应较高,因此选择pH 3.3的0.1%乙酸水溶液作为流动相。
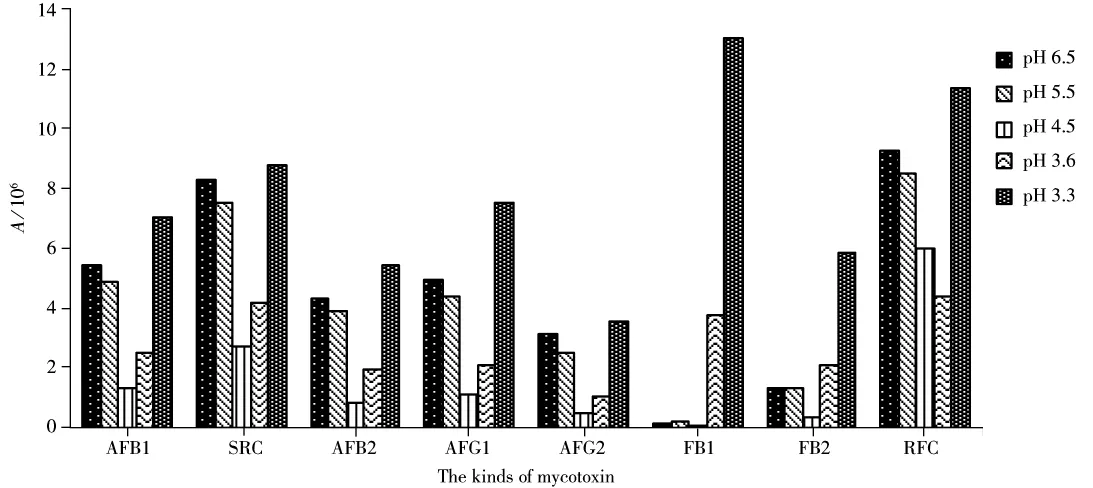
图2 不同流动相下8种真菌毒素的色谱峰响应Fig.2 Chromatographic response of 8 types of mycotoxin in vary of mobile phases
2.3 质谱条件的优化
通过单个分析物标准品溶液上机分析,得到目标分析物的质荷比。为了进一步对化合物进行确证分析,在碰撞诱导解析电离模式(CID)下,通过分析单个目标物标准品溶液,优化了去簇电压和碰撞电压,得到离子丰度较大的碎片离子为该化合物裂解的主要碎片离子。表1为ESI模式下,各化合物的主要碎片离子的质荷比。图3为MRM模式下真菌毒素标准溶液的选择离子流图。
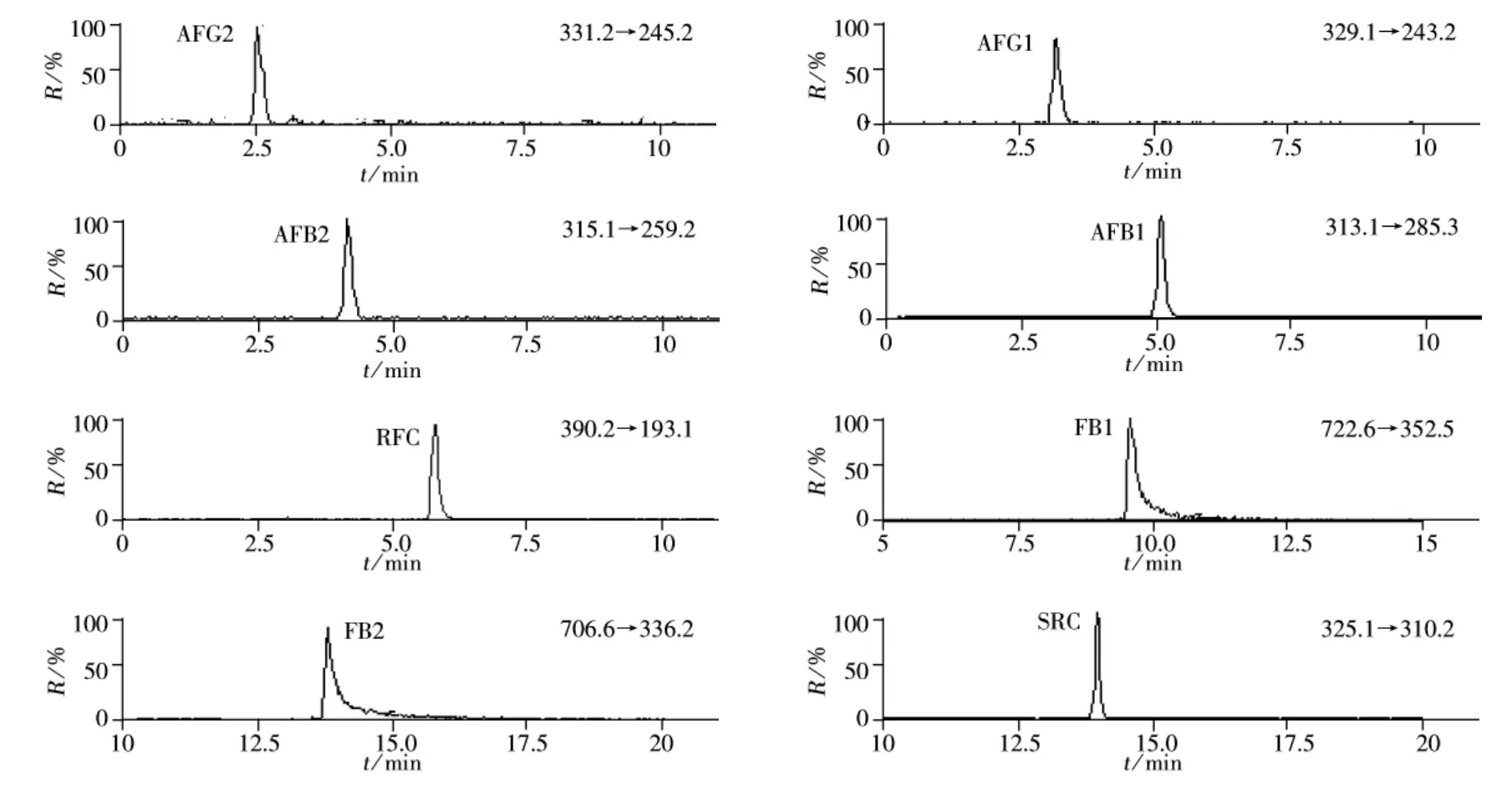
图3 优化条件下8种真菌毒素标准溶液的MRM色谱图Fig.3 MRM chromatograms of eight mycotoxin in optimum conditions
2.4 样品基质效应的消除
该实验中采用的同位素内标黄曲霉毒素B113C17、黄曲霉毒素B213C17、黄曲霉毒素G113C17、黄曲霉毒素G213C17、伏马毒素B113C34、伏马毒素B213C34、柄曲霉素13C18和异烟棒曲霉素13C22,各化合物的碳均为13C的稳定同位素内标,它们在定性、定量离子通道中相互无干扰,并且该内标物是人工合成,不存在于自然界中,为较好的内标物。但同位素内标难以得到,费用极高。实验对比了上述8种同位素内标和1种同位素内标(黄曲霉毒素B113C17)消除基质干扰的回收率,加标水平为各化合物的两倍定量下限(内标混合液最大浓度为20 μg/L),结果见表2。由表2可见,实验分析的8种化合物极性差别较大,性质各不相同,用同1种内标来消除干扰的分析结果并不理想。因此,最终将8种同位素内标都作为本实验的同位素内标物,用来同时对8种真菌毒素进行准确定量。
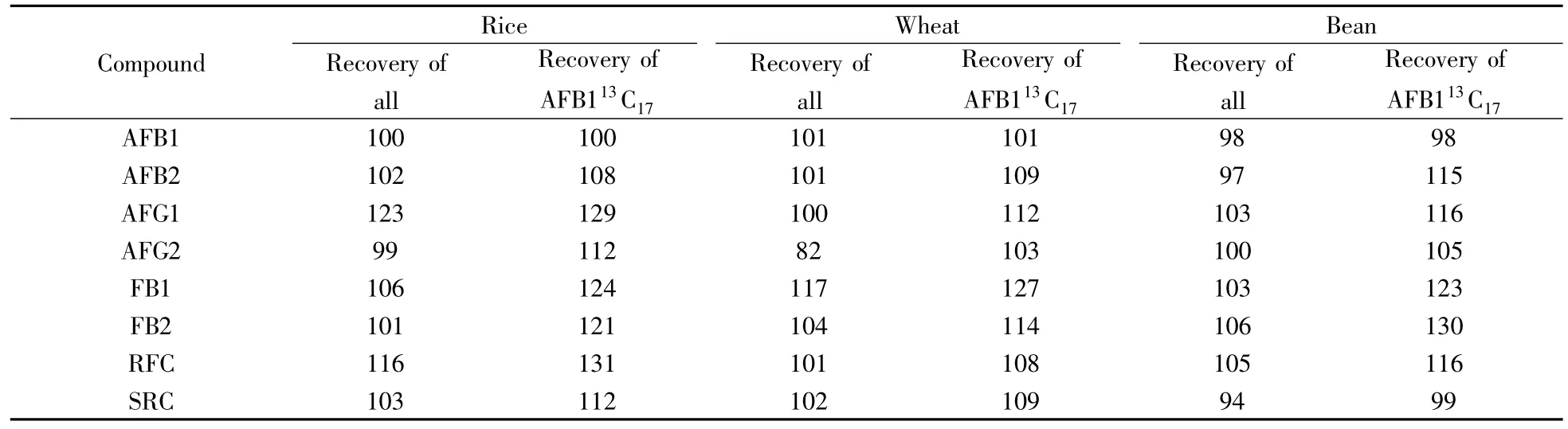
表2 8种同位素内标和单一同位素内标(黄曲霉毒素B113C17)的加标回收率对比Table 2 Comparison of recoveries between eight kinds of isotope internal standards and single isotope internal standard(AFB113C17) /%
2.5 线性方程与定量下限
配制质量浓度为0.1~200 μg/L的系列混合标准工作溶液,以目标组分和内标的峰面积比值为纵坐标(Y),对应的质量浓度比值为横坐标(X),绘制标准曲线。8种真菌毒素在以上质量浓度范围内具有良好的线性关系,线性相关系数均不低于0.997 0。以信噪比为10计算方法的定量下限(LOQ),结果见表3。

表3 8种化合物的线性范围、线性方程、相关系数以及定量下限Table 3 Linear ranges,regression equations,correlation coefficients(r)and limits of quantitation(LOQs)of eight target compounds
2.6 回收率与精密度
以各化合物的1倍、2倍定量下限(内标混合液最大浓度为20 μg/L)为3种空白样品的加标水平,在优化条件下,每个样品平行分析6次,计算回收率和精密度。各化合物的回收率为77%~123%,相对标准偏差为0.6%~13.3%(结果见表4)。
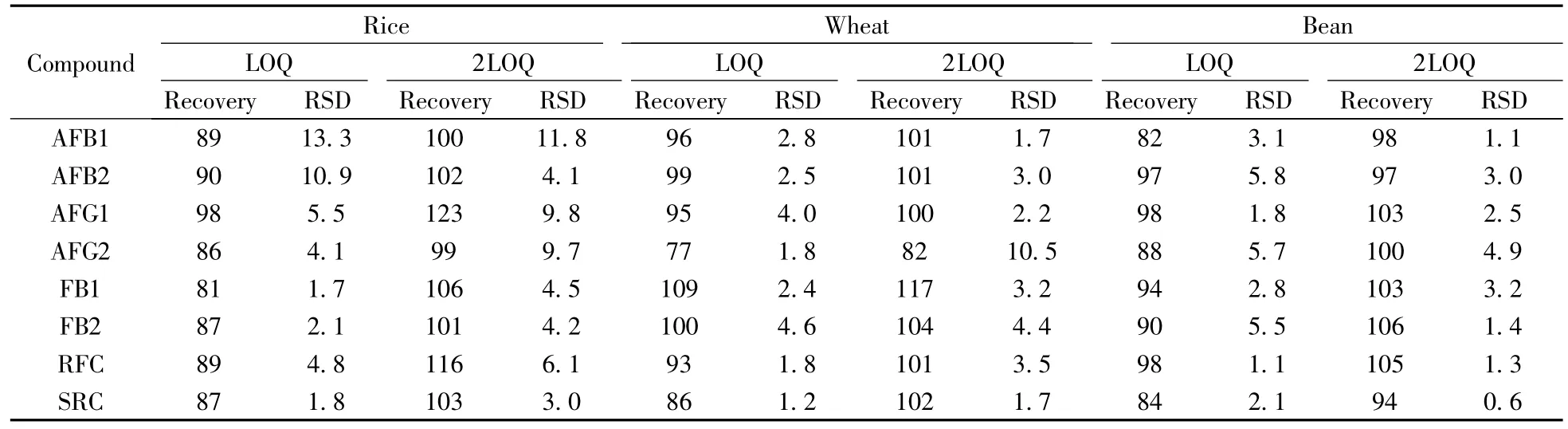
表4 8种化合物的加标回收率与相对标准偏差(n=6)Table 4 Recoveries and RSDs of eight target compounds(n=6) /%
2.7 实际样品的筛查
按照本方法对超市及农贸市场购买的大米、小麦和黄豆样品进行测定,每种样品各3批,结果在小麦粉中检出阳性样品,分别含有柄曲霉素0.73、0.33、0.49 μg/kg,但均未超过欧盟等发达国家的限量要求。
[1]Wei C M,Hansen B S,Jr Vaughan M H,McLaughlin C S.Toxicology,2001,167(2):101 -134.
[2]Li Q W,Wang S P,Bao W S.Chinese Endemic Disease Prevention Magazine(李群伟,王绍萍,鲍文生.中国地方病防治杂志),2001,16(1):24-25.
[3]Wang Y T.Chinese Jouranl of Career and Health(王允田.中国职业与健康),2010,26:1640-1642.
[4]Sospedra I,Blesa J,Soriano J M.J.Chromatogr.A,2010,1217:1437 -1440.
[5]Nicholas W T,Sreenath S,Sergry A P.Anal.Chim.Acta,2009,632:168 -180.
[6]Meng J.Chin.J.Chromatogr.(孟娟.色谱),2010,28:601 -607.
[7]Kok W T.J.Chromatogr.B,1994,659:127-134.
[8]Francisco M V,Eva M M,Ruìno M.Talanta,2011,84:1112 -1117.
[9]Luca C,Anna L P,Rita C.J.Chromatogr.A,2011,1018(42):7648 -7654.
[10]María I,Elena L,Elena G.Food Control,2011,22:1428 -1434.
[11]Silvio U,Lada I.J.Chromatogr.A,2004,1050(2):173 -178.
[12]Gilbert J,Anklam E.Trends Anal.Chem.,2002,21:468 -486.
[13]Gong X M,Ren Y P,Dong J,Sun J,Li J,Jin C,Yu J L.J.Instrum.Anal.(宫小明,任一平,董静,孙军,李健,金超,于金玲.分析测试学报),2011,30(1):6-12.
[14]Zhang L Q,Cao Z Y,Zhao X H,Ma Y N,Chen M X.J.Instrum.Anal.(张利强,曹赵云,赵肖华,马有宁,陈铭学.分析测试学报),2012,31(2):169-173.
[15]Li J,Yu Y M,Tian M.Chin.J.Chromatogr.(李军,于一茫,田苗.色谱),2006,24:581-584.
[16]Perez-Urquiz M,Prat M D,Beltrán J L.J.Chromatogr.A,2000,871:227 -234.
[17]Michael S,Franz B,Rudolf K.Rapid Commun.Mass Spectrom.,2006,20:2649-2659.
[18]Michael R,Michael N,Inga P.J.Chromatogr.B,2003,792:167-176.
