兔免疫球蛋白液相悬浮芯片的制备及制备条件的优化①
2013-11-28蔡月琴王德军吕建敏朱科燕陈民利
蔡月琴 王德军 吴 蔚 朱 亮 吕建敏 朱科燕 陈 诚 陈民利
(浙江中医药大学动物实验研究中心/比较医学研究中心,杭州310053)
液相悬浮芯片技术是一种新型、高通量的生物芯片技术,将流式细胞术、激光技术及应用流体学等技术结合在一起,利用悬浮在液相中的分类荧光编码微球作为检测载体,具有高通量、速度快、灵敏度高、特异性强及检测范围广等特点。近几年来,悬浮芯片技术在免疫学、基因组学、蛋白质组学及临床诊断检测等方面应用较广泛,被喻为后基因组时代的多功能液相芯片分析平台,是唯一被美国FDA批准用于临床诊断的新型生物芯片产品[1]。作为生物信息学先进的操作技术平台,液相悬浮芯片技术在生命科学基础研究领域的应用仍受限制。目前国内该技术尚处于起步阶段,国外已推出了商品化的可应用于实验动物研究的液相悬浮芯片试剂盒,但种类非常稀少,且只局限于大小鼠的检测,其他实验动物如实验兔的研究,无法得到应用[2-4]。
实验兔是目前生物医药产品研发及医学科学研究领域最常用的实验动物之一,尤其在生物抗体制备、眼科手术研究等方面发挥着大小鼠无法比拟的优势[5]。血清免疫球蛋白Ig水平是反映动物机体免疫状态的重要指标,Ig含量的变化与疾病密切相关,其中IgG、IgM和IgA是介导体液免疫的主要效应分子。本研究分别将亲和纯化的兔IgG、IgM和IgA偶联至荧光编码微球,对偶联条件、检测抗体浓度和Streptavidin-PE抗体浓度、抗体反应时间等因素进行优化,制备兔IgG、IgM和IgA液相悬浮芯片,为建立可应用于实验动物研究的液相悬浮芯片检测技术奠定基础,对实验动物研究和发展生物诊断试剂有重要意义。
1 材料与方法
1.1 实验动物及饲养条件 WHBE兔20只,雌雄各半,由浙江中医药大学实验兔生产基地[SCXK(浙)2009-0042]提供。饲养于本中心普通级实验兔饲养室[SYXK(浙)2008-0116],温度(20±2)℃,相对湿度40%~60%。
1.2 实验试剂与仪器
1.2.1 实验试剂 亲和纯化的IgG、IgM、IgA以及biotin标记的IgG、IgM、IgA均购自美国Bethyl公司;Streptavidin-PE抗体购自美国Invitrogen公司;Sulfo-NHS、EDC购自美国Thermo公司;96孔滤膜反应板购自美国Millipore公司;荧光编码微球、Bio-Plex calibration kit和validation kit均购自美国Bio-Rad公司。
1.2.2 实验仪器 Bio-plex 200液相悬浮芯片系统(美国Bio-Rad公司);台式冷冻高速离心机(美国Thermo公司);恒温孵育摇床(美国 Eppendorf公司);真空抽滤洗板机(美国Millipore公司)。
1.3 方法
1.3.1 兔IgG、IgM和IgA捕获抗体偶联量的优化每一种编码微球偶联一种捕获抗体,偶联的捕获抗体及所用微球编号,及相应生物素化检测抗体见表1。42号、48号和57号三种编码微球,分别与亲和纯化的IgG、IgM和IgA偶联,每种捕获抗体设置5个偶联量梯度(5、10、15、20 和 30 μg)。取 100 μl 42号荧光微球(1.25×106个)于进口离心管,用ddH2O洗涤,离心去上清,微球加80 μl 0.1 mol/L NaH2PO4(pH6.2)、10 μl 50 mg/ml S-NHS 和 10 μl 50 mg/ml EDC活化缓冲液,室温避光垂直旋转,活化20分钟。活化后的42号微球平均分为5份,分别与一系列浓度的IgG捕获抗体偶联,捕获抗体量设置为5、10、15、20 和30 μg 5 个梯度,室温避光垂直旋转偶联2小时,偶联完毕的微球用0.05%PBST洗涤两遍后,加1 ml 1%PBSB,室温避光旋转,封闭反应30分钟。用1%PBSB清洗微球一遍,去除上清,加入150 μl 1%PBSB悬浮微球,用血球计数器计算微球的浓度,4℃避光保存偶联的微球,有效期1年。48号荧光微球与IgM捕获抗体、57号荧光微球与IgA捕获抗体的偶联过程与上面步骤一样,不重复描述。
1.3.2 兔IgG、IgM和IgA捕获抗体偶联效率验证和最佳捕获抗体偶联量的确定 取96孔滤膜反应板,将各组不同偶联量的微球漩涡混匀15秒,每组3个复孔,每孔加入1×104个偶联的微球,同时设置阴性对照,稀释Anti-goat-IgG-PE 抗体至1 μg/ml,加50 μl到测试孔中,阴性对照孔不加,将96孔板放恒温孵育摇床,室温500 r/min反应30分钟,抽滤弃去上清,0.05%PBST 洗涤 3 次,加 125 μl 1%PBSB,900 r/min振荡3分钟重悬微球,Bio-Plex 200液相悬浮芯片系统检测荧光值。阴性对照荧光值不得超过100荧光强度中位值(Median fluorescence intensity,MFI),偶联捕获抗体的微球荧光值超过2000 MFI可认为偶联成功。每组免疫球蛋白中,选取与最高MFI值无显著性差异的捕获抗体量作为最佳偶联量。
1.3.3 检测抗体和Streptavidin-PE抗体工作浓度的确定 在确定最佳捕获抗体偶联量的基础上,分别优化检测抗体和Streptavidin-PE抗体的最佳工作浓度。将biotin标记的IgG、IgM和IgA检测抗体用1%PBSB 稀释成4 个浓度组,分别为 0.2、0.5、2、5 μg/ml,Streptavidin-PE抗体用1%PBSB稀释为1、2、5 μg/ml 3个浓度组,每组4个复孔,采用棋盘滴定法在液相悬浮芯片系统上检测荧光值,选取与最高MFI值无显著性差异的工作浓度作为最佳检测抗体浓度和Streptavidin-PE抗体浓度。
1.3.4 反应时间的确定 分为微球-血清反应时间,检测抗体反应时间,Streptavidin-PE抗体反应时间三个因素。在确定最佳捕获抗体偶联量、最佳检测抗体和Streptavidin-PE抗体工作浓度的基础上,将血清反应时间分为30、60、90分钟3个组,检测抗体反应时间分为30、60、90分钟3个组,Streptavidin-PE抗体反应时间分为15、30、45分钟3个组,每组4个复孔,采用棋盘滴定法在液相悬浮芯片系统上检测荧光值,选取与最高MFI值无显著性差异的反应时间作为最佳血清反应时间、检测抗体反应时间、Streptavidin-PE抗体反应时间。

表1 偶联微球编号、捕获抗体及生物素化检测抗体Tab.1 Fluorescent microspheres,capture antibody and detection antibody in IgG,IgM and IgA group
2 结果
2.1 荧光编码微球偶联兔IgG、IgM和IgA效率验证和最佳偶联量的优化 用Anti-goat-IgG-PE抗体与偶联捕获抗体的微球反应,进行捕获抗体偶联效率验证,IgG、IgM和IgA阴性对照孔的荧光值分别为 11.5 MFI、6.8 MFI和 6.5 MFI,均低于 100 MFI。图1显示,在IgG、IgM和IgA中,5组偶联量梯度(5、10、15、20 和30 μg)的微球,测得的荧光值均大于2000 MFI,证明 IgG、IgM和 IgA捕获抗体偶联成功。
在42号微球中,10 μg IgG捕获抗体偶联量组的MFI值最高,均显著高于其他4个捕获抗体偶联量组(P<0.05,P<0.01);在48 号微球中,20 μg IgM捕获抗体偶联量的MFI值最高,均显著高于5、10、15 μg IgM 捕获抗体偶联量组(P<0.05,P<0.01),但20 μg与30 μg IgM捕获抗体偶联量组相比则无显著性差异(P>0.05);在57号微球中,15 μg IgA捕获抗体偶联量的MFI值最高,均显著高于5、10和30 μg IgA 捕获抗体偶联量组(P<0.01),但 15 μg与20 μg IgA捕获抗体偶联量组比较则无显著性差异(P>0.05,图1)。根据以上优化试验,IgG、IgM和IgA的最佳偶联量分别为10、20和15 μg捕获抗体。
2.2 兔IgG、IgM和IgA检测抗体最佳工作浓度的优化 biotin标记的IgG、IgM和IgA检测抗体各自稀释为0.2、0.5、2、5 μg/ml四个浓度组,表2 结果显示,在IgG中,5 μg/ml检测抗体的MFI值最高,显著高于0.2、0.5 μg/ml检测抗体组(P<0.01),但5 μg/ml与2 μg/ml检测抗体组无显著性差异(P>0.05);在 IgM 中,5 μg/ml检测抗体的 MFI值最高,显著高于 0.2 μg/ml、0.5 μg/ml检测抗体组(P<0.01),但5 μg/ml与2 μg/ml检测抗体组无显著性差异(P>0.05);在 IgA 中,5 μg/ml检测抗体的 MFI值最高,显著高于 0.2、0.5、2 μg/ml检测抗体组(P<0.05,P<0.01)。据此,IgG、IgM 和 IgA 检测抗体最佳工作浓度分别为2、2和5 μg/ml。
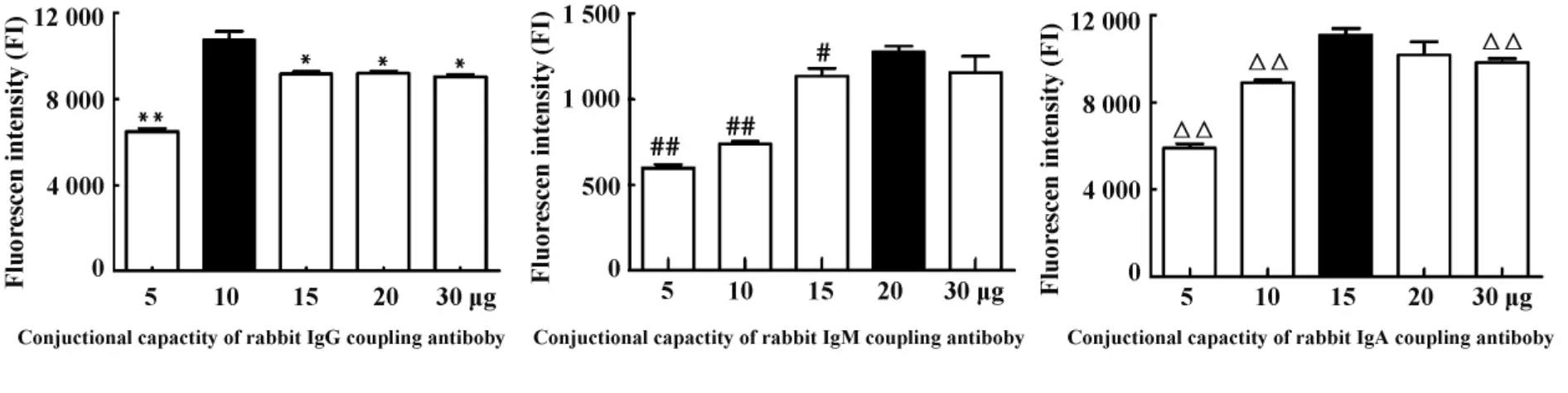
图1 IgG、IgM和IgA捕获抗体各组偶联量的荧光值(MFI)Fig.1 Fluorescence intensity of different conjuctional capacity of capture antibody group in IgG,IgM and IgA(MFI)
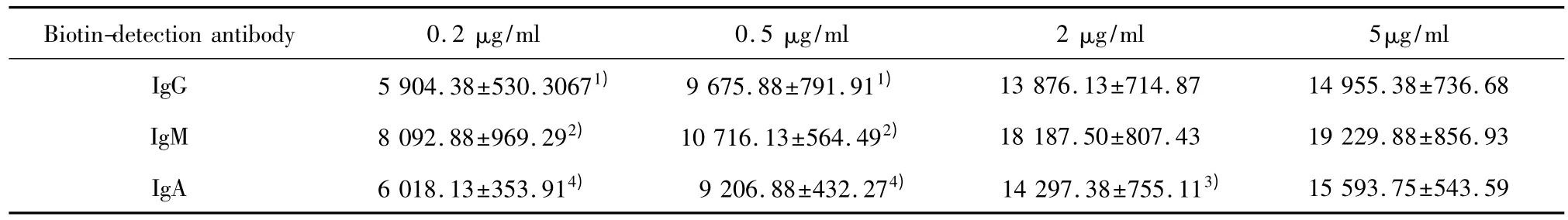
表2 各组免疫球蛋白不同检测抗体浓度的荧光值(MFI)Tab.2 Fluorescence intensity of different concentration of detection antibody group in IgG,IgM and IgA(MFI)
2.3 Streptavidin-PE抗体的最佳工作浓度的优化Streptavidin-PE 抗体用1%PBSB 稀释为1、2、5 μg/ml 3个浓度组,由表3可见,在 IgG、IgM、IgA中,5 μg/ml Streptavidin-PE抗体的MFI值最高,均显著高于1 μg/ml Streptavidin-PE 抗体组(P<0.01),但 5 μg/ml与 2 μg/ml Streptavidin-PE抗体组无显著性差异(P>0.05)。结果表明,IgG、IgM和IgA的最佳Streptavidin-PE抗体浓度均为2 μg/ml。
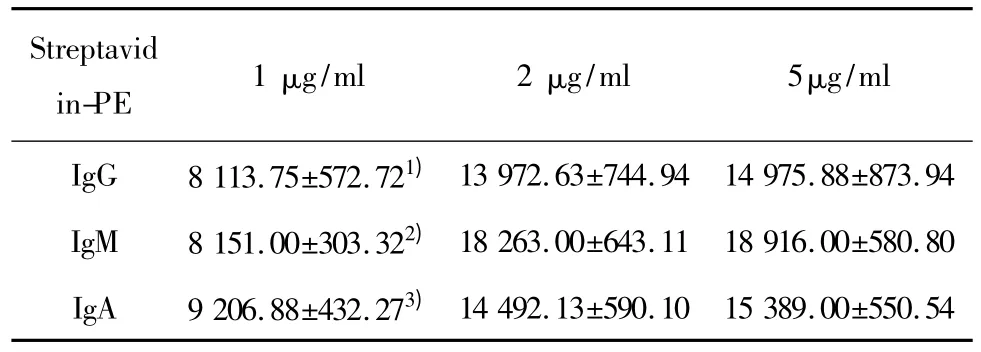
表3 各组免疫球蛋白不同Streptavidin-PE抗体浓度的荧光值(MFI)Tab.3 Fluorescence intensity of different concentration of Streptavidin-PE group in IgG,IgM and IgA(MFI)
2.4 兔IgG、IgM和IgA微球-血清最佳反应时间的优化 将微球-血清反应时间分为30、60、90分钟3个组,从图2中可以看出,在IgG、IgM和IgA中,微球-血清作用90分钟组MFI最高,显著高于30分钟组(P<0.01),但60分钟组与90分钟组无显著性差异,因此最佳微球-血清反应时间为60分钟。
2.5 兔IgG、IgM和IgA检测抗体最佳反应时间的优化 兔IgG、IgM和IgA检测抗体反应时间分为30、60、90分钟3个组,图3显示,IgG、IgM 和 IgA 检测抗体反应90分钟组MFI均最高,显著高于30分钟组(P<0.01),但60分钟组与90分钟组无显著性差异,因此检测抗体最佳反应时间为60分钟。
2.6 Streptavidin-PE抗体最佳反应时间的优化Streptavidin-PE抗体反应时间分为15分钟、30分钟、45分钟3个组,图4显示,IgG、IgM和IgA中,Streptavidin-PE抗体反应45分钟组MFI最高,显著高于15 分钟组(P<0.05,P<0.01),但 30 分钟组与45分钟组无显著性差异,因此Streptavidin-PE抗体最佳反应时间为30分钟。
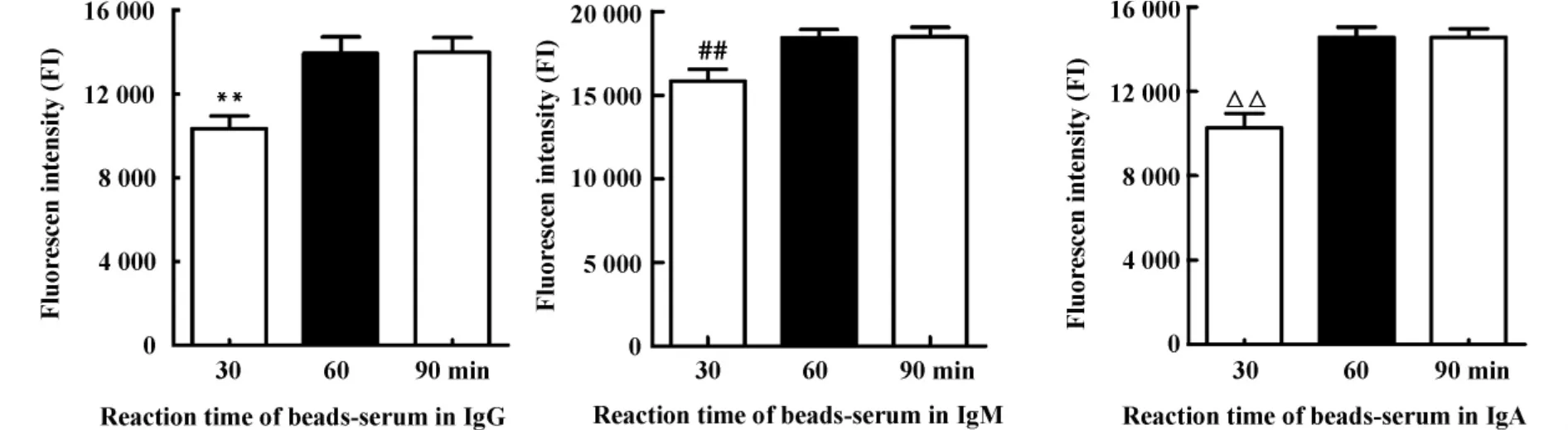
图2 IgG、IgM和IgA微球-血清各反应时间组的荧光值(MFI)Fig.2 Fluorescence intensity of different reaction time of beads-serum in IgG,IgM and IgA(MFI)

图3 IgG、IgM和IgA检测抗体各反应时间组的荧光值(MFI)Fig.3 Fluorescence intensity of different reaction time of detection antibody in IgG,IgM and IgA(MFI)
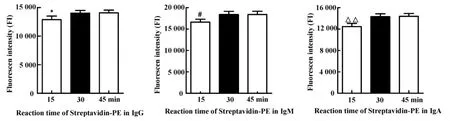
图4 IgG、IgM和IgA Streptavidin-PE各反应时间组的荧光值(MFI)Fig.4 Fluorescence intensity of different reaction time of Streptavidin-PE in IgG,IgM and IgA(MFI)
3 讨论
液相悬浮芯片中所有的反应都是在悬浮于液相中的微球表面上进行,将反应体系由液相-固相反应改变为接近生物系统内部环境的完全液相反应体系,对于确保建立在正确的高级结构之上的真实的蛋白质的检测尤为关键,液相环境有利于抗原抗体的反应,如血液样本中蛋白的检测[6,7]。液相悬浮芯片在蛋白水平上的检测基础是源于抗原-抗体反应,将捕获抗体共价偶联到荧光编码微珠上,微珠表面的羧基与蛋白质N末端的氨基发生羧胺反应,形成稳定的共价键[8,9]。本文就兔 IgG、IgM 和 IgA 捕获抗体的偶联量进行了优化,发现IgG、IgM和IgA的最佳捕获抗体偶联量存在差异,在IgG捕获抗体偶联反应中,10 μg蛋白偶联量组的FI值比15、20和30 μg蛋白偶联量组均高,具有显著差异;在IgM捕获抗体偶联反应中,20 μg蛋白偶联量的FI值最高,均显著高于5、10和15 μg蛋白偶联量组,而与30 μg蛋白偶联量组相比则无显著性差异;IgA捕获抗体偶联反应中,15 μg蛋白偶联量的FI值最高,均显著高于5、10和30 μg蛋白偶联量组,而与20 μg蛋白偶联量组相比则无显著性差异(图1)。提示每种指标的捕获抗体最佳偶联量不尽相同,捕获抗体一旦超出其最佳偶联量范围,可能由于空间位阻效应使得具有主要活性成分的Ig分子的Fab端的结合臂不能充分地微球结合,从而导致MFI值降低。因此每个蛋白必须摸索出最佳的偶联条件,关键是捕获抗体的偶联量。
此外本研究对IgG、IgM和IgA检测抗体浓度和Streptavidin-PE抗体浓度进行优化,选取与最高MFI值无显著性差异的抗体浓度作为最佳工作浓度。在反应时间优化中,对微球-血清、血清-检测抗体及Streptavidin-PE抗体作用时间分别进行比较分析,最佳反应时间分别为60、60和30分钟,与传统的双抗体夹心法ELISA反应时间比较一致。根据上述优化的条件,从而制备兔IgG、IgM和IgA液相悬浮芯片,同时这些免疫球蛋白液相悬浮芯片制备条件的优化方案可应用于其他蛋白的液相悬浮芯片,为建立可应用于实验兔研究的液相悬浮芯片检测方法和发展新颖生物诊断试剂奠定基础。
1 Joong-Ho W,Ofir G,Shai S S et al.Significance analysis of xMap cytokine bead arrays[J].Proc Natl Acad Sci USA,2012;109(8):2848-2853.
2 Houser B.Bio-Rad's Bio-Plex®suspension array system,xMAP technology overview[J].Arch Physiol Biochem,2012;118(4):192-196.
3 McDuffie E,Obert L,Chupka J et al.Detection of cytokine protein expression in mouse lung homogenates using suspension bead array[J].J Inflamm,2006;3:15.
4 Datta S C,Opp M R.Lipopolysaccharide-induced increases in cytokines in discrete mouse brain regions are detectable using Luminex xMAP technology[J].J Neurosci Methods,2008;175(1):119-124.
5 Choonara Y E,Pillay V,Danckwerts M P et al.In vivo evaluation of a biodegradable donut-shaped minitablet for prolonged posterior segment drug delivery in the rabbit eye model[J].J Pharm Sci,2011;100(5):1819-1832.
6 Birtwell S W,Broder G R,Roach P L et al.Multiplexed suspension array platform for high-throughput protein assays[J].Biomed Microdevices,2012;14(4):651-657.
7 Drago F,Karpasitou K,Spinardi L et al.A microsphere-based suspension array for blood group molecular typing:an update[J].Transfus Med Hemother,2010;37(6):336-338.
8 Sui W,Tan J,Guo J et al.An altered TH1/TH2 and pro-inflammatory cytokine profile in patients with end-stage renal disease detected by suspension array technology[J].Ren Fail,2009;31(1):1-5.
9 Wang Y,Fang F,Shi C et al.Evaluation of a method for the simultaneous detection of multiple tumor markers using a multiplex suspension bead array[J].Clin Biochem,2012;45(16-17):1394-1398.