微生物法检测实验动物血清中的抗生素残留
2013-11-27冯育芳岳秉飞贺争鸣
邢 进,冯育芳,岳秉飞,贺争鸣
(中国食品药品检定研究院实验动物资源研究所,北京 100050)
抗生素残留检测主要有传统微生物抑制法、氯化三苯四氮唑法、气相色谱法、液相色谱法等。而微生物抑制法对仪器设备的要求不高,操作比较简便,便于在国内实验动物检测机构中应用。该方法最常用的嗜热芽孢杆菌是被FDA认可的国际上公认的首选指示菌,其具有良好的培养稳定性,对更多的抗生素敏感,敏感度也较高[1]。本研究旨在通过微生物抑制法对实验动物血清中的抗生素残留进行检测,提高实验动物微生物检测结果的准确性。
1 材料和方法
1.1 材料
1.1.1 标准菌株嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)CMCC 63509:由中国食品药品检定研究院食品化妆品检定所惠赠。
1.1.2 血清:动物血清小鼠508份,大鼠91份,豚鼠386份,兔 334份,地鼠 40份,鸡 10份,犬 229份,猴42份,共1640份实验动物血清;新生牛血清(购自浙江天杭生物技术有限公司)。全部受试血清须经56℃灭活30min。
1.1.3 抗生素:头孢他啶、头孢噻肟、头孢哌酮、亚胺培南、磺胺甲基异恶唑、庆大霉素、青霉素G、环丙沙星、多粘菌素 E(购自中国食品药品检定研究院);氯霉素、庆大霉素(购自天津药业集团有限公司);利福平(日本 Wako)、红霉素、四环素、新生霉素(美国 Amresco),以上抗生素配制为 1000 μg/mL、500 μg/mL、100 μg/mL、50 μg/mL、10 μg/mL、5 μg/mL、1 μg/mL、0.5 μg/mL、0.25 μg/mL、0.025 μg/mL十个稀释度。
1.1.4 试剂和器材:MH琼脂培养基(美国BD);抗生素检测试剂盒 Premi©test(德国拜发)。牛津杯(内径6±0.1 mm,外径 7.8±0.1 mm,高 10±0.1 mm),90 mm无菌培养皿。
1.2 方法
1.2.1 菌悬液的制备:根据文献[2]制备嗜热脂肪芽孢杆菌芽孢悬液,将嗜热脂肪芽孢杆菌60℃培养18~24 h后,转入36℃培养3~4 d,革兰氏染色镜检芽孢产率达到85%以上时,用灭菌PBS将菌苔洗下,80℃水浴10 min后加入到60℃预先制备好的MH 培养基中,至芽孢含量为 106个 /mL[3,4]。
1.2.2 双碟的制备:取直径100 mm,高20 mm的平皿,参考药典中附录IX A抗生素残留检查法[5],将融化MH琼脂10 mL在碟底内均匀摊布,放置水平台上使凝固,作为底层。将制备好的50℃预热的MH琼脂菌悬液6 mL倒入预先凝固的MH底层琼脂上,冷却后备用。
1.2.3 血清中抗生素残留的检测:根据药典[5]和相关抗生素残留微生物学检测方法国家标准[6],参照管碟法检验该方法对不同抗生素的检测限,并对照品各种实验动物血清的抗生素残留进行检测。待嗜热脂肪芽孢杆菌平皿凝固后,将牛津杯均匀放置在培养基上,每块平皿放置6个。每个牛津杯中加入10 μL的受试血清,盖好平皿,每块平皿上设置阴阳对照各一个,阴性对照加入新生牛血清10 μL,阳性对照加入10 μg/mL青霉素 G。
1.2.4 与Premi@Test试剂盒检测结果的比较:将本研究中所采用的嗜热脂肪芽孢杆菌抑制法与Premi@Test抗生素检测试剂盒的检测结果进行比对[7],比对样品为14份抗生素对照品、82份随机选择的受试血清、4份新生牛血清阴性对照,将两种方法获得的结果进行比对,并进行统计学分析。
1.2.5 与细菌学检测结果比对:在检测血清中有875份的来源动物进行了肠道细菌的检测,即用DHL琼脂平皿对回盲部进行分离培养,将血清中抗生素残留结果与肠道细菌学检测结果进行比对,并进行统计学分析。
2 结果
2.1 检测限
从本研究所采用的嗜热脂肪芽孢杆菌管碟法对14种抗生素对照品的检测限可以看出,所用的嗜热脂肪芽孢杆菌菌株对头孢菌素类抗生素、亚胺培南、青霉素G和环丙沙星最为敏感。但对氯霉素、磺胺甲噁唑和多粘菌素E敏感性较差,与文献中的报道基本相符[8]。具体检出限结果见表1。
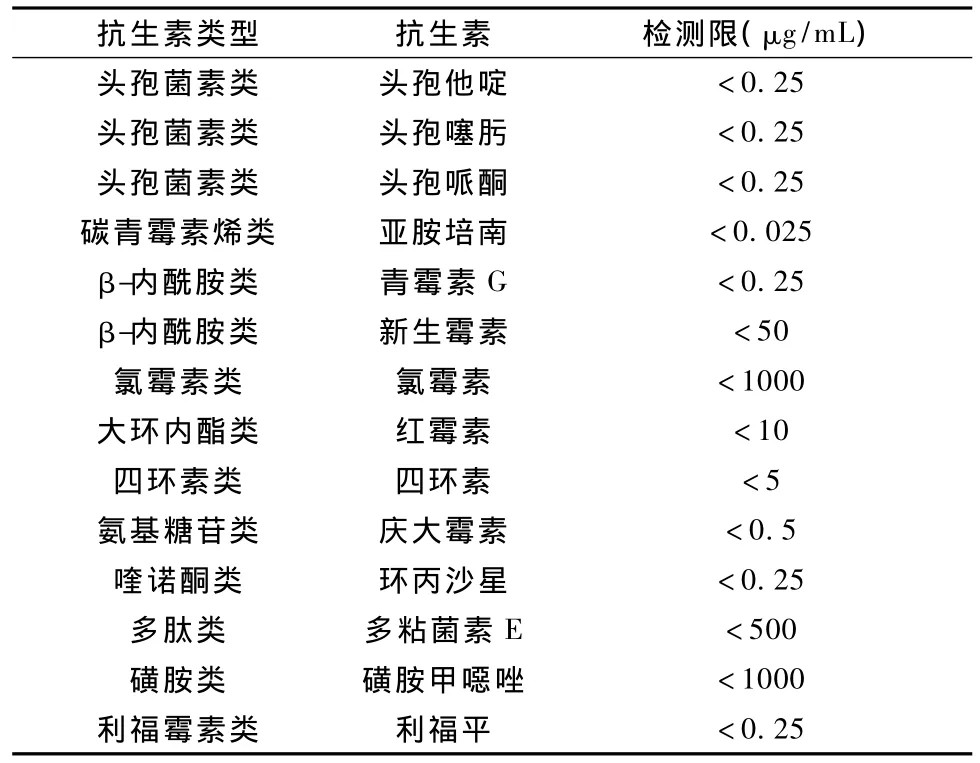
表1 对不同抗生素的检出限Tab.1 Detection limit of different antibiotics
2.2 重复性检测
将选择的14种抗生素及无抗生素的新生牛血清进行三次重复性试验,阴性对照新生牛血清三次测试均无抑菌圈产生。14种抗生素三次测试的相对标准偏差RSD范围在0.355% ~1.715%之间,表明该方法具有很好的重复性。结果见表2。
2.3 对实验动物血清样品的检测
在对1640份实验动物的血清进行检测后,小鼠、大鼠、豚鼠、兔、犬和猴的血清都发现存在对嗜热脂肪芽孢杆菌不同程度的抑菌现象。小鼠血清样品量最多,阳性率也最高。具体结果见表3。
2.4 与Premi@Test抗生素检测试剂盒比较
本研究中采用的方法对头孢他啶的灵敏度优于Premi试剂盒,见表4。对动物血清的检测结果Premi试剂盒的阳性率为21/83(25.3%),本研究的检测方法阳性率为31/83(37.5%)。如表5所示,两种方法样品结果总符合率为 72/100(72.0%),X2=16.680,P >0.05,两种方法的检测结果差异没有显著性。
2.5 细菌培养与抗生素残留的关系
在进行血清检测的1640只实验动物中,有875只的回盲部内容物接种了DHL琼脂平皿,检测结果见表6。将菌落生长情况与抗生素检测结果进行统计分析(X2=9.939,P<0.05),说明二者有一定的相关性,但C=0.106(<0.4),相关度不高。
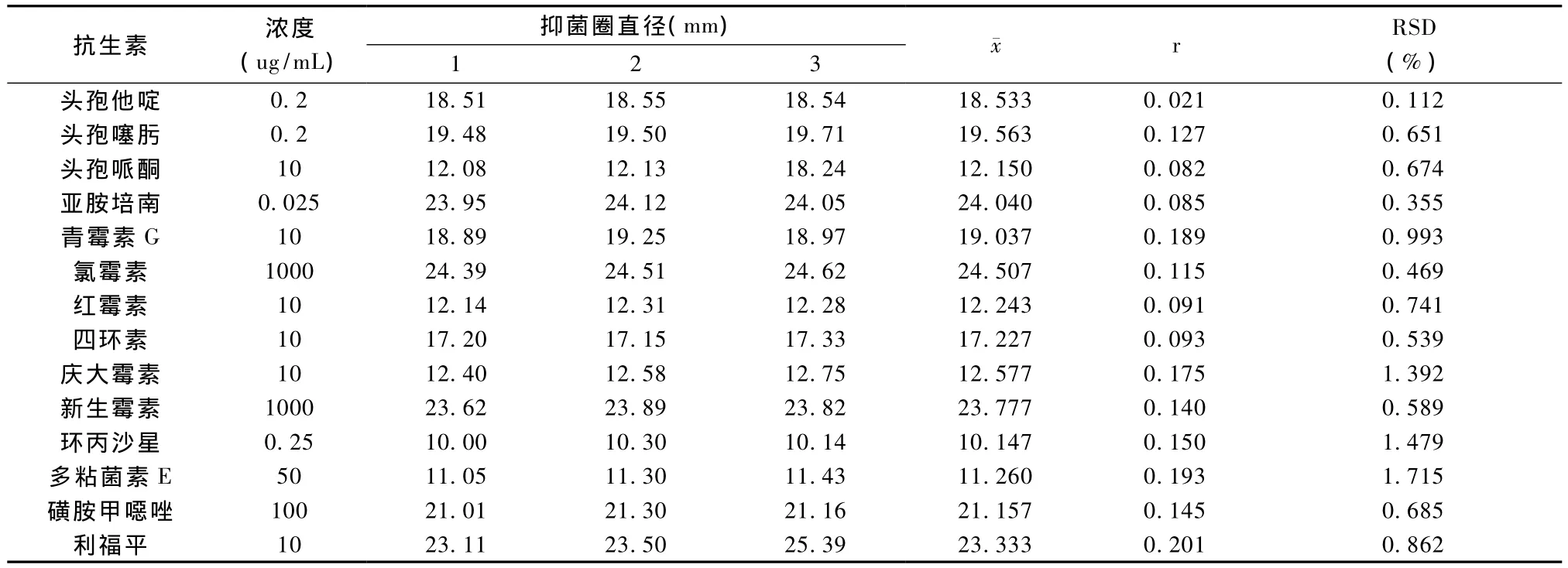
表2 对抗生素对照品的重复性检测结果Tab.2 Repeatability results of antibiotics reference substance detection
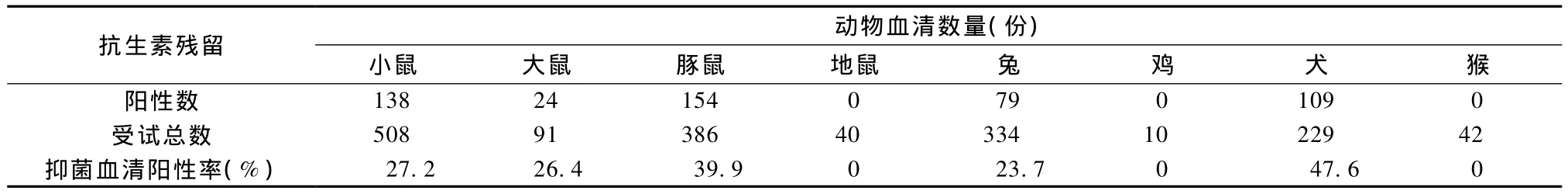
表3 实验动物血清抗生素检测结果Tab.3 Results of antibiotic residues test of the laboratory animal sera
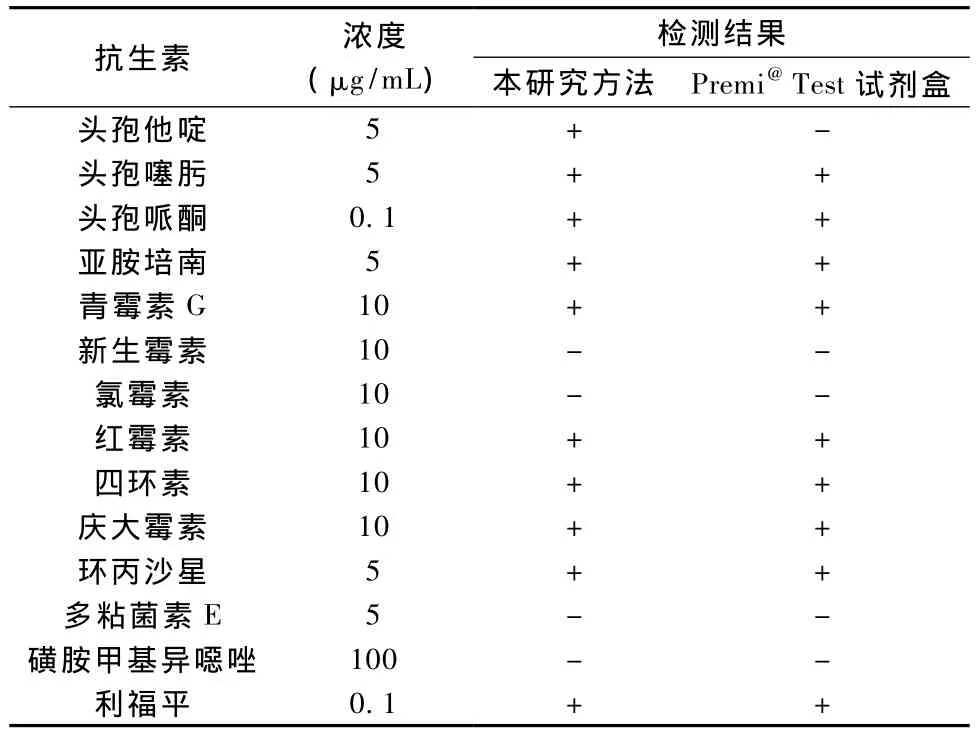
表4 Premi抗生素检测试剂盒对14种不同浓度抗生素的检测结果Tab.4 Results of antibiotics test with Premi@Test kit to 14 different concentrations
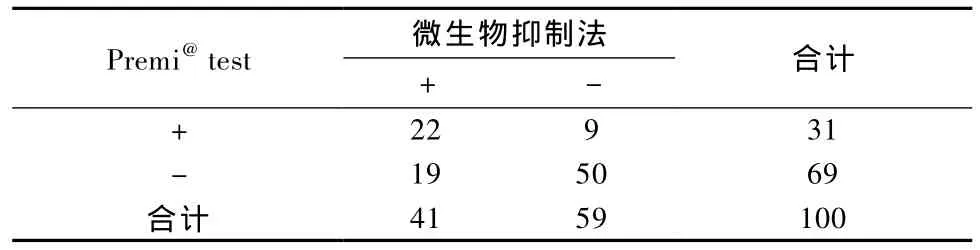
表5 两种方法检测结果Tab.5 Results of microbial inhibition test and Premi@test
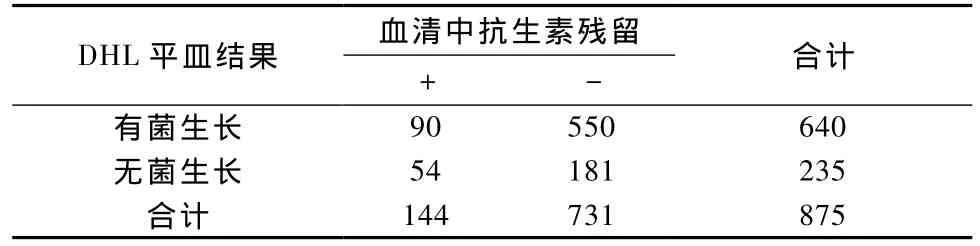
表6 血清中抗生素残留与DHL琼脂平皿检测结果Tab.6 Results of antibiotic residues test and DHL plate test of the animal sera
3 讨论
通过嗜热脂肪芽孢杆菌抑制法对实验动物血清中的抗生素残留进行检测,发现在小鼠、大鼠、豚鼠、兔和犬中都有存在。特别是豚鼠、兔、犬的整体残留水平更高,这可能与我国现行实验动物微生物检测国家标准中[9],这些动物的普通级只须排除沙门氏菌有关。但药物是否是经由饲料、饮水,或是其他途径进入动物体内需要进一步确证。本研究采用的方法将微生物纸片抑制法和管碟法相结合,在保证敏感型的同时,弥补了实验动物血清少的不足。与Premi@Test抗生素检测试剂盒比较,结果基本吻合。
在检测工作中,普通级动物的回盲内容物、肛拭子或者新鲜粪便的检测在接种DHL琼脂培养基后,没有细菌生长是非常普遍的情况。这种现象的产生是否是由于饲养过程中使用抗生素所引起的,应该引起我们的重视。从结果中显示,DHL培养回盲部内容物的菌落生长情况虽然与抗生素残留情况有一定的相关性,但相关的程度很弱,这可能是因为停药后一周内,即便是之前连续使用用药,大部分抗生素在畜禽体内的水平也会降到检出限以下甚至完全消除[10]。然而之前使用抗生素的效果会持续存在,干扰动物体内的微生物菌群[11],导致肠道菌群失调,难以恢复[12],极有可能对动物实验造成影响。
在检测成本方面,本研究所采用的微生物抑制法,将管碟法和纸片法相结合,非常经济,操作简便,在实验动物领域便于推广。目前,我国实验动物质量抽查检验的机制仍存在许多需要改进的方面,检验标准的完善至关重要[13]。因此,为了保证实验动物质量检测结果的准确,保证动物实验,特别是药品检验工作的顺利进行,有必要增加对实验动物抗生素残留的检测内容,以确保实验动物行业的健康发展。
[1] 丁志刚,王静,高红梅.抗生素残留检测技术的研究进展[J].食品与发酵工业,2005,31(6):112 -116.
[2] GB/T 4789.27-2008,食品卫生微生物学检验鲜乳中抗生素检验[S].北京:中国标准出版社,2008.
[3] 吴谦,郑晶,黄晓蓉,等.动物源性食品中 β-内酰胺类药物残留检测微生物抑制法的建立[J].福建畜牧兽医,2009,31(2):19-22.
[4] Ng TM,Viard E,Caipa ML,et al.Expansion and validation of a predictive model for the growth of Bacillus steamthernsophilus in military rations[J].J Food Science,2002,67(5):1872-1878.
[5] 中华人民共和国药典三部,附录 IX A抗生素残留检查法[S].中国医药科技出版社,2010:附录 93 -98.
[6] GB/T 20444-2006,猪组织中四环素族抗生素残留量检测方法微生物学检测方法[S].北京:中国标准出版社,2006.
[7] Pikkemaat MG,Rapallini ML,Zuidema T,et al.Screening methods for the detection of antibiotic residues in slaughter animals:comparison of the European Union Four-Plate Test,the Nouws Antibiotic Test and the Premi©Test(applied to muscle and kidney)[J].Food Addit Contam Part A Chem Anal Control Expo Risk Assess.2011,28(1):26 -34.
[8] Gaudin V, MarisP, FuselierR, etal. Validation ofa microbiological method:the STAR protocol,a five-plate test,for the screening of antibiotic residues in milk[J].Food Addit Contam.2004,21(5):422-33.
[9] GB/T 14922.2,实验动物微生物等级及监测[S].北京:中国标准出版社,2011.
[10] 周桂莲,蒋宗勇,林映才.饲用抗生素在畜禽体内残留及消除规律研究进展 [J].饲料工业,2007,28(4):1 -8.
[11] 孙晓红,王海香,陈娟等.动物源性食品中抗生素残留对肠道菌群的影响及其微生物学 ADI[J].中国食品卫生杂志,2010,22(5):471-475.
[12] 王瑞君,黄雪峰,唐欢,等.抗生素诱导的胃肠道菌群失调动物模型的建立[J].中国比较医学杂志,2006,16(3):145-149.
[13] 贺争鸣,李根平.建立和完善全国实验动物质量抽查检验的新机制 [J].实验动物科学,2011,28(4):44-45.
