OX-LDL 与单核巨噬细胞相互作用促进动脉粥样硬化形成
2013-11-27赵诗萌吴红敏
张 良,韩 丹,赵诗萌,吴红敏
(中国医科大学附属第一医院新生儿科,沈阳 110001)
动脉粥样硬化(atherosclerosis,AS)是影响人类 健康最严重,最常见的心血管疾病之一,是人类当前死亡的一个主要病因。对免疫组织化学方法及超级形态学研究表明形成于AS病变早期的泡沫细胞主要是由单核细胞来源的巨噬细胞吞噬大量脂质而形成的,而且存在于AS病变的始终,也有助于探索对AS病变的防治研究。其发病机制涉及炎性反应、脂质代谢失
调及氧化应激等多种病理生理机制[1-3]。其中,低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)的氧化修饰被认为是 AS形成的关键启动因素[4].氧化性低密度脂蛋白(OX-LDL)与单核巨噬细胞间的相互作用是泡沫细胞形成的重要机制。目前已从细胞形态学,生物化学等方面对该问题进行了不同方面的阐述,但关于泡沫化过程中细胞内脂质变化情况的研究报道尚不多见。
本研究采用一次性密度梯度超速离心方法由健康成人血浆中分离出低密度脂蛋白,由硫酸铜溶液氧化24 h制备成氧化型低密度脂蛋白,同体外培养的小鼠腹腔巨噬细胞相互作用,建立巨噬细胞源性泡沫细胞模型,并动态观察细胞内脂质成分(主要为总胆固醇TC、游离胆固醇FC、胆固醇酯EC)量的改变及细胞形态的变化过程,以初步探讨单核细胞源性泡沫细胞形成的可能机制。
1 材料和方法
实验动物,纯系 615小鼠[5-6](辽实动质字.(2000)015号),雄性 20~25 g,8~10周。健康成人新鲜血 200 mL(EDTA抗凝)固体 NaBr,固体CuSO4购于沈阳试剂三厂,分析纯品 DMEM培养基(美国 Gibco,总胆固醇试剂盒及游离胆固醇试剂盒,购于北京天象人生物工程高技术公司,LDL标准品购于美国Sigma公司。
1.1 低密度脂蛋白的制备、鉴定和定量分析
取新鲜全血室温静止后弃血凝于4℃,4 000 r/min离心30 min获血清,加入0.05%NaN3,100 mg/L EDTA 防 腐、防 氧 化。再 于 4℃,12 000 r/min离心30 min后除去上层乳糜微粒(CM)后备用。配置密度液,以固体NaBr调整血清密度为1.3 g/mL,分别配制密度为1.2 g/mL NaBr,1.006 g/mL NaCl溶液及1.0 g/mL双蒸水,(其中含0.01%EDTA,pH 7.6)用Abbe折光仪测定折光率,用CRC Handbook of Chemistry and Physics查得所对应的密度,调整所配溶液的密度。按郭刚及 Byung H.的方法建立密度梯度于(10~15)℃,542 000 r/min(28 000 g)条件下超速离心5 h,吸出中间黄色液体为LDL(d=1.040 0~1.056 0),经聚丙烯酰胺凝胶电泳鉴定纯度,LDL定量分析按Lowry方法测定蛋白含量,在Shimadzu UV-260紫外分光光度计上测595 nm处A值。LDL在4℃含10 mg/L EDTA的0.01 mol/L PBS中避光透析72 h,中间8 h换液一次,过滤除菌,4℃保存。
1.2 低密度脂蛋白的氧化修饰及修饰程度鉴定
将LDL于0.01 mol/L PBS中充分透析24 h除去EDTA后放置于终浓度为5 μmol/L的硫酸铜溶液中 37℃ 氧化 24 h加入终浓度为 200 μmol/L EDTA终止氧化反应,而后于4℃含100 mg/L EDTA的0.01 mol/L PBS中透析24 h。用硫代巴比妥酸反应物质(thiobarbituric acid reactive substance,TABRS)的含量来鉴定LDL的修饰程度。采用方明的方法测定TBARS含量,总胆固醇的定量分析根据CHOD-PAP方法测得,LDL的氧化修饰程度以每克胆固醇的TBARS含量来表示。
1.3 巨噬细胞的收集和培养
取纯系 615健康小鼠(雄性 20~25 g,8~10周)普通饲料喂养1周后将小鼠断颈处死,消毒后腹腔内注射无血清DMEM培养液5 mL,收集腹腔液以800 r/min离心10 min弃上清液收集细胞,用含20%小牛血清的DMEM培养液调整细胞浓度,以109/L密度种植在45 mL培养瓶中,每瓶约3 mL,在37℃ 5%CO2的培养箱中培养24 h,弃培养液,PBS冲洗掉未贴壁的细胞。分成3组,分别加入空白对照液(含 20%小牛血清,100 kU/L青霉素和 100 mg/L链霉素DMEM培养液),含10 mg/L LDL及10 mg/L OX-LDL 培养液各 3 mL,继续培养 24、48、72、96 h,另分为五组,分别加入含 10、30、50、100 μg/L LDL或OX-LDL培养液。
1.4 细胞内胆固醇的定量分析
将培养后的细胞弃培养液用PBS冲洗3次,冰浴30 min后用橡皮刮子刮下细胞800 r/min离心10 min收集细胞,加入0.5 mL异丙醇,匀浆破碎细胞,800 r/min离心10 min取上清液用总胆固醇试剂盒及游离胆固醇试剂盒分别测定总胆固醇(TC)及游离胆固醇(FC)含量,沉淀用0.1 mol/L NaOH 0.2 mL裂解细胞,用Lowry法测得细胞内蛋白质含量。细胞内胆固醇含量用每克蛋白所含的总胆固醇,游离胆固醇和胆固醇酯来表示,胆固醇酯(CE)含量由总胆固醇与游离胆固醇的差值来获得。
1.5 细胞的形态学观察
将收集的腹腔巨噬细胞以109/L密度接种于3.5×1.5 cm2盖玻片,实验条件同前。培养结束后以PBS洗3次采用苏丹III-IV混合染色的方法。
取培养24 h后的巨噬细胞PBS冲洗3次取下细胞离心收集,于细胞团块中加入2.5%戊二醛4℃固定3 h,梯度丙酮脱水,树脂包埋,切片后经醋酸双养铀-枸橼酸铅双重染色后,用JEM-2000EX透射电镜摄片。
1.6 CD54和CD36测定
消化并收集细胞,以1 000 r/min离心10 min,弃上清,用 PBS冲洗 2次,然后加入 20 μL CD54、CD36抗体避光染色20 min,加入400 μL PBS置于流式细胞仪下进行检测。
1.7 统计学方法
所有计量资料以均值±标准差表示,显著性检验用配伍组设计的多个样本均数比较的t检验
2 结果
2.1 低密度脂蛋白的鉴定、定量分析及氧化低密度脂蛋白氧化程度鉴定
利用聚丙烯酰胺凝胶电泳技术采用5%分离胶,3%浓缩胶,以血清蛋白为对照鉴定所制备低密度脂蛋白,经考马氏亮蓝染色为单一区带,且位置与血清β-球蛋白位置相当,利用电子计算机图像分析仪测定相对纯度可达92.39%,蛋白含量为1.26 mg/mL,总胆固醇含量为60.85 mg/dL,基本上与以往文献报道相符。LDL氧化修饰程度:LDL为2.87 μmol/g,OX-LDL 为 26.5 μmol/g(图 1)。

图1 聚丙烯酰胺凝胶电泳鉴定、定量LDL和OX-LDLFig.1 Quantification of LDL and OX-LDL by polyacrylamide gel electrophoresis
2.2 低密度脂蛋白的氧化修饰及修饰程度鉴定
为进一步研究低密度脂蛋白与氧化型低密度脂蛋白对巨噬细胞影响,我们进行了在不同时间(表1、图2)、不同浓度条件下(表2、图3)对LDL和ox-LDL对巨噬细胞进行了形态学分析(图2~3)。
2.3 细胞形态学观察
培养24 h后刮下贴壁细胞,经电镜观察可见不同层面的细胞均呈现巨噬细胞的超微结构特征,直径大约为5~10 μm,边缘犬牙交错的细胞核周围包含染色质,胞浆稀少含有大量的核糖体,线粒体丰富,同时还含有小的囊状结构及一定数目的致密颗粒,为溶酶体结构。说明贴壁细胞基本上来源于小鼠腹腔巨噬细胞(图4)。
2.4 细胞内胆固醇的定量分析
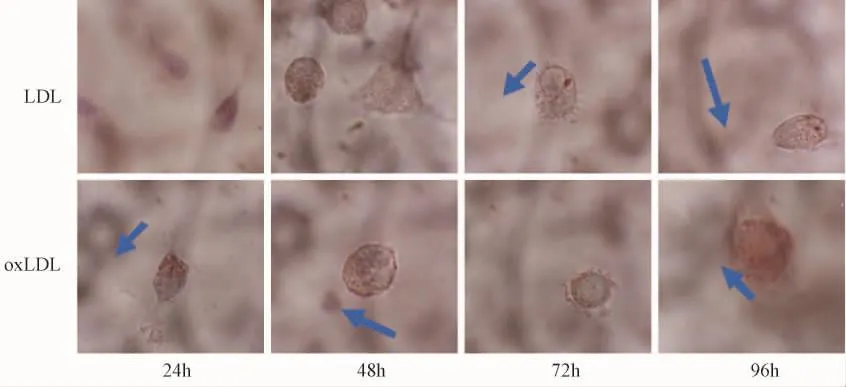
图2 不同时间条件下巨噬细胞形态学变化Fig.2 Morphological changes of macrophages at different time points
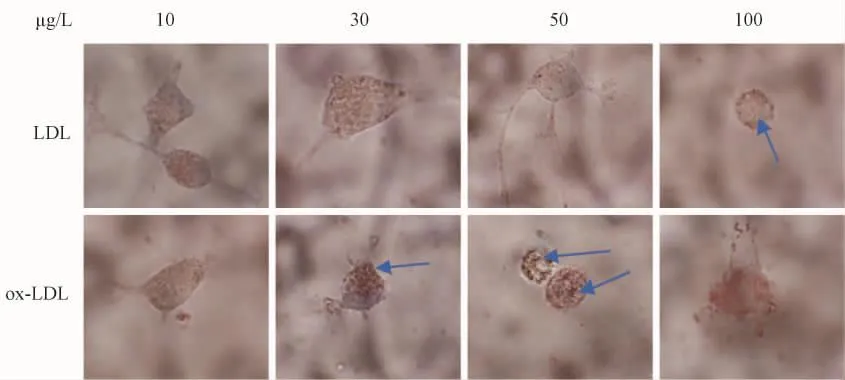
图3 不同浓度巨噬细胞形态学变化Fig.3 Morphological changes of macrophages at different concentrations

表1 不同时间条件下巨噬细胞形态学变化Tab.1 Morphological changes of macrophages at different time points

表2 不同浓度下巨噬细胞形态学变化Tab.2 Morphological changes of macrophages at different concentrations
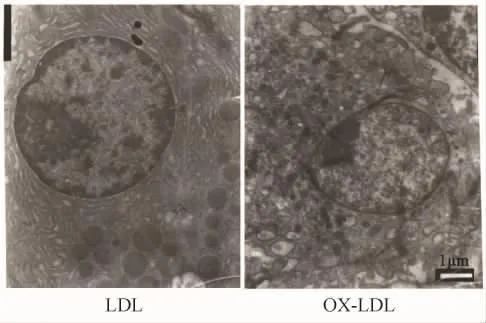
图4 24 h后的巨噬细胞电镜结果Fig.4 Electron micrographs of LDL-and ox-LDL-treated macrophages after 24 h
用无脂蛋白DMEM培养的单核巨噬细胞为对照培养组,实验结果单核巨噬细胞与10 mg/L的LDL或OX-LDL孵育不同时间后,细胞内的总胆固醇和游离胆固醇均较对照组明显增加,且OX-LDL组比LDL组更为显著。随着时间的延长LDL组细胞内总胆固醇,游离胆固醇的量保持相对恒定,而OX-LDL组细胞内总胆固醇持续增加,游离胆固醇的含量基本不变,胆固醇酯的含量逐渐增加。最终表现为胆固醇酯在总胆固醇的比例增大约占50%左右,符合泡沫细胞的形态学及细胞学定义。
以不同浓度的LDL及OX-LDL同巨噬细胞培养48 h后,可见随浓度的增加LDL组及OX-LDL组细胞内 TC、FC、CE均较对照组明显增加,且 OXLDL组较LDL组更为明显。其中LDL组在高浓度时仍表现为一定的饱和性,即 TC、FC、CE三者相对恒定,而OX-LDL组则表现为当浓度小于50 μg/mL时随浓度的增加,细胞内TC、FC、CE逐渐增加,在30~50 μg/mL时尤为明显,当浓度大于 50 μg/mL时,随浓度的增加细胞内的脂质含量反而减少(图5)。
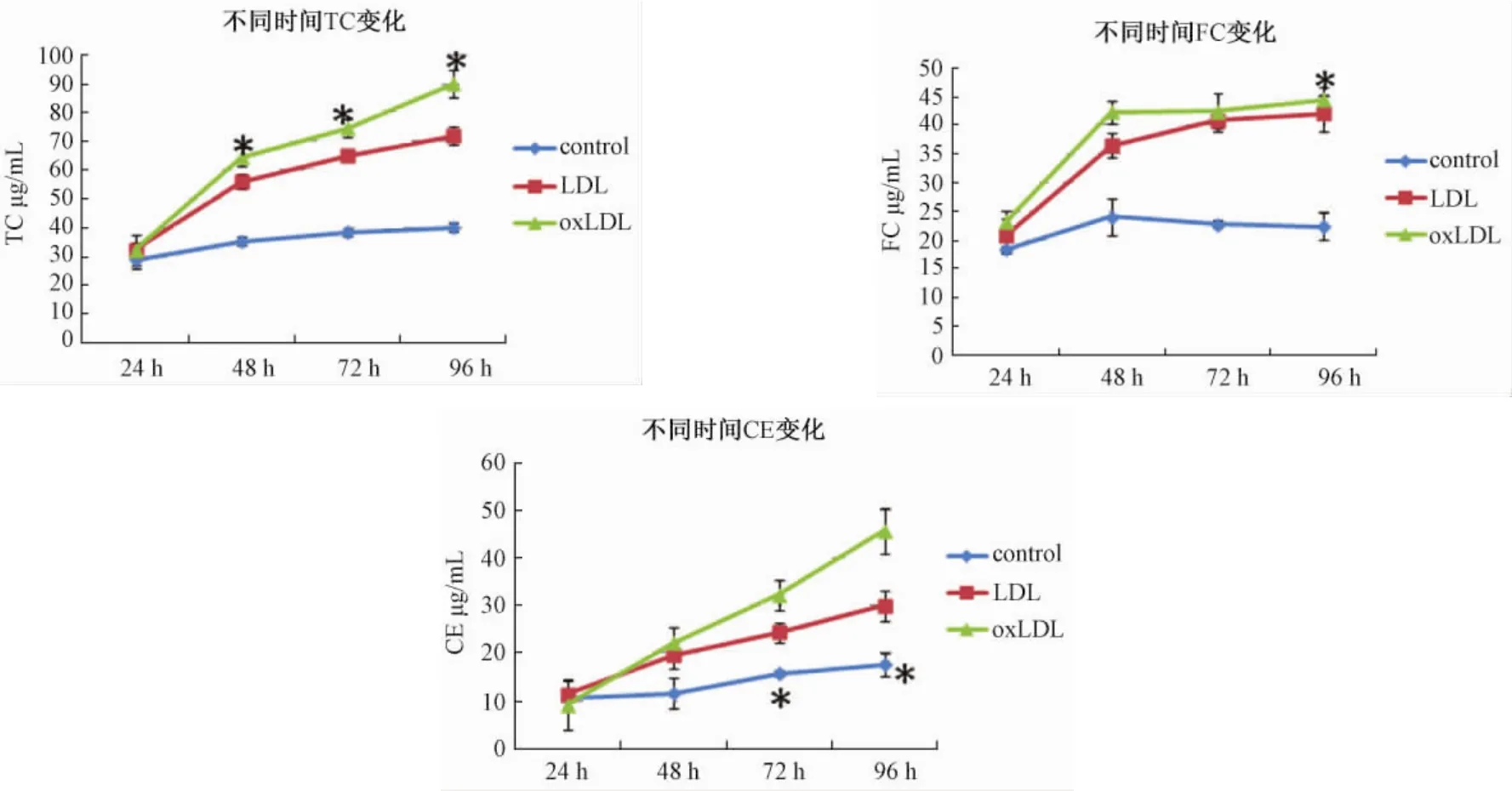
图5 不同时间 TC、FC、CE变化情况Fig.5 Expression of TC,FC,CE at different time points
2.5 ox-LDL对细胞内CD54表达的影响
本研究发现ox-LDL能显著诱导细胞表面CD54的表达,LDL诱导表达作用不明显(图6)。

图6 LDL ox-LDL对细胞内CD54变化影响Fig.6 Effects of LDL and ox-LDL on CD54 expression in the cells
本研究还进一步的观察了细胞在LDL和ox-LDL慢性刺激下CD36的表达情况。在泡沫细胞的形成中,CD36介导的对修饰的 LDL(包括 Ox-LDL和乙酞化的LDL)的内吞起着重要的作用,研究显示,LDL,ox-LDL可以促进细胞膜表面受体CD36的表达(图7)。
3 讨论
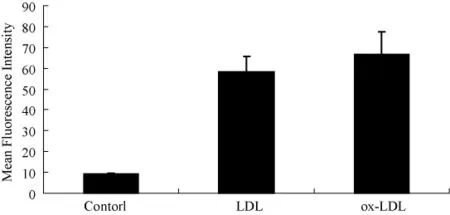
图7 LDL ox-LDL对细胞表面受体CD36变化影响Fig.7 Effects of LDL and ox-LDL on CD36 expression in the cells
本文采用一次性密度梯度超速离心的方法,综合以往文献的经验,成功地由健康人血浆中分离出低密度脂蛋白,并在体外由Cu2+氧化制备成氧化型低密度脂蛋白,经聚丙烯酰胺凝胶电泳及测定TBARS含量鉴定其纯度及氧化程度同以往文献记载基本一致,满足本实验的要求。
统一培养条件下不同时间点培养的细胞内总胆固醇的含量,OX-LDL组较LDL组增高,我们分析此现象原因有三,第一,可能是巨噬细胞对OX-LDL的摄取速度高于对LDL的摄取,由于OX-LDL其结构的改变而使之与LDL受体亲合性下降转而通过与之具有更高亲合性的清道夫受体特异性相结合,为巨噬细胞大量吞噬。第二,M体外培养的巨噬细胞中加入OX-LDL后可以刺激其产生巨噬细胞集落刺激因子(MCSF),MCSF可以在DNA水平促进SR基因表达,促使巨噬细胞对OX-LDL的摄入。第三,OX-LDL可以诱导一种细胞内核受体 PPARr表达,该受体可以同编码脂代谢有关的酶和蛋白的结构基因结合,而发挥转录调节的作用。而当巨噬细胞同OX-LDL相作用时,PPARr高水平表达直接作用于细胞表面CD36受体基因使之高水平转录翻译从而使细胞表面CD36受体数目增多而使OX-LDL摄入量进一步增加。
巨噬细胞泡沫化过程中出现细胞内堆积的脂质逐渐增多,当堆积的脂质超过了细胞的清除能力则形成特征性的巨噬细胞源性泡沫细胞。当巨噬细胞以胞饮的方式摄取大量 OX-LDL后,由于OXLDL其组成结构与性质的改变,细胞内的脂质代谢异常,OX-LDL-受体复合物首先进入溶酶体内,胞浆内ACAT由于OX-LDL的进入而被激活,在ATP供能情况下将FC同油酸再次酯化,形成胆固醇酯,无法通过细胞膜排除细胞外,在电镜下观察为无膜包绕的脂滴形式存在于细胞内。故在24~48 h,细胞内CE较FC增加迅速,所占细胞内总胆固醇比例高。随着时间的延长,溶酶体内来源于OX-LDL的神经鞘磷脂(sphingomyelin,SM)堆积,形成 SM-UC颗粒,使 UC不能通过溶酶体膜,溶酶体渗透性下降,SMase的活性而导致大量的非酯化胆固醇堆积于溶酶体内,而无法进入胞浆 FC代谢库,使 CE生成下降,酯化作用减慢。故随着时间的增加,表现为FC增加,而CE增加较明显,但总胆固醇始终表现为增加。清道夫受体的表达与活性不受体内游离胆固醇水平的负反馈调节,因此可以无限制摄取氧化低密度脂蛋白,随着OX-LDL的大量摄入,表现为OX-LDL分解减少,而以脂蛋白形式存在于细胞内,其apoB的抗原活性保留,同时含有以胆固醇酯为主的脂质。因此表现为FC量基本不变,而CE量仍表现为增加,TC量增加。
研究发现OX-LDL中含有的过氧化产物LOOH及溶血卵磷酯对体外培养的巨噬细胞有毒性作用,可以破坏细胞的膜性结构,改变其通透性,从而使细胞坏死,脱壁。无论巨噬细胞是调亡还是坏死都是细胞代谢等一系列生命活动的终止,走向死亡的标志,在宏观上表现为当 OX-LDL浓度〉50 μg/mL时,随着浓度的增加细胞内 TC,FC及CE的量反而减少。此外,同一浓度下OX-LDL组较LDL组细胞内脂质含量明显增高,说明OX-LDL较LDL更易使单核巨噬细胞形成泡沫细胞。
已有研究表明,巨噬细胞中的肌动蛋白一细胞骨架在动脉粥样硬化脂蛋白胆固醇醋化中起着重要的作用。本研究表明,巨噬细胞中CD36介导的细胞内吞伴随着 F-actni网络的增加[7]。Ox-LDL显著诱导CD36的提高。结果提示,在胞浆区局部F-actin的积聚不但存在己有肌动蛋白纤维的重新分布,而且也有新的actin多聚化产生。
ICAM-1即CD54是属于免疫球蛋白超家族的一种细胞粘附分子,正常情况下仅在血管内皮细胞较大量地持续表达,它与单核细胞表面的白细胞功能相关抗原LFA-I、巨噬细胞分化抗原 Mac-D以配体一受体的方式结合并参与介导单核细胞与血管内皮细胞的粘附[8]。受炎症因子、内毒素等刺激后也可使单核细胞上微量表达的CIAM-1上调,在多种细胞中发现人IAM-I的表达,包括内皮细胞、单核细胞、淋巴细胞、滤泡树突细胞、成纤维细胞和上皮细胞。本研究检测了 LDL与 ox-LDL对细胞内CD54的表达,结果显示 ox-LDL可以增加细胞内CD54表达,提示单核细胞的积聚可能随ox-DLD增加而增加。
[1] Ross R.The pathogenesis of atherosclerosis:a perspective for the 1990s[J].Nature,1993,362(6423):801 -809.
[2] Katagiri H,Yamada T,Oka Y.Adiposity and cardiovascular disorders:disturbance of the regulatory system consisting of humoral and neuronal signals[J].Circ Res,2007,101(1):27-39.
[3] Glass CK,Witztum JL.Atherosclerosis:the road ahead[J].Cell,2001,104(4):503 -516.
[4] Steinberg D.Atherogenesis in perspective:hypercholesterolemia and inflammation as partners in crime[J].Nat Med,2002,8(11):1211-1217.
[5] 李 莉,张锦,刘聪,等.致动脉粥样硬化食小鼠的肝脏改变及其清道夫受体B1的表达[J].中国比较医学杂志,2004,4(14):100.
[6] 卢笑丛,王有为.血脂类代谢研究中的转基因动物模型[J].中国比较医学杂志,2004,5(14):313-317.
[7] Vicca S,Massy ZA,Hennequin C,et al.Apoptotic pathways involved in U937 cells exposed to LDL oxidized by hypochlorous acid[J].Free Radic Biol Med,2003,35(6):603-615.
[8] Vijayagopal P, Srinivasan SR, Lipoprotein-proteoglycan complexes from atherosclerotic lesions promote cholesteryl ester accumulation in human monocytes/macrophages[J].Arterioscler Thromb Vasc Biol 1992,12(2):237-249.
