两株紫色红曲菌根癌农杆菌介导的T-DNA 转化子的生物学特性*
2013-11-25曹丽凌齐育平梁帅帅施晓莉蒋冬花
曹丽凌,齐育平,梁帅帅,施晓莉,蒋冬花
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
红曲菌(Monascus spp.)又称为红曲霉,是我国传统的食用和药用微生物,在我国己有上千年的应用历史[1].近二十年来,红曲菌的许多功效相继被证实,它能分泌产生红曲色素、莫呐可琳类(Monacolins)物质、γ-氨基丁酸、麦角固醇和丰富的水解酶类等多种有益代谢产物[2-5],是生产食品发酵剂、着色剂、保健食品、药品或其他原料的重要微生物资源[6-9].但是,自Blanc 等[10]研究发现某些红曲菌株能产生对人体有害的真菌毒素——桔霉素(citrinin)以来,红曲菌及其相关制品的安全性一直存在着争议,从而影响到我国红曲产品的出口.因此,如何调控红曲菌的桔霉素代谢基因、降低桔霉素含量,是当前红曲菌研究的重要方向[11].为了有效地控制红曲中桔霉素的含量,提高红曲色素等有益次生代谢产物的产量,有必要从分子水平研究桔霉素与红曲色素等其他代谢产物之间的相互关系.
本实验利用根癌农杆菌介导转化法转化紫色红曲菌,筛选得到2 株产色素发生显著变化的转化子菌株S62 和S158,并对其菌落形态、生长速度、显微结构、桔霉素含量及其遗传稳定性等进行了分析,以期阐明红曲色素代谢的分子机制,进而为从分子水平上调控红曲中的色素产量奠定基础,也为今后从红曲菌中获得产色素相关基因提供研究材料.
1 材料与方法
1.1 菌株
原始菌株:由本实验室筛选并保藏的一株高产红曲色素的紫色红曲菌(Monascus purpureus)菌株S.
转化菌株:转化子菌株S62 和S158 来自本实验室构建的紫色红曲菌T-DNA 插入突变体库,并由本实验室保藏.经鉴定,转化子菌株S62 和S158 中均含潮霉素抗性标记基因.
1.2 主要培养基
1)CYA 培养基 蔗糖30 g,NaNO33 g,酵母提取物5 g,K2HPO41 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,琼脂18 g,蒸馏水加至1 L,pH 6.0.
2)MEA 培养基 麦芽浸出粉20 g,蛋白胨1 g,葡萄糖20 g,琼脂15 g,蒸馏水加至1 L,pH 6.0.
3)葡萄糖乙醇培养基 葡萄糖50 g,蛋白胨20 g,KH2PO48 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·7H2O 0.01 g,乙 醇2 mL,琼 脂20 g,蒸馏水加至1 L,pH 6.0.
4)摇瓶培养基 葡萄糖50 g,蛋白胨20 g,KH2PO48 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·7H2O 0.01 g,乙醇2 mL,蒸馏水加至1 L,pH 6.0.
5)种子培养基 葡萄糖50 g,蛋白胨20 g,酵母提取物10 g,K2HPO410 g,MgSO4·7H2O 5 g,KCl 5 g,FeSO4·7H2O 1 g,蒸馏水1 L,pH 6.0.
6)固体培养基 将大米浸泡过夜,沥干后称量30 g 分装于250 mL 锥形瓶中.
以上培养基均在121 ℃灭菌20 min,培养基配方参照文献[12-13].
1.3 转化子菌株遗传稳定性测定
用无菌牙签将转化子S62 和S158 菌丝挑取到不含潮霉素的葡萄糖乙醇培养基上,30 ℃培养7 d.连续转接6 次后,再转接到含100 mg/mL 潮霉素的葡萄糖乙醇培养基上,同时接种原始菌株S 作为对照,30 ℃培养,观察突变子的生长情况和菌落形态,测定其稳定性.
1.4 转化子菌株菌落生长速度测定
将转化子菌株接种于MEA,CYA 和葡萄糖乙醇培养基上,30 ℃培养,同时接种原始菌株S 作为对照,72 h 后每隔12 h 测量一次菌落直径,直至菌落铺满整个平皿.
1.5 转化子菌株形态观察
将原始菌株S、转化子菌株S62 和S158 转接到MEA,CYA 和葡萄糖乙醇培养基中,30 ℃培养7~14 d,观察菌落形态、大小、颜色,在显微镜下观察菌丝、分生孢子和闭囊壳等显微形态特征.
1.6 转化子菌株发酵色价检测
1.6.1 液态发酵
将转化子菌株S62 和S158 及原始菌株S 接种于试管斜面上,30 ℃恒温培养7 d 至菌丝长满斜面.用5 mL 无菌水洗下孢子,按2%的接种量接入装有40 mL 摇瓶培养基的250 mL 锥形瓶中在30 ℃,200 r/min 振荡培养7 d.按照Kim 等[14]的方法,取发酵液按1 ∶1 的体积比加入70%乙醇液,60 ℃水浴2 h,10 000 r/min 离心10 min,取上清.以相同处理(加70%乙醇液)的不接入红曲菌的培养液作为空白对照.测定300~600 nm 波长下的吸光度,分析吸收峰值.通常以在505 nm处测得的A 值乘以稀释倍数的值作为色价[12].
1.6.2 固体发酵
将5 mL 孢子悬浮液接入装有50 mL 种子培养液的250 mL 三角瓶中,30 ℃,200 r/min 摇床上培养72 h,取发酵液备用.
将大米浸泡过夜,沥干,称量30 g 分装于250 mL锥形瓶中,121 ℃灭菌20 min,待其冷却后每瓶加入3 mL 红曲发酵种子液,30 ℃培养10 d,烘干,得红曲米成品[15].

1.7 转化子菌株发酵产物中桔霉素含量分析
参照Pastrna 等[17]的方法检测发酵后菌株中的桔霉素含量.取红曲菌发酵液或红曲米成品,加入10 mL 甲醇,制成样品溶液.取2 μL 样品溶液,同时取2 μL 10 mg/mL 桔霉素标准品溶液作为参照,点样于硅胶板上,展开剂为V(甲苯)∶V(乙酸乙酯)∶V(甲酸)=6 ∶3 ∶1,展开,在紫外灯下显影,拍照.
2 结果与分析
2.1 遗传稳定性检测
作为研究基因功能的材料,要求其在遗传上具有稳定性.本实验将转化子菌株S62 和S158 接种到葡萄糖乙醇培养基上,对突变子菌株进行稳定性检测.结果显示,转化子菌株S62 和S158 均能在含有100 mg/mL 潮霉素的葡萄糖乙醇培养基上正常生长,而原始菌株S 无法正常生长.这表明潮霉素抗性基因已经整合到转化子红曲菌基因组中,并能稳定遗传.
2.2 菌落生长速度测定
将转化子菌株S62 和S158 接种于MEA,CYA 和葡萄糖乙醇培养基平皿上,30 ℃培养,同时接种原始菌株S 作为对照,接种72 h 后,每隔12 h 测量一次菌落直径.结果(见图1)显示:在MEA 和葡萄糖乙醇培养基上,转化子菌株S62 和S158 开始时生长速度都比原始菌株S 缓慢;在CYA 培养基上,转化子菌株S158 生长速度比原始菌株S 快.在葡萄糖乙醇培养基中,与原始菌株S 相比,转化子菌株S62 虽然一开始菌落直径比原始菌株S 小,但在培养108 h 后,其菌落直径已与原始菌株S 相同,后来的生长速度甚至超过了原始菌株S.
2.3 菌落及显微形态观察
2.3.1 菌落形态
将转化子菌株S62 和S158 接种到MEA,CYA 和葡萄糖乙醇培养基上,30 ℃培养,在7 和14 d 时观察比较转化子菌株与原始菌株在菌落形态、颜色等方面的差异.结果表明,2 株转化子菌株在菌落颜色、形态及菌落生长速度上发生了较大的变化(见表1 和图2).
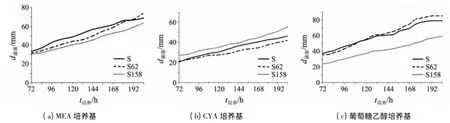
图1 MEA,CYA 和葡萄糖乙醇培养基上菌株的生长速度

表1 转化子S62 和S158 的菌落形态

图2 转化子S62 和S158 在不同培养基上的菌落形态
2.3.2 显微形态
显微镜下观察菌株的形态特征,结果如图3所示:原始菌株S 的菌丝粗壮,且红色色素颗粒多,分生孢子与子囊孢子较多,闭囊壳厚,囊内孢子清晰可见;转化子S62 菌丝透明且细小,基本无色素颗粒,隔膜不明显,闭囊壳数少,厚垣孢子较多,有少数分生孢子;转化子S158 菌丝细,有少量色素颗粒,部分菌丝透明,隔膜明显且部分节间膨大,闭囊壳较多且壁厚,囊内孢子不清晰,闭囊壳基本成熟,分生孢子少.

图3 转化子S62 和S158 菌株的显微形态(×200)
2.4 发酵产物色价检测
分别测定了红曲菌液态和固态发酵产物的色价,结果如图4 所示:在液态发酵条件下,与原始菌株S 相比,转化子菌株S62 和S158 的色价均大幅度降低,原始菌株S 的色价为66.37 U/mL,转化子菌株S158 的色价为17.62 U/mL,S62 仅为2.71 U/mL,只有原始菌株S 色价的0.04 倍;固体发酵的结果与之类似,转化子菌株S62 的色价为556 .51 U/g,S158 的色价为724.83 U/g,而原始菌株S 的色价为1 664.74 U/g.

图4 转化子和原始菌株液态和固态发酵的色价比较
将红曲菌原始菌株S 与转化子菌株S62 和S158的乙醇浸提液适当稀释后,于300~600nm波长下进行紫外-可见光谱扫描,扫描图谱见图5.结果表明,红曲菌转化子菌株S62 和S158 不仅色价发生了明显下降,而且吸收峰位置也发生了变化.原始菌株S 有2 个吸收峰,都在400~500 nm;而转化子菌株S158 虽然有2 个吸收峰,但其中1 个吸收峰在500~530 nm 处;转化子菌株S62 只在380~420 nm 左右有1 个吸收峰.此现象的原因可能是转化子的色素代谢途径发生了变化,使色素的组成发生了改变,这对色素相关基因的研究有重要意义.

图5 原始菌株与转化子的70%乙醇液浸提物的紫外-可见光扫描图
2.5 桔霉素含量分析
采用薄层色谱法定性分析转化子菌株S62 和S158 发酵液中桔霉素含量的变化,结果见图6.

图6 发酵液和红曲米中桔霉素含量的TLC 分析
由图6 可以看出,红曲菌转化子菌株S62 和S158 发酵液及红曲米固体发酵后,桔霉素含量与原始菌株S 相比发生了不同程度的变化.S158 的桔霉素含量与原始菌株S 相比,条带暗了很多;而突变子菌株S62 发酵液中的桔霉素在254 nm 紫外光照射下几乎检测不到条带.
3 讨论
农杆菌介导转化法是一种常用的研究基因功能的反向遗传学策略[18].本实验采用农杆菌介导转化法使T-DNA 插入到红曲菌基因组,通过影响某些基因的表达引起突变,这些突变将会导致各个方面的变化,菌株形态发生突变是比较直观的方面,而这些直观变化又常常和其他的重要改变相关联,如次级代谢产物的变化等.
本研究发现,与原始菌株S 相比,转化子菌株S62 和S158 菌落形态的变异主要表现在以下几个方面:1)菌落颜色有变化.2 株转化子菌株在颜色上发生了很大的变化,变淡甚至变为白色.2)菌落生长速度及菌落大小发生改变.相对于原始菌株S 的生长情况,2 株转化子都有明显的不同.3)气生菌丝形态有变化.2 株转化子的菌丝都比原始菌株S 长且密,呈绒毛状.4)菌落发生隆起突变.在不同的培养基上,转化子有不同程度的隆起.5)菌落辐射纹或裂纹有变化.原始菌株S 的菌落会出现明显裂纹,而2 株转化子的菌落裂纹减少甚至没有出现.6)菌落显微特征发生改变.通过显微观察发现,2 株转化子的菌丝直径、色素颗粒、分生孢子及闭囊壳都有明显的改变.
本实验对2 株转化子菌株S62 和S158 产色素及桔霉素的能力进行了分析测定,结果表明,转化子菌株产色素及桔霉素的能力发生了不同程度的变化.这可能是由于T-DNA 插入位点不同或者是插入位点多样性阻断了其与不同代谢产物代谢途径有关的基因位点所引起的;也可能是红曲菌的代谢产物存在部分共同的代谢途径,阻断了其中的一个位点,从而影响到其他代谢产物的生成.有研究认为,洛伐他汀、红曲色素和桔霉素三者都是聚酮体合成酶(PKSs)催化合成的产物[19].若能找到控制桔霉素合成途径中编码酶的基因,就有望通过定点敲除等技术阻断桔霉素的生成,同时不影响甚至促进红曲色素的产生[20].采用分子生物学手段改造和利用红曲菌[21],使红曲产品安全地运用于食品及其他产品中,今后还应在红曲菌基因组序列及遗传学方面进行进一步的深入研究,利用基因改造技术获得高产色素、不产桔霉素的菌种,使之成为安全的食品添加剂.
[1]傅金泉.中国红曲及其实用技术[M].北京:中国轻工业出版社,1997.
[2]Su Yuanchi,Wang J J,Lin T T,et al.Production of the secondary metabolites gamma-aminobutyric acid and monacolin K by Monascus[J].J Ind Microbiol Biotech,2003,30(1):41-46.
[3]Campoy S,Rumbero A,Martín J F,et al.Characterization of an hyper pigmenting mutant of Monascus purpureus IB1:identification of two novel pigment chemical structures[J].Appl Microbiol Biotechnol,2006,70(4):488-496.
[4]Endo A.Monacolin K,a new hypocholesterolemic agent produced by a Monascus spesies[J].J Antibiotics,1979,32(3):852-854.
[5]Wang J J,Lee C L,Pan T M.Improvement of monacolin K,γ-aminobutyric acid and citrinin production ratio as a function of environmental conditions of Monascus purpureus NTU 601[J].J Ind Microbiol Biotech,2003,30(11):669-676.
[6]Gremmels J F,Dresel J,Leistner L.Use of Monascus extracts as an alternative to nitrite in meat products[J].Fleischwirtschaft,1991,71(3):329-331.
[7]Iizuka H,Lin C R.On the genus Monascus of Asia and its specific characteristics[J].Adv Biotechnol,1981,2:555-561.
[8]Gremmels J F,Dresel J,Leistner L.Use of Monascus extracts as an alternative to nitrite in meat products[J].Fleischwirtschaft,1991,71(3):329-331.
[9]宋洪涛,宓鹤鸣,郭涛.中药红曲的研究进展[J].药学实践杂志,1999,17(3):172-174.
[10]Blanc P J,Loret M O,Goma G.Production of citrinin by various species of Monascus[J].Biotech Lett,1995,17(3):291-294.
[11]Ciegler A,Vesonder R F,Jackson L K.Production of patulin and citrinin from Penicillium expansum[J].Appl Environ Microbiol,1977,33(4):1004-1006.
[12]李钟庆,杨晓暾,郭芳.综观红曲与红曲菌[M].北京:中国轻工业出版社,2009.
[13]Jiang Donghua,Ji Hao,Ye Yan,et al.Studies on screening of higher γ-aminobutyric acid:producing Monascus and optimization of fermentative parameters[J].Eur Food Res and Technol,2011,232(3):541-547.
[14]Kim H J,Kim J H,Oh H J,et al.Morphology control of Monascus cells and scale-up of pigment fermentation[J].Process Biochem,2002,38(5):649-655.
[15]Lee B K,Piao Haiyan,Chuang W J.Production of red pigments by Monascus purpureus in solid-state culture[J].Biotechnol Bioprocess Eng,2002,7(1):21-25.
[16]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB 4926-2008 食品添加剂 红曲米(粉)[S].北京:中国标准出版社,2008.
[17]Pastrna L,Blanc P J.Production of citrinin by Monascus ruber submerged culture in chemically defined media[J].Acta Biotechnol,1996,16(4):315-319.
[18]Shao Yanchun,Ding Yuedi,Zhao Ying,et al.Characteristic analysis of transformants in T-DNA mutation library of Monascus ruber[J].World J Microbiol Biotechnol,2009,25(6):989-995.
[19]鲁佳慧,刘昕,王江海,等.红曲的生产工艺及Monacolin K 和桔霉素的检测[J].现代食品科技,2006,22(1):144-146.
[20]邵彦春,李利,杨莎,等.根癌农杆菌介导的定点敲除技术在红色红曲菌中的应用[J].微生物学通报,2009,36(2):231-237.
[21]邵彦春,丁月娣,陈福生,等.TAIL-PCR 法快速分离红曲霉色素突变株T-DNA 插入位点侧翼序列[J].微生物学通报,2007,34(2):323-326.
