雷帕霉素与大鼠肝纤维化演变的相关研究
2013-11-24钟志宏陈土明吴祖超
钟志宏,戴 东,陈土明,吴祖超
(广东医学院附属医院 肝胆外科,广东 湛江524001)
转化生长因子(TGF-β1)是属于一组新近发现的调节细胞生长和分化的TGF-β超家族,研究显示TGF-β1在肝纤维化的发生发展中起着重要的作用。本实验选择大鼠肝纤维化模型,应用mTOR受体抑制剂雷帕霉素(RAPA)治疗,观察其对大鼠肝脏TGF-β1的表达及雷帕霉素对肝纤维化的影响,探讨雷帕霉素在肝纤维化演变中的作用。
1 材料与方法
1.1 实验动物及模型的制备 成年健康雄性SD大鼠24只,体重200-250g,由广东医学院动物实验中心提供。按四氯化碳油(CCl4油)诱导建立大鼠肝纤维化模型。
1.2 实验方法 24只SD大鼠随机分为3组:正常对照组(A组)、肝纤维化模型组(B组)、雷帕霉素组(C组)每组8只。B、C组建立模型;C组按雷帕霉素2mg/kg体重胃内灌灌注,每天1次,持续2周。A、B组按同剂量予生理盐水灌胃,每天1次,持续2周。同期处死取肝脏组织切片,对肝组织切片分别行HE染色及免疫组织化学法处理,相片用Imagepro plus 6.0图像分析软件处理。
1.3 统计学分析
使用SPSS 17.0统计软件处理数据。计量资料用均数±标准差(±s)表示。组间比较采用独立样本的t检验。实验各组间比较差异有显著统计学意义(P<0.01)
2 结果
2.1 HE染色对肝脏组织的变化 见图1。
2.2 雷帕霉素对肝脏TGF-β1表达 见图2,表1。

图1 HE染色对肝脏组织的变化
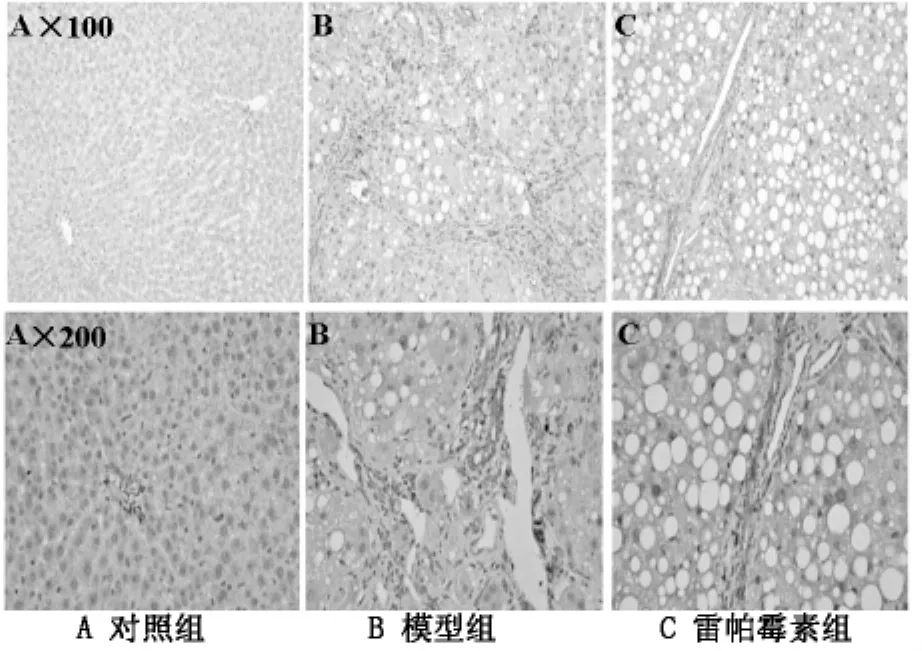
图2 雷帕霉素对肝脏TGF-β1表达

表1 大鼠肝脏组织TGF-β1的阳性表达
3 讨论
近年来研究发现,TGF-β1可促进肝纤维化,通过TGF/Smad信号通路进行调控ECM的沉积,TGF-β1的大量表达,促使ECM过度沉积,加速肝纤维化。在肝硬化形成过程中抑制、缓解及延缓病程发展是基础与临床研究的重点。本实验病理HE染色及免疫组织化学结果观察到,模型组中肝纤维化明显,纤维间隔穿插其中;应用雷帕霉素2周后,TGF-β1表达明显下降,纤维间隔程度也较模型组减少。结果显示,雷帕霉素可抑制纤维肝大鼠肝组织中TGF-β1表达。TGF-β在正常肝脏组织中转录水平很低,而在肝纤维化模型中,在大多数的间充质细胞、单核细胞、肝细胞中TGF-βRNA转录处于高水平,TGF-β家族中尤以TGF-β1在肝纤维化的发生发展中有着重要的作用[1]。相关资料对HSC凋亡的调节因子主要有抑制HSC凋亡的生长因子如TNF-α、TGF-β、IFN-α、leptin 等[2],而细胞因子中只有TGF-β能刺激HSC合成胶原纤维,而其他细胞因子仅刺激HSC增殖[3],TGF-β通过TGF/Smad信号通路进行调控ECM的沉积。在肝纤维化进展期中,Kupffer Cell(KC)通过自分泌或旁分泌途径分泌大量TGF-β1,同时增加HSC上血小板衍生因子(PDGF)受体表达,通过自分泌循环分泌TGF-β1和PDGF,使HSC持续活化,抑制其凋亡。大鼠星状细胞体外培养活化后形态类似成纤维细胞,有研究者认为,HSC是成纤维细胞前体,在肝损伤时HSC活化转变为成纤维细胞,分泌ECM、细胞因子和蛋白酶抑制剂等成分参与肝纤维化进展[4]。雷帕霉素改善肝纤维化,与多途径调控TGF-β1表达相关。RAPA作为PI3K/AKT/mTOR信号通路抑制剂,抑制其激酶活性,阻断其细胞通路,抑制下游S6K1和4EBP1的磷酸化,从而抑制细胞分化和增殖[5-7]。KC作为肝脏固定于肝窦窦壁的巨噬细胞,RAPA阻断 巨噬细胞的PI3K/AKT/mTOR通路,减少细胞因子如 TNF-α、TGF-β1等的释放,抑制HSC增殖活化,促进HSC的凋亡,减少HSC转化为成纤维细胞,使ECM沉积减轻。单侧输尿管梗阻的老鼠模型中,通过封闭mTOR信号通路,抑制巨噬细胞和肌成纤维细胞,可以有效的改善患侧肾脏的纤维化[8]。RAPA也可以直接作用于HSC的Fas/Fasl系统,抑制细胞周期凋亡相关基因Bcl-2的转录,促进Fas/FasL系统中的重要因子Fas的表达,同时促进凋亡基因P53表达增多,启动Fas/FasL凋亡通路,上调P53、下调Bcl-2的表达实现HSC凋亡,抑制增殖[9,10],减少 ECM 的沉积。本实验通过应用mTOR信号通路抑制剂雷帕霉素,检测大鼠肝脏组织的病理形态改变及TGF-β1的表达,探讨雷帕霉素在肝纤维化进展中相关作用,实验结果显示:应用雷帕霉素大鼠,肝组织TGF-β1的表达明显降低,肝脏组织纤维化得以改善。
[1]Milani S,Herbst H,Schuppan D,et al.Transforming growth factors beta 1and beta 2are differentially expressed in fibrotic liver disease[J].Am J Pathol,1991,139(6):1221.
[2]Friedman S L.Mac the knife?Macrophages—the double-edgedsword of hepatic fibrosis[J].J Clin Invest,2005,115(1):29.
[3]Shek F W,Benyon R C.How can transforming growth factor beta be targeted usefully to combat liver fibrosis[J].Eur J Gastroenterol Hepatol,2004,16:123.
[4]Guyot C,Lepreux S,Combe C,Doudnikoff E,et al.Hepatic fibrosis and cirrhosis:the (myo)fibroblastic cell subpopulations involved[J].Int J Biochem Cell Bio,2006,38:135.
[5]Gao N,Flynn DC,Zhang Z,et al.G1cell cycle progression and the expression of G1cyclins are regulated by PI3K/AKT/mTOR/p70S6K1signaling in human ovarian cancer cells[J].Am J Physiol Cell Physiol,2004,287(2):C281.
[6]Gai B,Zhang Z,Jiang BH,et al.Role of PI3K/AKT/mTOR signaling in the cell cycle progression of human prostate cancer[J].Biochem Biophys Res Commun,2003,310(4):1124.
[7]Xu Z,Zhang Y,Jiang J,Yang Y,et al.Epidermal growth factor induces HCCR expression via PI3K/Akt/mTOR signaling in PANC-1pancreatic cancer cells[J].BMC Cancer,2010,10:161.
[8]Chen G,Chen H,Wang C,et al.Rapamycin ameliorates kidney fibrosis by inhibiting the activation of mTOR signaling in interstitial macrophages and myofibroblasts[J].PLoS One,2012,7(3):e33626.
[9]翁山耕,徐常国,孙 颖,等.雷帕霉素诱导大鼠肝形状细胞凋亡的研究[J].临床肝胆病杂志,2012,28(3):219.
[10]Shafer A,Zhou C,Gehrig PA,et al.Rapamycin potenciates the effects of paclitaxel in endometrial cancer cells through inhibition of cell proliferation and induction of apoptosis[J].Int J Cancer,2010,126(5):1144.
