脑蛋白水解物注射液对脑缺血再灌注大鼠的神经保护作用研究
2013-11-23温世斌刘国军夏金花哈小琴
温世斌 刘国军 夏金花 哈小琴
大面积脑梗死多由颈内动脉及大脑中动脉闭塞引起,氧化应激损伤在脑缺血后脑损伤中起重要作用[1-2]。脑蛋白水解物注射液是一种神经保护剂,所含生物活性低分子肽可通过血-脑脊液屏障,能有效抑制脑梗死后自由基的生成,抑制神经细胞的激活和凋亡,预防神经元变性。该研究旨在观察脑蛋白水解物注射液对大鼠脑缺血再灌注损伤的神经保护作用。
1 材料和方法
1.1 动物 成年健康雄性 Wistar大鼠80只,SPF级,体质量(300±20)g,5~6月龄,由甘肃中医学院实验动物中心提供。大鼠置常规实验室适应环境1周。
1.2 主要试剂和仪器 脑蛋白水解物注射液(商品名:施普善,EVER Neuro Pharma GmbH公司,奥地利);还原型谷胱甘肽(GSH)及一氧化氮合酶(NOS)、考马斯亮蓝蛋白、超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒均购自武汉博士德生物制品有限公司;分散式匀浆机(DY89-II,深圳点晶科学仪器有限公司);可调式水平离心机(Sigma公司);酶标板(Costar 9018系列,美国康宁公司);其余试剂均为国产分析纯。
1.3 方法
1.3.1 大鼠脑缺血再灌注损伤模型的制备:应用线栓法经右侧颈总动脉插线建立右侧大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)再灌注模型[3]。另随机取10只大鼠作为假手术组,仅分离颈总动脉和颈内动脉不进行线栓。将造模成功且成活的大鼠随机分为模型组、脑蛋白水解物注射液低剂量注射组、中剂量注射组和高剂量注射组,每组10只。另20只大鼠备用。给药剂量:再灌注后立即给药,模型组经尾静脉注射0.9%(质量浓度)生理盐水600μL,脑蛋白水解物注射液低剂量注射组、中剂量注射组和高剂量注射组分别经尾静脉注射300、600、1200μL脑蛋白水解物注射液注射液。
1.3.2 观察指标:分别于大鼠清醒后、再灌注24 h后根据Longa等5级评分方法[4]进行神经功能评分:0分:正常活动;1分:不能充分伸展左前肢;2分:向左侧转圈;3分:向左侧倾倒;4分:不能自己行走或意识障碍。选择神经功能评分在2~3分且伴左侧 Horner征阳性的大鼠用于实验。提高躯体摆动实验(EBST):大鼠清醒24h后,使大鼠倒悬离地约5cm,记录大鼠头向两侧方偏转的次数(以大鼠头部偏离身体中线约10°为准),重复该步骤10次。向缺血对侧(左侧)的旋转次数>75%即可认为造模成功[5]。
1.3.3 大鼠脑组织SOD、NOS活性及 GSH 、MDA含量的检测:各组大鼠于再灌注后24h后,取大脑中动脉供应区相同部位的脑组织,等重称取,加入9倍4℃生理盐水溶液制成10%组织匀浆,以2500r/min离心10min(低温、离心半径=150mm),吸取上清,按试剂盒说明书步骤操作,分别测定各组SOD、NOS活性及GSH和MDA含量。
1.4 统计学处理 采用SPSS16.0统计软件进行统计学处理。计量资料采用均数±标准差表示,多组均数间比较采用单因素方差分析,两两比较采用LSD法。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能比较 模型组神经功能评分高于假手术组,而对侧旋转次数百分比则低于假手术组(均P<0.05);与模型组比较,应用脑蛋白水解物注射液治疗后,脑蛋白水解物注射液低、中和高3个剂量组较模型组神经功能评分降低,对侧旋转次数百分比显著升高(均P<0.05)。脑蛋白水解物注射液中、高剂量组神经功能评分较低剂量组显著降低,对侧旋转次数百分比则显著升高(均P<0.05);但中等剂量注射组与高剂量注射组间比较,其神经功能评分和对侧旋转次数百分比差异无统计学意义(P>0.05,表1)。
表1 各组大鼠神经功能评分和对侧旋转次数百分比比较 (,n=10)
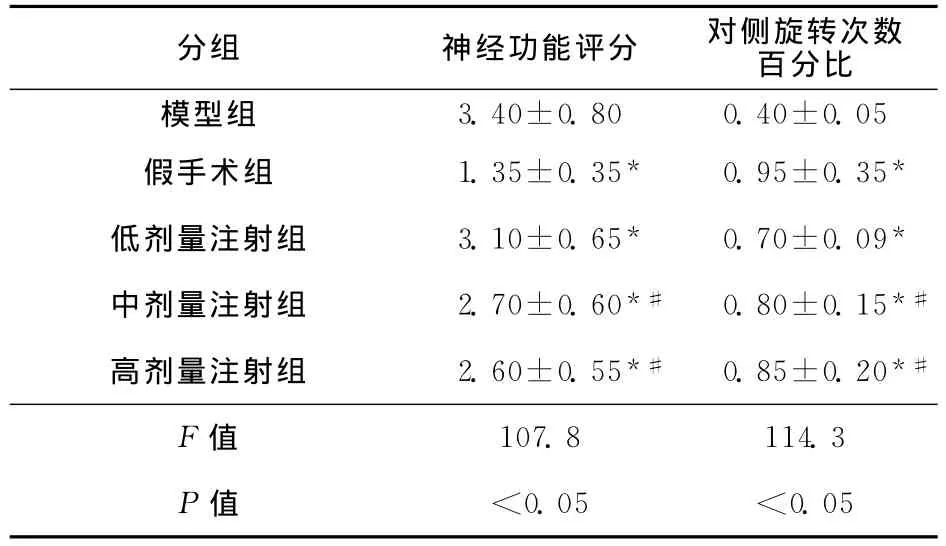
表1 各组大鼠神经功能评分和对侧旋转次数百分比比较 (,n=10)
注:低、中、高剂量注射组指脑蛋白水解物注射液低、中、高剂量注射组;与模型组比较,*P<0.05;与低剂量注射组比较,#P<0.05
分组 神经功能评分 对侧旋转次数百分比模型组3.40±0.80 0.40±0.05假手术组 1.35±0.35* 0.95±0.35*低剂量注射组 3.10±0.65* 0.70±0.09*中剂量注射组 2.70±0.60*# 0.80±0.15*#高剂量注射组 2.60±0.55*# 0.85±0.20*#F值107.8 114.3 P值 <0.05 <0.05
2.2 各组大鼠脑组织SOD和GSH活性及MDA含量比较 模型组与假手术组比较SOD活性和GSH含量显著下降,而MDA含量则显著升高(均P<0.05);与模型组比较,脑蛋白水解物注射液高、中、低剂量组SOD活性和GSH含量显著升高,MDA含量显著降低(均P<0.05)。脑蛋白水解物注射液中、高剂量组SOD活性和GSH含量较低剂量组升高,MDA含量则显著降低(均P<0.05);但中等剂量注射组与高剂量注射组间比较,各指标之间差异无统计学意义(P>0.05)。具体结果见表2。
表2 各组大鼠脑组织中SOD、MDA、GSH含量比较 (,n=10)
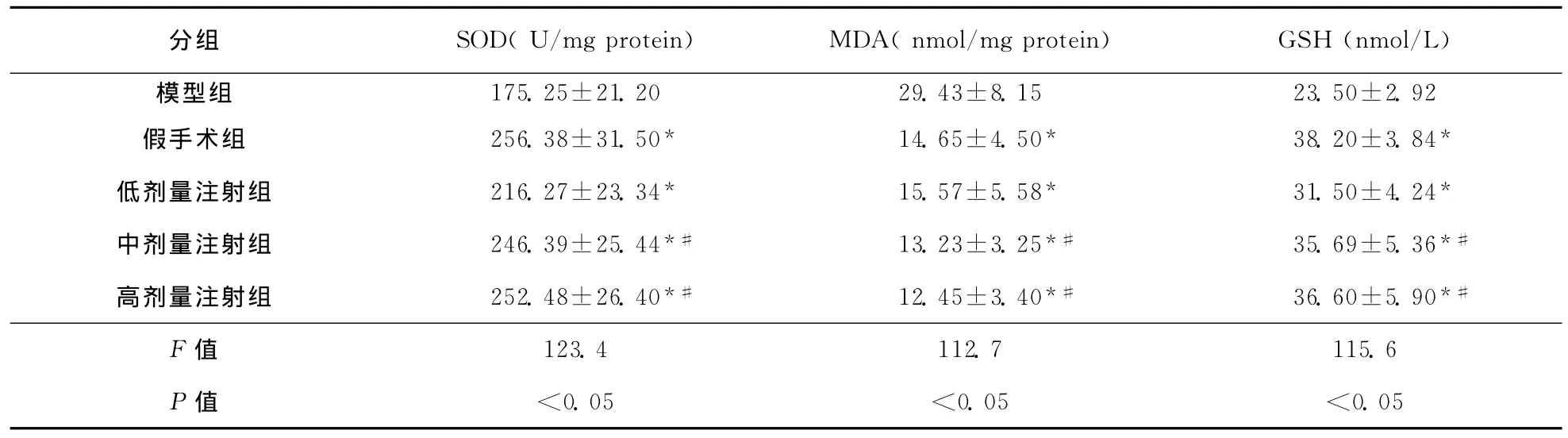
表2 各组大鼠脑组织中SOD、MDA、GSH含量比较 (,n=10)
注:低、中、高剂量注射组指脑蛋白水解物注射液低、中、高剂量注射组;与模型组比较,*P<0.05;与低剂量注射组比较,#P<0.05
分组 SOD(U/mg protein) MDA(nmol/mg protein) GSH(nmol/L)模型组175.25±21.20 29.43±8.15 23.50±2.92假手术组 256.38±31.50* 14.65±4.50* 38.20±3.84*低剂量注射组 216.27±23.34* 15.57±5.58* 31.50±4.24*中剂量注射组 246.39±25.44*# 13.23±3.25*# 35.69±5.36*#高剂量注射组 252.48±26.40*# 12.45±3.40*# 36.60±5.90*#F值123.4 112.7 115.6 P值 <0.05 <0.05 <0.05
表3 各组大鼠脑组织中总NOS、iNOS、cNOS含量比较 (,n=10,U/mg protein)
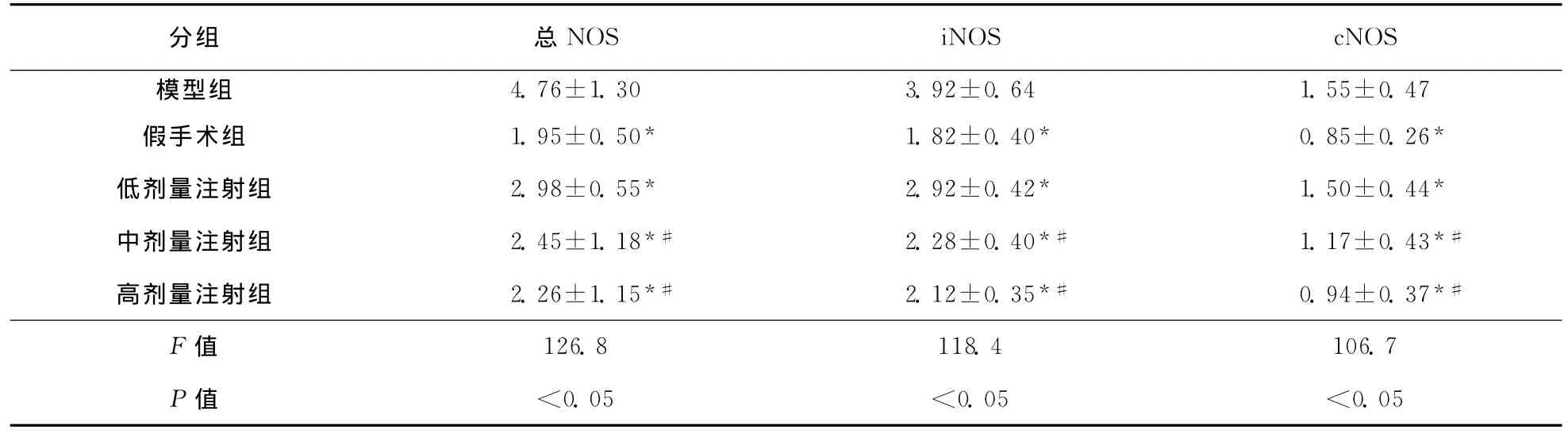
表3 各组大鼠脑组织中总NOS、iNOS、cNOS含量比较 (,n=10,U/mg protein)
注:低、中、高剂量注射组指脑蛋白水解物注射液低、中、高剂量注射组;与模型组比较,*P<0.05;与低剂量注射组比较,#P<0.05
分组 总NOS iNOS cNOS模型组4.76±1.30 3.92±0.64 1.55±0.47假手术组 1.95±0.50* 1.82±0.40* 0.85±0.26*低剂量注射组 2.98±0.55* 2.92±0.42* 1.50±0.44*中剂量注射组 2.45±1.18*# 2.28±0.40*# 1.17±0.43*#高剂量注射组 2.26±1.15*# 2.12±0.35*# 0.94±0.37*#F值126.8 118.4 106.7 P值 <0.05 <0.05 <0.05
2.3 各组大鼠脑组织总NOS、诱导型NOS(iNOS)、构建型NOS(cNOS)活性的影响 模型组与假手术组比较TNOS、iNOS、cNOS均显著升高(P<0.05);与模型组比较,脑蛋白水解物注射液各剂量组TNOS、iNOS、cNOS活性均明显降低(P<0.05);脑蛋白水解物注射液中、高剂量组TNOS、iNOS和cNOS活性较低剂量组均显著降低(P<0.05);中等剂量组与高剂量组间比较无统计学差异(P>0.05,表3)。
3 讨论
脑蛋白水解物注射液(Cerebrolysin)含有生物活性肽,有独特的神经保护和神经营养作用,在脑卒中病理级联反应的各个环节中具有保护神经细胞的作用。通过对脑蛋白水解物注射液抗氧自由基的研究为其在脑血管病治疗中的应用提供了新的思路和方法[6-8]。尤其神经保护和神经营养类药物对于大脑缺血后的修复以及预后评价等至关重要。脑蛋白水解物注射液已经应用于临床并在救治急性脑血管意外中具有较好的疗效,但有关其抗自由基损伤机制的研究报道较少。本研究通过建立大鼠脑缺血再灌注模型,观察脑蛋白水解物注射液对脑缺血再灌注脑组织中GSH、MDA、SOD、NOS含量的影响,旨在探讨脑蛋白水解物注射液是否具有抑制脑缺血再灌注后氧自由基生成和过氧化反应的作用,结果表明脑蛋白水解物注射液能显著提高脑缺血再灌注后SOD活力和降低MDA含量,从而起到脑组织保护的作用。
大量生成的氧自由基在缺血性脑损伤时可破坏组织及体液细胞及大分子,继而引起细胞凋亡[9],脑缺血再灌注后,自由基生成增多,自由基清除动态平衡破坏,导致细胞膜的脂质过氧化反应,造成组织损伤继续恶化,组织损伤再引起氧自由基的过多生成,是一个恶性循环过程[10-11]。超过生理量的NO释放可以通过自由基而产生神经毒性。对于缺血再灌注所形成的脑组织损伤,NOS的活性增强,表明 NO合成释放增加[12],SOD、MDA、GSH对于清除氧自由基有重要作用,可反映体内氧自由基的水平和组织损伤程度[13]。NOS各类型的活性则可反映组织损伤的阶段,是反映机体抗氧化能力的重要指标[14-15]。本研究测定了大鼠脑缺血再灌注24h后脑组织中SOD、GSH和MDA的变化,结果显示,与假手术组比较,模型组SOD活性和GSH含量明显降低,MDA含量则明显升高,表明模型组大鼠体内氧自由基的生成水平增高,组织损伤程度加重。缺血再灌注后脑组织各类型NOS活性均明显升高,再次证实缺血再灌注后脑内自由基大量产生以及抗脂质过氧化功能的降低,自由基清除能力下降是其重要的损伤机制。经脑蛋白水解物注射液干预后,脑蛋白水解物注射液能显著升高缺血再灌注后大鼠脑组织SOD和NOS酶活性及GSH水平,降低MDA水平,表明脑蛋白水解物注射液可拮抗脑损伤后的自由基过多生成,对脑损伤后的自由基损伤具有保护作用。本研究结果还显示,在各剂量干预组SOD和NOS酶活性、GSH含量并未随脑蛋白水解物注射液剂量的增加而增加,MDA含量亦未见明显的剂量效应关系,表明脑蛋白水解物注射液达到一定剂量之后,其保护效应不再增强。
综上所述,大鼠脑缺血再灌注并经尾静脉注射脑蛋白水解物注射液治疗后,大鼠神经行为功能得到明显改善,其原因可能与脑蛋白水解物注射液增强细胞抗氧化系统功能或清除自由基有关,最终起到保护脑组织的作用。但关于脑蛋白水解物注射液的应用疗程及其抗凋亡作用等方面尚需进一步研究。
[1]熊文欣,李文峰.硫化氢对脑缺血再灌注损伤大鼠血清及脑组织NO和NOS的影响[J].现代中西医结合杂志,2010,19(16):1971-1972.
[2]谭华,何晓英,李小刚.大鼠局灶性脑缺血一再灌注后脑组织一氧化氮水平的实验研究[J].中国现代医学杂志,2008,18(9):1215-1217.
[3]杨养贤,延卫东,乔晋.黄芩苷对大鼠缺血再灌注脑组织TNF-α、IL-1β表达的影响[J].西安交通大学学报(医学版),2005,26(3):220-223.
[4]王竞,杜俊蓉.缺血性脑损伤机制的研究进展[J].国际药学研究杂志,2008,35(4):302-304.
[5]Candelario-Jalil E.Injury and repair mechanisms in ischemic stroke:considerations for the development of novel neurotherapeutics[J].Curr Opin Invest Drugs,2009,10(7):644-654.
[6]黄文胜.急性脑卒中患者血清一氧化氮、一氧化氮合酶、丙二醛、超氧化物歧化酶及过氧化脂质水平动态变化与病情预后分析[J].临床医学,2009,29(7):82-84.
[7]黄信全,王从平,陈开广.厚朴酚对大鼠局灶性脑缺血再灌注损伤保护作用的研究[J].中国神经免疫学和神经病学杂志,2007,14(2):118-119.
[8]杨霄鹏,李秋芳,杨瑞玲.丁苯酞预处理对抗大鼠脑缺血再灌注损伤后脑水肿的作用机制[J].中国老年学杂志,2012,12(4):269-272.
[9]吴云,梁庆成,王晓坤,等.西洛他唑对大鼠脑微血管内皮细胞缺血再灌注损伤的保护作用[J].中国神经免疫学和神经病学杂志,2011,18(2):106-109.
[10]胡跃强,肖 波,毕方方.依达拉奉对脑缺血再灌注后FADD、caspase-8表达的影响[J].中国神经免疫学和神经病学杂志,2007,14(1):20-22.
[11]方玲,王柠,吴志英.一氧化氮合酶在脑缺血再灌注中的双重作用[J].中国神经免疫学和神经病学杂志,2004,11(1):29-31.
[12]周洁,王建明,王岚.沙鼠前脑缺血再灌注后脑组织HSP20和EPO的表达变化及相关性[J].中国老年学杂志,2011,7(31):2519-2521.
[13]张释双,马静萍.粒细胞集落刺激因子对大鼠脑缺血再灌注损伤脑Caspase-3与细胞色素C表达的影响[J].中国神经免疫学和神经病学杂志,2011,18(4):269-272.
[14]Maksimova MIu,Briukhov VV,Timerbaeva SL,et al.Effectiveness of cerebrolysin in hypertensive supratentorial intracranial hemorrhages:results of a randomized triple blind placebo-controled study[J].Zh Nevrol Psikhiatr Im S S Korsakova,2009,109(1):206.
[15]赵峰,姜亚军.卒中治疗的抗氧化策略[J].国际脑血管病杂志,2006,14(6):401-410.
