术后不同放化疗时间窗及程序对高级别脑胶质瘤疗效的影响
2013-11-22王小文谢金龙
王小文 阳 波 谢金龙
高级别脑胶质瘤(high-grade glioma,HGG)是机体神经系统比较常见的难治性恶性肿瘤,发病迅速,死亡率高、生存时间短[1]。目前手术后进行放化疗的综合疗法被认为是提高HGG患者术后局部控制率的可接受的有效措施[2],但临床治疗效果仍然不能达到满意程度。我们通过前瞻性随机对照试验分析不同的放化疗时间窗及程序对HGG疗效的影响,现将结果报告如下。
1 资料与方法
1.1 一般资料
病例纳入标准:①术前经过CT或者MRI等影像学诊断,术后经病理活检确诊为HGG(WHOⅢ级~Ⅳ级)的初治脑胶质瘤患者;②手术方式为部分切除或(次)全肿瘤切除;③患者检查心肺功能、肝肾功能正常。病例排除标准:在随访中由于更换电话号码无法联系,或者中途退出,死亡原因无法确定者。选择我院2008年1月至2009年12月期间放射肿瘤科收治的符合纳入标准的HGG患者72例,随访截至时间2012年12月,病例随访时间6~48个月,平均随访时间36.5个月。72例中失访4例,失访率占5.56%。最后入组作为研究对象且随访资料完整的共68例。所有患者均签署知情同意书,符合医学伦理学研究要求。
1.2 方法
分组与治疗程序采用随机数字表法将68例患者分为2组,即化疗+放化疗+化疗组(C+RC+C)和放化疗+化疗组(RC+C),每组34例。C+RC+C组程序:患者术后1周开始替莫唑胺(TMZ)化疗(150 mg/m2,1次/天,治疗1周)。第2周开始放化疗,放疗剂量:2 Gy/次,5次/周,总量 50~60 Gy;替莫唑胺(TMZ):75 mg/m2,1 次/天,放疗全程;在5~6 周后继续TMZ辅助化疗(150~200 mg/m2,1次/天,28天1个周期)。RC+C组程序:术后2周进行放化疗治疗,放化疗剂量同C+RC+C组,即TMZ:75 mg/m2,1次/天,放疗全程同步化疗。5~6周后单独TMZ辅助化疗(150~200 mg/m2,1次/天,每28天1个周期)。
1.3 治疗效果判断标准
所有病例治疗效果的判断均结合核磁共振(MRI)和临床表现,按WHO实体瘤疗效评价标准进行疗效分级评估:完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)。有效率为 CR+PR,疾病控制率(DCR)为CR+PR+SD。
1.4 随访和观察指标
对所有患者进行随访,随访主要内容包括术后临床症状是否缓解,术后体征及影像学复查情况,评估患者无进展生存期(PFS)和生存期(OS)等。手术后1年内每3个月随访1次,第2年开始每6个月随访1次,随访截至时间为2012年12月。生存时间以手术时间开始计算,PFS指从手术时间到肿瘤复发或临床症状提示复发的时间,或肿瘤瘤体表现为无进展的时间,至随访时间出现复发或死亡为截尾数据;OS是指从手术时间至患者发生死亡的时间,随访结束未发生死亡或其他原因导致的死亡为截尾数据。
1.5 统计学方法
采用SPSS20.0统计软件包对数据进行处理。计量资料采用均数±标准差(±s)表示,组间比较采用t检验;计数资料采用构成比表示,组间比较采用χ2检验;术后生存多因素分析采用COX比例风险回归模型对预后因素进行判断,PFS和OS采用乘积极限法(Kapplan-Meier法)计算生存率和描述生存曲线,生存率比较应用Log-Rank方法。P<0.05为差异有统计学意义。
2 结果
2.1 2组患者基线资料的比较
2组患者在年龄、性别、肿瘤部位、KPS评分、肿瘤直径、手术切除范围等因素方面差异均无统计学意义(P<0.05),见表1。在放射治疗方面,2组间放疗总剂量、放疗分割剂量、放疗次数差异无统计学意义(P<0.05)。

表1 基线资料2组患者之间的比较(例,%)
2.2 近期疗效评价
术后治疗6个月后随访,C+RC+C组有效率为79.41%,RC+C 组为52.94%,差异有统计学意义(χ2=5.322,P=0.021);C+RC+C 组控制率达88.24%,RC+C 组为67.65%,差异有统计学意义(χ2=4.191 P=0.041)。见表2。
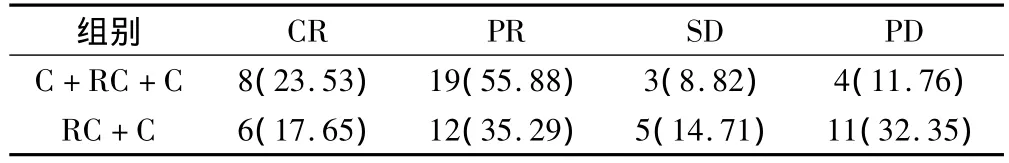
表2 2组患者近期随访有效率及控制率比较(例,%)
2.3 远期生存分析
经Kapplan-Meier生存曲线分析,C+RC+C组中位OS为18.6个月,RC+C组中位OS为16.5个月,差异无统计学意义(P=1.145)。C+RC+C组的中位PFS为9.5月,RC+C组中位 PFS为8.2月,差异有统计学意义(P=0.009),见图1。
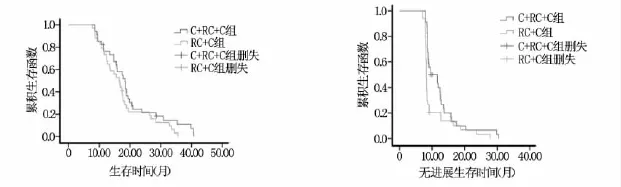
图1 2组患者生存期和无进展生存时间比较
2.4 COX回归多因素生存分析
对69例患者年龄、性别、病理分级、肿瘤直径、KPS评分等因素进行Cox多因素回归分析,病理诊断分级、KPS评分和肿瘤切除程度3个因素对胶质瘤患者的预后有影响,见表3。

表3 Cox回归分析患者术后生存率影响因素
3 讨论
高级别脑胶质瘤(high-grade glioma,HGG)是1种常见的神经系统恶性肿瘤,恶化程度高,患者预后极差,是目前比较难以治疗的神经肿瘤。在本次HGG预后影响因素的分析显示,病理分级、KPS评分和肿瘤切除程度是3个主要因素,与其他学者的研究结果一致[3]。HGG患者生存期比较短,通常Ⅲ级患者总生存期一般是2~5年,Ⅳ级的总生存期9个月~1年,本次研究WHOⅢ级生存率是WHOⅣ的0.34倍。KPS评分比较高的患者生存质量相对较好,其生理、心理状态较好,抵抗肿瘤的能力较强,与肿瘤的恶化程度存在相关性。手术全切除患者的生存期较长,次全切除的发生主要与肿瘤浸润组织难以区分,影像学成像技术还不能很清晰的区分肿瘤组织,医生的主观判断等因素有关,但也有研究显示,手术的切除范围与预后无明显关系,两者的相关性还有待进一步研究[4]。
HGG的手术治疗是主要的临床首先治疗方法,但由于其生物侵袭力强,组织浸润高,手术术野难以清晰区分,所以不管是全切除手术还是部分切除手术,术后均需要进行放化疗[5-6]。放射治疗可以通过释放 X线、γ-射线、离子等高能粒子束照射肿瘤组织,破坏肿瘤组织细胞内的DNA/RNA等大分子物质,感染肿瘤细胞的增殖,导致肿瘤细胞的凋亡[7]。但在达到有效放射剂量后,再增加剂量则不再增强治疗效果,而继续辅助进行化疗则可以明显延长患者生存期。一项前瞻性研究显示,化疗可以明显提高患者的PFS,延长患者OS[8-9]。TMZ是口服剂型,服用方便,同时研究证明其血液毒性、肝肾功能损害等副反应较少,且具有放疗增效作用,被作为脑胶质瘤术后患者化疗的首选药物[10-11]。也有研究报道采用血管内皮抑制素(Endostatin)联合化疗药物治疗晚期复发恶性脑胶质瘤患者取得了较好的效果[12]。
目前,HGG患者术后放、化疗联合治疗普遍被认为是可以接受的提高疗效的综合治理方案,对WHO IV级的胶质母细胞瘤(GBM)的作用比较明显[13]。临床多中心随机临床试验认为,与单纯放疗GBM患者对比,在术后放疗中、后期服用TMZ可以有效提高患者生存期,PFS 延长1.9 个月,中位 OS延长2.5 个月[2]。放化疗同时进行继之以TMZ辅助化疗目前逐渐成为广泛认可的脑胶质瘤综合治理方案,但其治疗效果还不是十分满意,为进一步研究探讨疗效,本文中在通常放化疗+后期化疗的前期进行早期化疗,患者PFS达9.5月,明显高于放化疗+化疗(RC+C组)组患者;患者OS为18.6月,高于对照组,但未表现出明显差别。说明C+RC+C治疗程序可以有效地延长患者无进展生存期,提高患者的生存率。其机理可能是因为手术后初期,血脑屏障开放,术后水肿带扩大等原因使化疗药物更容易到达肿瘤残余部位发挥细胞毒作用。有研究在对老年患者进行放、化疗治疗时,虽然可以提高其治疗效果,但同时HGG患者治疗后毒副反应发生率也上升至49%[14]。所以在对老年患者进行放化疗治疗时,要考虑患者身体状况,对患者进行生存质量评分评估,对制定适宜的放化疗方案,进行患者生存预后判断有很好的作用。
总之,HGG首选治疗方法仍是手术,在术后早期放疗采取术后早期化疗(TMZ)+放化同步+辅助化疗(TMZ)程序,可以有效提高患者无发展生存期,促进患者生存率的提高。
[1]杨群英,沈 冬,赛 克,等.初诊恶性脑胶质瘤患者综合治疗的生存情况分析〔J〕.中华医学杂志,2013,93(1):8.
[2]Stupp R,Hegi ME,Mason WP,et al.Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy along on survival in glioblastoma in randomized phaseⅢstudy:5-year analysis of the EORTC-NCIC trial〔J〕.Lancet Oncol,2009,10(5):459.
[3]王 鹏,焦保华.脑胶质瘤病人的预后多因素生存分析与相关性研究〔J〕.脑与神经疾病杂志,2010,18(6):417.
[4]李海燕,吕 明,陈兴栋,等.脑胶质瘤患者术后生存影响因素分析〔J〕.中华流行病学杂志,2009,30(5):507.
[5]李方明,田增民,聂 青,等.恶性脑胶质瘤TMZ联合同步放疗临床疗效探讨〔J〕.中国肿瘤临床,2009,36(13):721.
[6]段宝奇,高觉明,李海林,等.恶性脑胶质瘤手术联合放疗和化疗的疗效分析〔J〕.中国肿瘤外科杂志,2009,1(2):78.
[7]陈媛媛,汤金梁,龙海霞,等.低剂量超微分割与常规分割放疗对脑胶质瘤细胞的生物学效应比较〔J〕.第三军医大学学报,2012,34(11):1026.
[8]温居一,蒋富强,王 斌,等.术后放、化疗时序对高级别脑胶质瘤疗效的影响〔J〕.中华神经医学杂志,2012,11(11):1143.
[9]梁永平,马晓东,王宇博,等.高级别脑胶质瘤手术后联合放化疗疗效观察〔J〕.军医进修学院学报,2011,32(6):557.
[10]韩 倩,李 良,吴广银,等.不同放疗方式联合替莫唑胺治疗脑功能区恶性胶质瘤疗效观察〔J〕.中华放射医学与防护杂志,2010,30(5):574.
[11]翟小明,王建平,张军宁,等.成人脑恶性胶质瘤术后两种同步放化疗方案的疗效比较〔J〕.南方医科大学学报,212,32(2):255.
[12]苗振静,马晶洁,马旭辉,等.恩度联合尼莫司汀治疗复发脑胶质瘤的临床观察〔J〕.实用癌症杂志,2010,25(4):416.
[13]王计伟,陈步东,张春智,等.替莫唑胺治疗胶质母细胞瘤的长期疗效评价〔J〕.中华神经医学杂志,2012,11(1):57.
[14]Sijben AE,Me Intyre JB,Roldan GB,et al.Toxicity from chemoradiotherapy in older patients with glioblastoma multiforme〔J〕.J Neurooncol,2008,89(1):97.
