原发性肝细胞癌组织中P21的亚细胞定位及其意义
2013-11-22邱荣元王松柏刘崇梅冯喜华万焱鑫伍小琼何生松
易 玲 邱荣元 王松柏 刘崇梅 冯喜华 万焱鑫 伍小琼 何生松
原发性肝细胞肝癌(hepatocellular carcinoma,HCC)是世界上第五大常见恶性肿瘤,在癌症相关死亡原因中排名第三。尽管外科手术及肝移植治疗取得了很大进展,但肝癌的预后仍不乐观。
P21具有广泛的细胞周期抑制活性,理论上其与肝癌的发生发展及预后密切相关,然而国内外对其预测价值意见很不一致。目前认识到P21具有不同的功能状态,比如抑制细胞增殖与促进细胞增殖,抑制细胞凋亡与促进细胞凋亡。而P21的功能状态与亚细胞定位密切相关。
本课题组前期研究中[1-3],初步证实当P21定位于细胞质,胞质型P21促进HepG2细胞增殖、促进细胞周期运行、增强其抗凋亡能力。作为前期项目的延伸,本研究采用免疫组织化学的方法,检测原发性肝细胞肝癌组织中P21表达情况及其亚细胞定位,并探讨与临床病理参数的关系。
1 材料与方法
1.1 一般资料
收集2007年2月至2012年9月岳阳市第二人民医院、华中科技大学同济医学院附属协和医院收治的115例肝硬化基础上发生的肝癌病例资料及手术切除于病理科存档的石蜡包埋标本,其中包括同一病例的肝癌组织、癌旁组织、肝硬化组织。115例中,男性81例,女性34例;年龄16~71岁,平均年龄47岁,中位年龄 48岁;肿瘤直径平均 5.6 cm(1.5~12 cm)。根据 Edmondson-Steiner标准分级:Ⅰ-Ⅱ级 48例(41.74%)Ⅲ-Ⅳ级67例(58.26%)。HBsAg阳性98例(85.21%)。
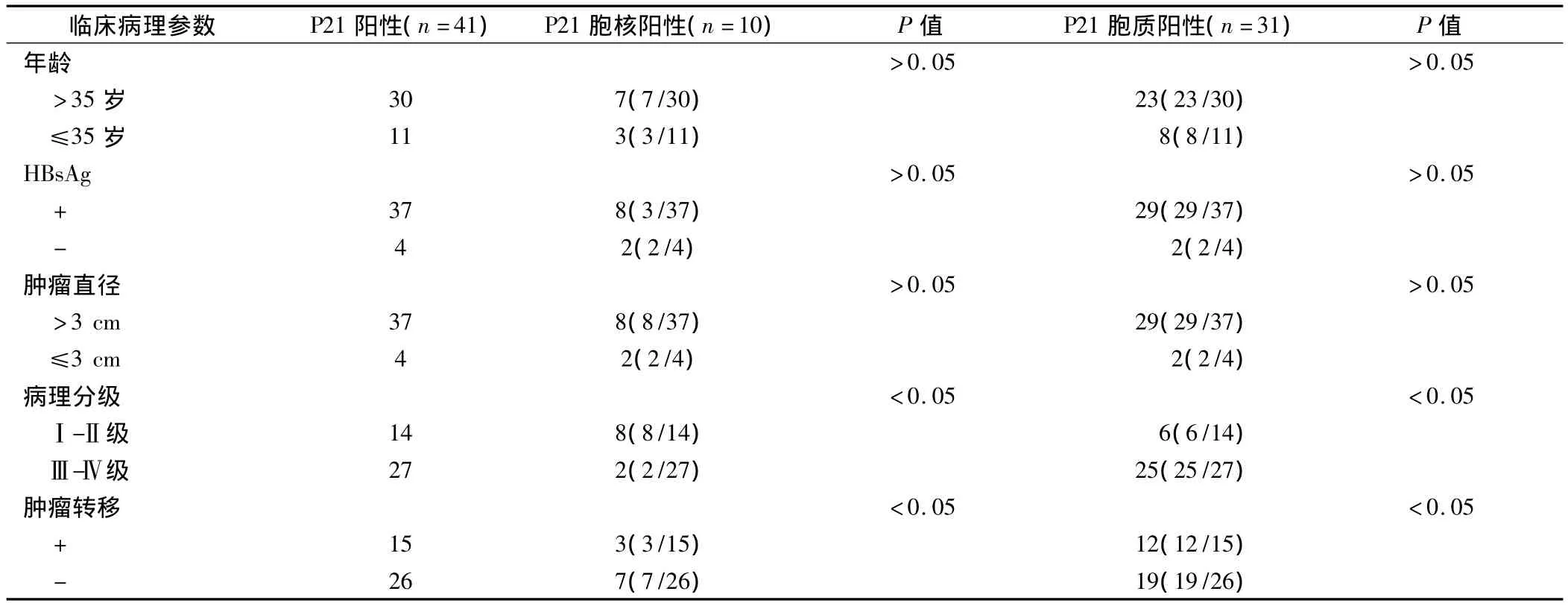
表1 P21阳性表达与HCC临床病理特征的关系
1.2 主要试剂
鼠抗 P21W AF/CIP1单克隆抗体(Neo Markers);SP试剂盒、DAB显色剂(北京中杉公司)。
1.3 方法
采用SP法,严格按照试剂盒操作说明进行P21免疫组化染色,采用柠檬酸高温高压法进行抗原修复,抗体稀释度为1:200,DBA显色,苏木精复染,脱水,透明,封片。以PBS和正常血清分别代替一抗与二抗作阴性对照。阳性细胞计数标准如下:每个位点随机选取3个高倍镜视野,平均每高倍镜阳性细胞<5% 为“-”,5%~25% 为“+”,26%~50% 为“++”,>50% 为“+++”。P21W AF/CIP 1阳性染色为胞质型或核型,淡黄色、棕黄色或棕褐色,呈颗粒状或团块状。
1.4 统计学方法
所有数据均用SPSS 13.0软件包作统计处理。各组阳性表达率差异的比较及与临床参数之间关系采用卡方检验;单因素相关分析采用Pearson相关法。多组之间的两两比较采用秩和检验法,求Hc值,推断P值范围。
2 结果
2.1 P21在肝脏不同组织中的表达
肝硬化组织中P21阳性表达率为10.43%(12/115),原发性肝细胞肝癌组织中阳性率为35.65%(41/115),癌旁组织为38.26%(44/115),肝癌与癌旁组织相比,差异无统计学意义(P>0.05),肝癌与肝硬化组相比,差异有统计学意义(P<0.01),癌旁与肝硬化组相比,差异有统计学意义(P<0.01)。
2.2 胞质型P21在肝脏不同组织中的表达
胞质型P21阳性率在癌旁组织中为6.82%(3/44),在肝硬化组织中为8.33%(1/12),在原发性肝细胞肝癌组织中为75.61%(31/41)。肝癌与癌旁组织及肝硬化组相比,胞质型P21阳性表达率的差异均有统计学意义(P<0.01);而癌旁与肝硬化组相比,差异无统计学意义(P>0.05)。
2.3 胞质型P21与肝癌组织临床特征的相关性
胞质型P21在肝癌组织中Ⅰ-Ⅱ级、Ⅲ-Ⅳ级的阳性率分别为 42.89%(6/14),92.59%(25/27),胞质P21的阳性表达与肿瘤细胞分化程度明显负相关(γ=-0.42,P<0.01),胞质型 P21 在肝癌组织中无转移及有转移的患者中阳性率分别为73.07%(12/15),80.00%(19/26),胞质 P21与肿瘤转移正相关(γ=0.27,P<0.05),而与年龄、HBSAg、肿瘤直径无关(P>0.05)。见表1。
3 讨论
P21是el-Deiry等于1993年发现的1种能够被p53转录激活的基因,编码分子量为21 kDa的蛋白,因此命名为P21[4]。P21具有众多蛋白质结合位点,其中某些部位相互重叠,如P21可与细胞周期素(cyclin)、细胞周期素依赖的蛋白酶(CDK)、增殖细胞核抗原(PCNA)、切冬酶原3(Procaspase 3)、MAPK家族分子、钙调蛋白等相互作用,此外还有核定位信号(nuclear locational signal,NLS)、核输出信号(nuclear export signal,NES),从而影响其亚细胞定位[5]。
P21蛋白最初因其细胞周期抑制活性而为人们所熟知,因而人们将其归属为抑癌基因的范畴。目前关于P21功能的研究,认识到P21涉及到细胞的生长、分化、凋亡、老化。并且,P21具有不同的功能状态,比如抑制细胞增殖与促进细胞增殖,抑制细胞凋亡与促进细胞凋亡[6-7]。而P21的功能状态与某些位点的磷酸化、亚细胞定位密切相关[8]。
P21的抑癌功能与其核定位密切相关,而胞核P21的促进细胞生长及抗凋亡能力在许多细胞的研究中得到证实,如在急性单核细胞性白血病[9]、人乳腺癌[10]、神经肿瘤性疾患[11]。
当P21定位于细胞质,可与细胞凋亡信号分子相结合,如与Procaspase 3结合,阻止Fas介导的凋亡途径[12-13],并且通过抑制促凋亡激酶(apoptosis signalregulating kinase 1,Ask1)而使抗凋亡效应进一步放大[14]。Tanaka等发现[15],胞质 P21 蛋白可与 Rho 激酶形成复合体并抑制其激酶活性,导致肌动蛋白应力纤维丢失,促进细胞外生性生长。在某些肿瘤性疾患中,也发现胞核P21蛋白表达与肿瘤浸润和转移的相关性,其机制可能为胞核P21抑制Rho激酶活性,肌动蛋白应力纤维丢失,细胞活动性增强,最终导致肿瘤的浸润和转移[11]。
目前关于P21的亚细胞定位与肝癌的关系,研究尚不多见,而关于P21与肝癌关系的报道极不一致,在肝癌组织中,P21的表达意义也未取得一致结论。
为达到上述研究目的,我们曾采用基因定点诱变的方法[1-3],构建了核定位信号突变的P21真核表达载体,转染HepG2细胞,观察转染的HepG2细胞周期及凋亡率的改变,进一步了解P21亚细胞定位与其功能活性的关系。
我们通过观察肝硬化基础上发生的原发性肝细胞癌患者,其肝癌组织、癌旁组织、肝硬化组织中P21的表达情况,亚细胞定位分布,结果显示 HCC与癌旁肝组织P21的表达无统计学意义,但通过亚细胞定位的分析表明,HCC主要表达在细胞质,其比例可达到75.61%,而癌旁肝组织胞质表达比例为6.82%。进一步根据肝癌组织的肿瘤细胞分化程度及肿瘤转移情况进行相关性分析,胞质P21的阳性表达与肿瘤细胞分化程度明显负相关,胞质型P21的阳性表达与肿瘤转移正相关。
本组研究表明,在肝硬化组织中,由于炎症和纤维化影响,P21表达上调,但主要定位于细胞核,其表达率与炎症及纤维化程度密切相关。而在肝癌组织,P21也可见表达上调,但主要定位于细胞质,而且胞质表达的比例与肿瘤分化程度、肿瘤转移密切相关。因此,细胞质P21的高表达,可能有助于原发性肝癌的发生、发展。虽然P21具有广泛的细胞周期抑制活性,但既往以P21为靶点的抗肿瘤治疗,并没有取得令人鼓舞的临床效果,考虑可能与忽视了P21蛋白的功能状态与其亚细胞定位密切相关,因此,从亚细胞定位角度,调整P21的抗肿瘤治疗策略,也许是条可行的途径。
[1]邱荣元,何生松,陈 锋,等.P21真核表达载体的构建及其对HepG2细胞增殖影响〔J〕.世界华人消化杂志,2009,17(26):2662.
[2]邱荣元,何生松,陈 锋.核定位信号突变型 P21对HepG2.2.15细胞病毒复制的影响〔J〕.临床肝胆病杂志,2010,26(4):387.
[3]Rongyuan Qiu,Songbai Wang,Xihua Feng.Effect of subcellular localization of P21 on cell proliferation and apoptosis of HepG2〔J〕.J Huazhong Univ Sci technol,2011,31(6):756.
[4]e-Deiry WS,Tokino T,Velculescu VE,et al.WAF1,a potential mediator of p53 tumor suppression〔J〕.Cell,1993,75(4):817.
[5]Child E S,Mann D J The intricacies of P21 phosphorylation:protein/protein interactions,subcellular localization and stability〔J〕.Cell Cycle,2006,5(12):1313.
[6]Roninson IB.Oncogenic functions of tumour suppressor P21(Waf1/Cip1/Sdi1):association with cell senescence and tumour-promoting activities of stromal fibroblasts〔J〕.Cancer Lett,2002,179(1):1.
[7]Dotto GP.P21(WAF1/Cip1):more than a break to the cell cycle?〔J〕.Biochim Biophys Acta,2000,1471(1):143.
[8]Zhou B P,Y liao,W Xia,et al.Cytoplasmic localization of P21WAF1/CIP1 by Akt-induced phosphorylation in HER-2/neu-overexpressing〔J〕.Nat Cell Biol,2001,3(3):245.
[9]Schepers H,Geugien M,Eggen BJ,et al.Constitutive cytoplasmic localization of P21(Waf1/Cip1)affects the apoptotic process in monocytic leukaemia〔J〕.Leukemia,2003,17(1):2113.
[10]Pérez-Tenorio G,Berglund F,Esguerra Merca A,et al.Cytoplasmic P21WAF1/CIP1 correlates with Akt activation and poor response to tamoxifen in breast cancer〔J〕.Int J Oncol,2006,28(5):1031.
[11]戴 嵩,黄维国,甘晓凡,等.p21和PCNA在喉原发性鳞癌中的表达〔J〕.实用癌症杂志,1998,6(2):89.
[12]Suzuki A,Tsutomi Y,Akahane K,et al.Resistance to Fasmediated apoptosis:activation of caspase 3 is regulated by cell cycle regulator P21WAF1 and IAP gene family ILP〔J〕.Oncogene,1998,17(8):931.
[13]Suzuki A,Tsutomi Y,Miura M,et al.Caspase 3 inactivation to suppress Fas-mediated apoptosis:identification of binding domain with P21 and ILP and inactivation machinery by P21〔J〕.Oncogene,1999,18(5):1239.
[14]Asada M,Yamada T,Ichijo H,et al.Apoptosis inhibitory activity of cytoplasmic P21(Cip1/WAF1)in monocytic differentiation〔J〕.EMBO J,1999,18(5):1223.
[15]Tanaka H,Yamashita T,Yachi K,et al.Cytoplasmic P21(Cip1/WAF1)enhances axonal regeneration and functional recovery after spinal cord injury in rats〔J〕.Neuroscience,2004,127(1):155.
